Introducción
Hantavirus representa una zoonosis emergente transmitida al hombre a través de la orina, saliva o excretas de roedores que presentan una infección crónica asintomática con viremia persistente1,2.
Se trata de una infección endémica en al menos 13 países de las Américas. Desde 1993 hasta 2016, más de 6.300 casos se han registrado en países de la región donde la enfermedad está bajo vigilancia de la Organización Panamericana de la Salud (OPS). Cada año se reportan aproximadamente 300 casos nuevos1.
Los hantavirus son un género perteneciente a la familia Bunyaviridae. Su nombre proviene del río Hantaan, en el sur de Corea, cerca del cual se aisló originalmente en 1978. Este género cuenta con 14 especies reconocidas que se identifican y clasifican actualmente en genotipos por la composición y secuencia de su ácido ribonucleico (ARN). En la región de las Américas, entre los genotipos más frecuentes se encuentran Andes, Orán, Lechiguana, Bermejo y Laguna Negra1,3,4. Estos causan dos formas graves de enfermedad, la fiebre hemorrágica con síndrome renal (FHSR), observada con mayor frecuencia en Asia y en Europa, y el síndrome cardiopulmonar por hantavirus (SCPH), más prevalente en América1.
En la sospecha diagnóstica es importante reconocer las manifestaciones compatibles considerando los antecedentes ambientales o contacto con casos confirmados. La confirmación requiere estudios serológicos mediante enzimoinmunoanálisis de adsorción (ELISA) con determinación de IgM específica o seroconversión de IgG, técnicas moleculares, o ambas, o cultivo viral2,5-7.
En Uruguay la enfermedad se presenta con un comportamiento endémico estacional. Desde 1997, el Ministerio de Salud Pública (MSP) inició la vigilancia y el diagnóstico de SCPH. Hasta el año 2020 se habían identificado 281 casos, afectando principalmente a jóvenes procedentes mayoritariamente de los departamentos del sur del río Negro (Montevideo, Canelones, Colonia, San José y Soriano)8,9.
En el año 2003, Bello y colaboradores comunicaron el primer caso pediátrico de síndrome pulmonar por hantavirus a nivel nacional, en 2009 Mas y colaboradores publican una serie de seis casos pediátricos asistidos entre los años 1999 y 2009 con SCPH10,11.
Previo a 2018, se registraba en Uruguay un aumento sostenido de la tasa de incidencia de enfermedad por hantavirus. En los últimos años se observó una disminución, probablemente vinculada al advenimiento de la pandemia por SARS-CoV-2 que implicó una disminución de la circulación de personas8,9.
A continuación, se describe un caso de hantavirus con presentación de FHSR, forma clínica no reportada hasta el momento en la edad pediátrica en nuestro país.
Caso clínico
Cuatro años, sexo femenino, procedente de zona urbana del interior de Uruguay; medio socioeconómico y cultural aceptable. Buen crecimiento y desarrollo. Inmunizaciones vigentes. Crisis febril a los 3 años.
Su padrastro falleció 15 días antes con diagnóstico de sepsis a punto de partida respiratoria. IgM para hantavirus indeterminada. Roedores en el vecindario. Vecina fallecida hace dos años por hantavirus.
Comenzó 48 horas previas a la consulta con vómitos escasos, una deposición líquida sin elementos anormales y dolor centro abdominal tipo cólico. En consulta ambulatoria se realiza diagnóstico de gastroenteritis aguda indicando tratamiento higiénico dietético.
A las 24 horas agregó fiebre 39 °C axilar, rinorrea serosa y tos catarral, sin dificultad respiratoria. Decaimiento marcado. Tránsito urinario sin alteraciones.
Examen físico: Glasgow 15, temperatura axilar 37,9 ºC, FC 102 cpm, FR 24 rpm, no tirajes, PA 100/60 mmHg y saturación de oxígeno ventilando al aire 98%. Bien hidratada y perfundida. Petequias en piel y mucosas. Resto del examen, normal.
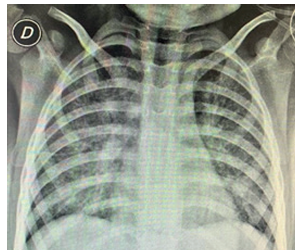
Estudios complementarios: hemoglobina 12,5 g/dL, hematocrito 38,4%, leucocitos 15,0 x 109/L (neutrófilos 45%, linfocitos 10%), plaquetas 30 x 104/L. Proteinemia total 5,6 g/dL, albuminemia 3,0 g/dL. Aspartato aminotransferasa 107 UI/L, alanino aminotransferasa 10 UI/L, fosfatasa alcalina 126 UI/L, gamma glutamil transferasa 12 U/L, lactato deshidrogenasa 1557 U/L, colinesterasa sérica 5185 U/L. Azoemia 0,58 g/L, creatininemia 0,68 mg/dL. Tiempo de protrombina 91% (11,8 segundos), INR 1,03, APTT 38 segundos, fibrinógeno 316 mg/dL. Antígenos de adenovirus, virus sincitial respiratorio e influenza A y B negativos en muestra de secreciones nasofaríngeas. La radiografía de tórax mostró infiltrado intersticial difuso (Figura 1).
Se inicia antibioticoterapia (ceftriaxona) y se coordina el traslado al Hospital Pediátrico del Centro Hospitalario Pereira Rossell (HP-CHPR).
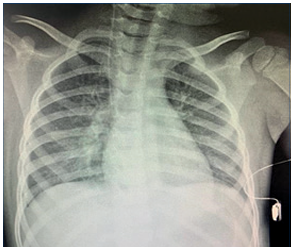
Evolución: a las 12 horas del ingreso hospitalario permanece febril, con palidez cutáneo-mucosa, aumento de lesiones hemorragíparas y presenta dos episodios de hematemesis. Fue derivada a unidad de cuidados intensivos (UCI). Presentó convulsión generalizada tonicoclónica con fiebre, que cede con benzodiacepinas. No reitera el episodio. Electroencefalograma normal. Se inicia tratamiento con levetiracetam. Se constató deterioro de las cifras de creatinina sin criterios de sustitución de la función renal. Agravación de la plaquetopenia, requiriendo transfusión de plaquetas y una dosis de inmunoglobulina intravenosa (IGIV). Se mantiene sin insuficiencia respiratoria; en la radiografía de tórax persiste infiltrado intersticial difuso, agregando discreto derrame pleural a derecha (Figura 2). Ecocardiograma: fina lámina de derrame pericárdico con fracción de eyección del ventrículo izquierdo normal. Ecografía abdominal y renal sin alteraciones.
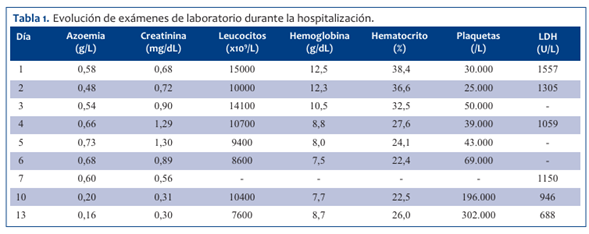
Hemocultivo y urocultivo sin desarrollo. Serología para virus de la inmunodeficiencia humana (VIH) y VDRL no reactivos. Serología para leptospira negativa. IgM para hantavirus positivo. En la (Tabla 1) se muestra la evolución de los hallazgos de laboratorio.
A los 7 días, egresó a sala de cuidados moderados, otorgándose el alta a los 14 días, asintomática, con hemograma y función renal normales. A los 7 días del egreso hospitalario, se recibe IgG positiva para hantavirus.
Discusión
Se describe el caso clínico de una niña de 4 años previamente sana, con infección por hantavirus con forma de presentación clínica atípica para la región de las Américas. Como fue descrito previamente, en esta región predomina la forma SCPH y no la FHSR.
En el FHSR suelen describirse cinco fases distintas: febril, hipotensiva, oliguria, poliuria y convalecencia. Si bien la mayoría de los casos se ha reportado en adultos, los niños con esta enfermedad pueden tener presentaciones atípicas que conducen a un diagnóstico tardío o erróneo6,7.
La fase febril se presenta con fiebre alta, malestar general, decaimiento, cefalea, dolor abdominal y lumbar, náuseas, vómitos, hemorragia y visión borrosa.
Las manifestaciones clínicas iniciales son indistinguibles a las de otras infecciones prevalentes de etiología viral o bacteriana1. Los síntomas respiratorios que la paciente presentaba no son frecuentes en esta etapa, lo que llevó al planteo diferencial de infecciones respiratorias frecuentes6,7.
La fase febril es seguida por la hipotensiva, puede durar de horas a días y se caracteriza por trombocitopenia, causa del aumento de la permeabilidad vascular. El aumento de la pérdida de proteínas que ocurre en los días 3 a 7 del inicio de la fase febril es una característica de la FHSR grave y produce proteinuria masiva en la mayoría de los casos. En esta fase, 15% de los pacientes experimentan shock y confusión mental6. Como es habitual, esta paciente presentó plaquetopenia, petequias generalizadas y hemorragia digestiva, requiriendo transfusión de plaquetas e IGIV.
El 60% de los sobrevivientes presenta una fase de oliguria durante 3 a 7 días. La insuficiencia renal es la causa principal de muerte en esta etapa. La afectación renal se manifiesta con proteinuria, hematuria y disminución del filtrado glomerular2,6-15. En esta niña se evidenció oliguria y aumento de la azoemia y creatininemia, se realizó tratamiento con diuréticos, sin requerir sustitución renal. La base fisiopatológica es la lesión vascular endotelial y nefritis túbulo-intersticial mediada por citoquinas. El compromiso renal se asocia a peor pronóstico14,15.
Es también un hallazgo habitual la colección perirrenal, el derrame pleural, pericárdico o la ascitis16. En esta paciente se observó derrame pleural y pericárdico leves. Durante esta fase, la tendencia a sangrar se vuelve más marcada y se observan varias combinaciones de hemorragia cerebral, gastrointestinal y púrpura extenso. La afectación del sistema nervioso central y el edema pulmonar ocurren en casos severos6.
El tratamiento generalmente es de sostén y depende de la gravedad. La literatura señala en algunos casos el uso de corticoides, anticuerpos monoclonales y ribavirina con el objetivo de reducir la mortalidad; sin embargo, no es del todo conocida su efectividad, siendo necesarios más estudios para determinar su papel en el abordaje terapéutico1,6,10-17.
La fase poliúrica puede durar días o semanas, se suele objetivar la mejoría de la función renal y aumento de la diuresis como indicadores de buen pronóstico6-9. Posteriormente los pacientes pasan a una etapa de convalecencia de duración variable, si bien la mayoría suele recuperarse completamente, algunos presentan secuelas como trastornos visuales y auditivos1,18. Por este motivo, previo al egreso hospitalario se coordinó seguimiento con oftalmología y otorrinolaringología.
Las pruebas serológicas siguen siendo la técnica de elección para hacer el diagnóstico. A comienzos de la enfermedad con frecuencia se hallan anticuerpos específicos contra inmunoglobulina M e IgG. En casos graves de presentación súbita la IgG puede ser negativa. No es útil hacer cultivo viral. La tinción inmunohistoquímica de tejidos puede establecer diagnóstico en necropsias9,19. En este caso el planteo diagnóstico surgió rápidamente orientado por el antecedente epidemiológico del fallecimiento del padrastro en una región con elevada incidencia de la enfermedad y antecedentes de fallecimientos previos por ésta. Es posible que dicho caso correspondiera a una forma SCPH con un estudio serológico precoz. En esta oportunidad no se realizó la genotipificación del virus, aspecto relevante para una mejor comprensión de la epidemiología y patogenia de la enfermedad.
La letalidad referida en la población general varía entre 30% y 50%. Sin embargo, son pocos los casos reportados en menores de 12 años2,6,7,20.
Todas las personas que no han sido infectadas por hantavirus son susceptibles de contraer la enfermedad. Aunque se desconoce la duración de la protección inmunológica dada por la infección, tampoco se han documentado casos de reinfección. Se considera que presentan mayor riesgo de exposición para contraer el virus los hombres jóvenes relacionados a tareas de campo. La enorme mayoría de los casos tiene el antecedente de contacto con roedores o haber realizado tareas de riesgo8. La transmisión ocurre a través del contacto con excrementos o secreciones de roedores infectados con las mucosas conjuntival, nasal o bucal, o de la mordedura de éstos21. Existe evidencia epidemiológica y virológica de transmisión persona a persona en relación con el virus Andes en el sur de Argentina, y, por ello, las secreciones y otros fluidos humanos deben considerarse potencialmente peligrosos en los casos de atención a pacientes con infección por hantavirus21. En pacientes con FHSR se ha demostrado la transmisión por ingesta de alimentos o agua contaminada. No existe evidencia de transmisión vertical del virus22.
Aunque la infección por hantavirus es un problema de salud mundial, cerca del 90% de los casos son notificados en China. Las infecciones infantiles son poco frecuentes, esto podría deberse a un diagnóstico insuficiente dadas las manifestaciones clínicas inespecíficas5,6.
Entre 1997 y 2007, en Uruguay fueron reportados 97 casos de hantavirosis. En 2018 se registraron 22 casos en todo el país, la mayoría en los departamentos de Canelones, San José y Montevideo8. Este constituye el primer caso pediátrico comunicado a nivel nacional de una infección por hantavirus con manifestación clínica de FHSR.
Son de suma importancia las medidas dirigidas a la prevención primaria del agente etiológico, entre estas: evitar la convivencia y contacto con roedores vivos o muertos, así como con sus secreciones, limpieza adecuada del domicilio en especial de lugares cerrados y de almacenamiento, ventilación de por lo menos 30 minutos de lugares que hayan estado cerrados por un período largo de tiempo (galpones, viviendas). Las personas que presenten síntomas de la enfermedad deben buscar atención médica y evitar el contacto estrecho con otras personas, además de las medidas de bioseguridad para trabajadores del área de la salud y el adecuado manejo de muestras biológicas de los pacientes9,20-24. En este caso se realizó la notificación correspondiente al MSP. Esta zoonosis se encuentra dentro de las enfermedades de notificación obligatoria grupo A. El laboratorio del MSP confirmó el diagnóstico.
Conclusiones
Los hantavirus son una zoonosis poco frecuente con alta mortalidad. Debe mantenerse alta sospecha diagnóstica en pacientes con contacto epidemiológico y considerar las diferentes formas de presentación de esta enfermedad. El tratamiento es de sostén y requiere una monitorización clínica continua. No siempre se presenta con afectación cardiopulmonar. La identificación temprana de los casos permite mejorar la sobrevida mediante la aplicación oportuna de medidas de apoyo e implementar el control ambiental.