Introducción
El cáncer de cuello (CC) uterino representa un problema de salud pública, siendo la cuarta causa de muerte por cáncer en mujeres a nivel mundial. Posee un impacto mayor en países en vías de desarrollo, evidenciando la distribución desigual de la enfermedad1. En Uruguay, el CC ocupa en las mujeres el tercer lugar en incidencia y el quinto en mortalidad, con un aproximado de 311 casos nuevos y 133 fallecimientos anuales2.
El tratamiento del CC es guiado por la estadificación de la Federación Internacional de Ginecología y Obstetricia (FIGO), ajustado a medida de la paciente y en forma multidisciplinaria3.
El compromiso ganglionar metastásico es el factor pronóstico más importante en la sobrevida y crucial para determinar un tratamiento adecuado4-6. Si se identifican metástasis ganglionares en la cirugía primaria, la tasa de supervivencia a cinco años decrece de 85% a 50%7.
Clásicamente la valoración ganglionar se realizó mediante la linfadenectomía pélvica sistemática. Esta técnica asocia un considerable riesgo de complicaciones: linfedema de miembros inferiores, linfocele pélvico, lesión vascular y afectación nerviosa8,9.
Actualmente la técnica recomendada por guías clínicas internacionales para el abordaje linfático en CC en estadios precoces es el ganglio centinela (GC) con el objetivo de evitar linfadenectomías innecesarias y realizar la detección más adecuada del compromiso ganglionar10.
La biopsia del GC linfático es un método de diagnóstico que se utiliza para determinar el estado de los ganglios linfáticos locales y regionales de los tumores sólidos al tomar una muestra específica en lugar de realizar una linfadenectomía completa11. Suponiendo una progresión ordenada del flujo linfático, predice el estado de la cadena ganglionar. Si el GC es negativo, el resto de los ganglios linfáticos de la cadena homolateral debe estar libre de enfermedad, y no sería razonable realizar linfadenectomía completa12.
Se estima que entre 15% y 20% de las pacientes con CC uterino temprano presentan metástasis en los ganglios linfáticos, lo que significa que más del 80% de las pacientes se sometería a una linfadenectomía pélvica innecesaria12,13.
La técnica de GC demostró una sensibilidad de 92% y un valor predictivo negativo de 98,2%, con menor frecuencia de las complicaciones mencionadas8,9.
El GC se puede identificar durante la cirugía por linfogammagrafía con tecnecio 99m (99mTc), colorante azul, verde de indocianina (ICG), con posterior examen histopatológico de los ganglios detectados utilizando sección congelada, hematoxilina-eosina (H y E) o ultraestadificación con cortes en serie e inmunohistoquímica (IHQ) utilizando el anticuerpo anticitoqueratina13.
Otra de las ventajas del GC es estudiar los ganglios linfáticos con mayor probabilidad de albergar metástasis tumorales. El mapeo del GC permite identificar patrones inesperados de drenaje linfático que, de otro modo, se pasaría por alto por disección estándar, y realizar un examen patológico mejorado (ultraestadificación) que, de otra manera, sería impracticable en una linfadenectomía de rutina, aumentando la tasa de detección de metástasis, incluyendo la identificación de micrometástasis y células tumorales aisladas (ITC)8,12,14.
En cuanto a la curva de aprendizaje para optimizar las tasas de detección del GC, Fady Khoury-Collado y colaboradores demostraron que alcanzar un volumen quirúrgico de 30 casos de GC mejora las tasas de detección15.
El objetivo de este estudio es validar la técnica del GC en CC uterino en el Centro Hospitalario Pereira Rossell (CHPR), lugar de referencia nacional en patología ginecológica oncológica.
Material y método
Se realizó un estudio prospectivo, longitudinal, de casos en el que se incluyó a usuarias con CC uterino en estadios iniciales, en el período comprendido entre enero de 2018 y noviembre de 2022.
Se planteó obtener 30 casos de GC más linfadenectomía sistemática en todos los casos de GC negativo, con una tasa de falsos negativos menores a 5% y una tasa de detección de más de 90%. Para los casos de GC positivo, no se completa la linfadenectomía pélvica y se reclasifica a la paciente como estadio avanzado para un correcto tratamiento.
La muestra fue de 30 casos, lo cual es considerado estándar de validación de la técnica.
Los criterios de inclusión fueron: usuarias con diagnóstico de CC primario mediante biopsia o cono biopsia, estadio clínico y paraclínico (examen clínico y resonancia nuclear magnética de pelvis) FIGO 2018: IA1 con invasión linfovascular, IA2, IB1, IIA1, que hayan aceptado participar del estudio previa información y firma del consentimiento informado.
Se excluyeron del procedimiento usuarias que hubieran recibido radioterapia o quimioterapia previa; que tuvieran como antecedente quirúrgico una linfadenectomía pélvica; que estuvieran cursando un embarazo, con terreno alérgico documentado; estudios de imagen con adenopatías sospechosas de compromiso metastásico, o que no acordaron participar del estudio mediante la firma del consentimiento informado.
Las cirugías se realizaron en el Hospital de la Mujer por parte del equipo de ginecología oncológica de la Clínica Ginecotocológica A de la Facultad de Medicina y por la Unidad de Ginecología Oncológica del Hospital de la Mujer.
Los resultados se procesaron de manera anónima en la base de datos de la Clínica Ginecotocológica A y se procesaron con Open EPI.
Técnica
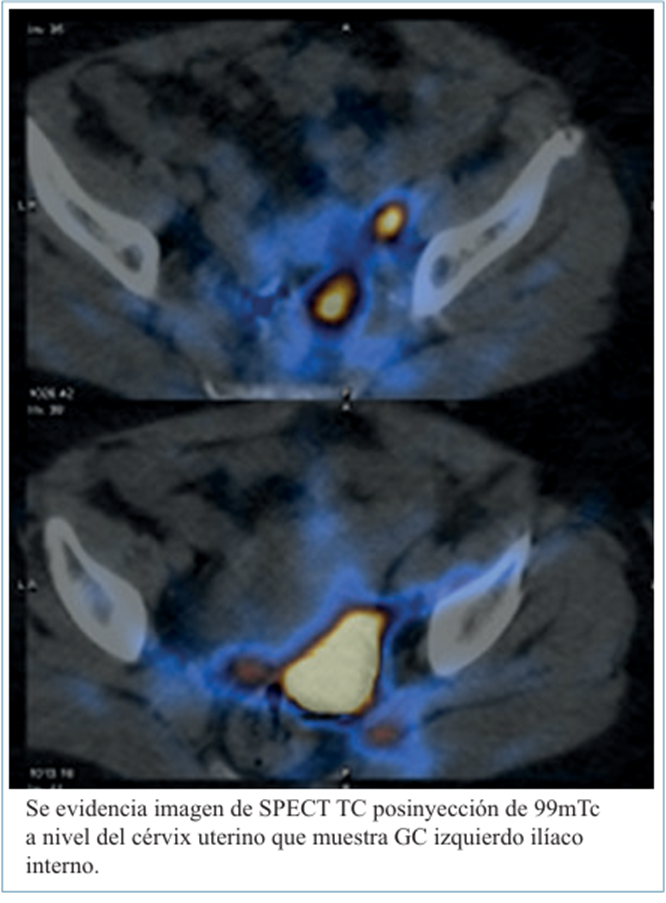
El marcado del GC se realizó con 99mTC, el día previo a la cirugía, inyectando 1 mCU del reactivo a nivel submucoso, con aguja de 27G, horas 12, 3, 6 y 9, lentamente (figura 1), obteniendo posteriormente imágenes de Spect TC para mejorar la localización de los ganglios calientes previo al procedimiento (figura 2).
En el intraoperatorio la identificación del o los GC se realizó con sonda detectora (Gammaprobe), mediante introducción de ésta al campo operatorio, la cual marcó las zonas con mayor contaje radioactivo, permitiendo la identificación de ganglios en vistas a su extracción.
Se resecaron todos aquellos ganglios linfáticos con actividad mayor a 10% del ganglio de mayor marcación. Se resecaron, además, todos los ganglios sospechosos de compromiso clínico.
Una vez extraídos, se verificó la no existencia de actividad sospechosa a nivel del lecho quirúrgico.
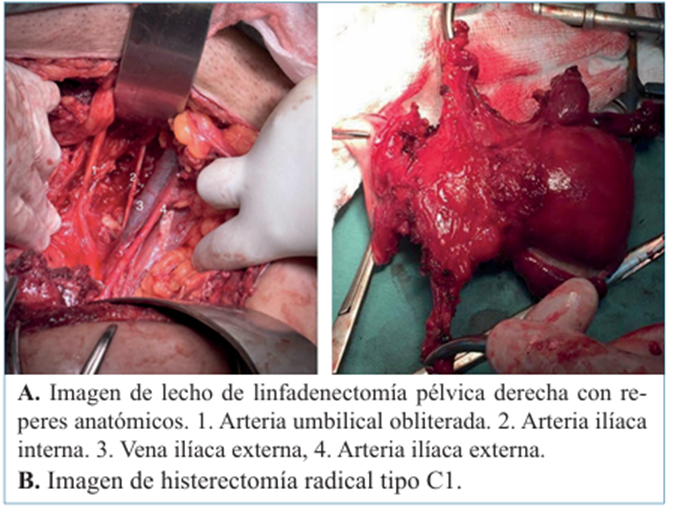
Una vez realizado este procedimiento, en todos los casos se realizó linfadenectomía pélvica bilateral sistemática e histerectomía radical de acuerdo a la técnica planteada en cada caso (figura 3).
El procesamiento anatomopatológico fue llevado a cabo en el Laboratorio de Anatomía Patológica y Citología del Hospital de la Mujer, con amplia experiencia en el procesamiento de GC de mama, vulva y endometrio.
Se enviaron los GC extraídos en fresco, que fueron procesados de acuerdo a protocolo que incluye la obtención de dos láminas por ganglio teñidas con H y E, previa fijación corta con alcohol al 95% (figura 4).
Los extendidos citológicos fueron analizados en el estudio intraoperatorio por dos patólogos entrenados.
El diagnóstico intraoperatorio fue informado de acuerdo a los siguientes criterios:
- Extendidos citológicos positivos: en casos en que fuera inequívoca la presencia de células epiteliales atípicas.
- Extendidos citológicos negativos: casos sospechosos y sin evidencias de células epiteliales atípicas.
Los ganglios no centinelas (GNC) se estudiaron en diferido con la misma metodología del estudio diferido del GC.
Para el diagnóstico diferido se utilizó la técnica de ultraestadificación (figura 4).
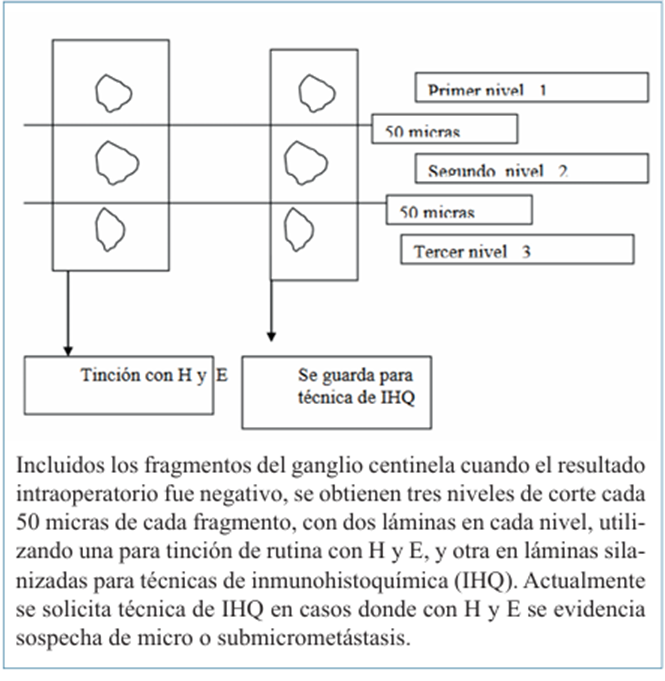
Figura 4 Procesamiento anatomopatológico del ganglio centinela, protocolo de estudio diferido. Departamento de Anatomía Patológica y Citología. Hospital de la Mujer “Dra. Paulina Luisi” (elaboración propia).
Al momento de corte, se obtuvieron tres láminas en cada nivel, una para tinción de rutina con H y E y dos en láminas silanizadas en blanco (sin teñir) para eventuales técnicas de IHQ. La IHQ fue realizada en casos de sospecha de micro o submicrometástasis.
Criterios anatomopatológicos utilizados:
Macrometástasis o metástasis ganglionar: metástasis > 2 mm.
Micrometástasis: depósitos de tumor entre 0,2 y 2 mm.
Submicrometástasis (células tumorales aisladas, células en tránsito): células aisladas o en grupos que miden menos de 0,2 mm de tamaño.
Falsos positivos: casos donde inicialmente en el estudio intraoperatorio se informó como positivo y en el estudio diferido no se encuentran células comparables a las células neoplásicas del tumor primario de cuello uterino, ya sea con técnicas convencionales o con técnicas de IHQ.
Cambio de estatus: casos donde no se observaron en el estudio intraoperatorio células neoplásicas y sí se encuentran tanto con técnicas convencionales como con técnicas de IHQ en el diferido del GC. También se incluyen casos con presencia de submicrometástasis confirmadas con técnicas de IHQ.
Normas éticas
Se presentó el protocolo de validación del GC, desarrollado por el equipo asistencial de la Clínica Ginecotocológica A de la Facultad de Medicina y el Laboratorio de Anatomía Patológica del Hospital de la Mujer del CHPR, al Comité de Ética hospitalario recibiendo la aprobación correspondiente.
En todos los casos se obtuvo el consentimiento informado previo al procedimiento.
Resultados
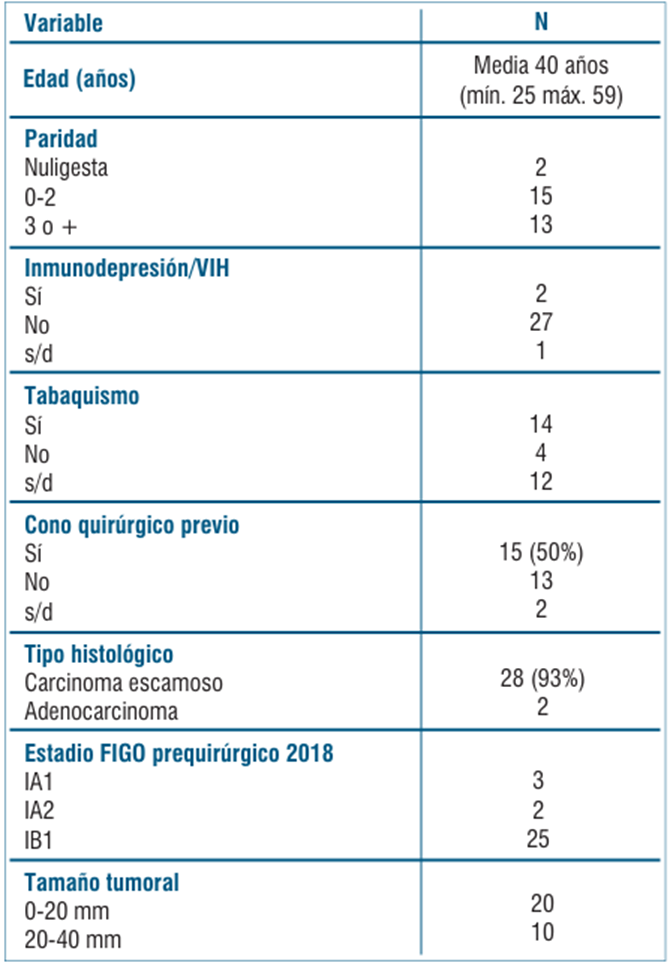
Se incluyeron 30 pacientes en el estudio. En la (tabla 1) se muestra la caracterización de la población. Las edades de las pacientes incluidas oscilaron entre 25 y 59 años, con una media de 40 años. Dos pacientes fueron nuligestas y 28 presentaron uno o más partos. Dos pacientes presentaban como cofactor inmunosupresión por VIH. El tabaquismo activo o en abstinencia no estaba registrado en el 40% de los casos, lo que corresponde a 12 pacientes. De las que sí contamos con datos, el 77,7% era tabaquista.
En cuanto al tipo histológico, 93% se trató de carcinoma escamoso y el 7% de adenocarcinoma. Se constató un tamaño tumoral entre 0 y 20 mm para 20 pacientes y entre 20 y 40 mm para 10 pacientes.
Mapeo de nodos linfáticos
Las 30 pacientes recibieron inyección del radiotrazador 99mTc, según protocolo mencionado, obteniendo imágenes preoperatorias de SPECT TC (figura 2) y se les realizó biopsia de todos los GC detectados en el intraoperatorio.
Tasa de detección de ganglio linfático
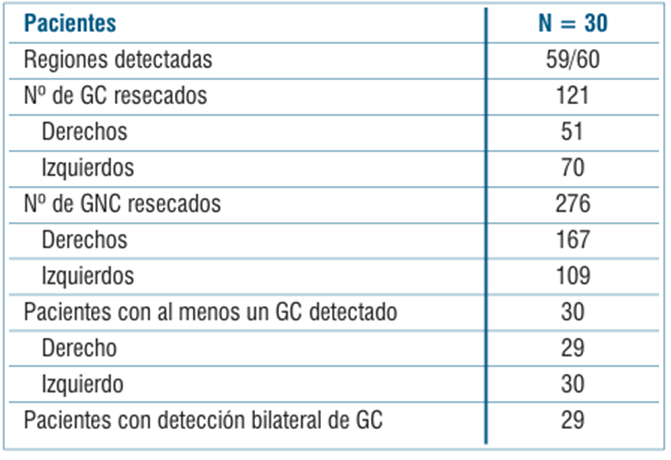
Los hallazgos ganglionares se muestran en la (tabla 2). El porcentaje de detección por región fue de 98,3%, con una media de dos GC resecados por región. En cuanto a los GNC se resecó una media de 5 GNC a derecha (máximo 14, mínima 1), y de 3 GNC a izquierda (máximo 8, mínima 1).
En cuanto a la performance diagnóstica de GC, los resultados se muestran en la (tabla 3). De las 30 pacientes incluidas en el estudio, en 29 de ellas la detección fue bilateral, en una no se logró marcación a derecha, por lo cual se realizó la linfadenectomía como estaba previsto. La tasa de detección por paciente fue de 96,6% y por hemipelvis de 98,3%.
Tabla 3 Performance diagnóstica de la técnica de GC con lin fogammagrafía con 99mTc en pacientes con cáncer de cuello en estadio precoz (elaboración propia).
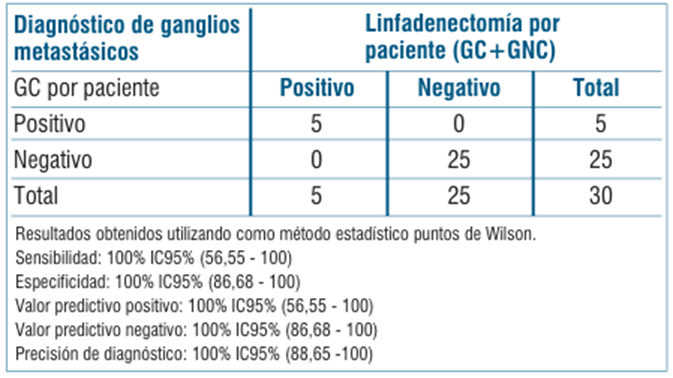
Fueron encontradas metástasis ganglionares en siete GC de cinco pacientes.
De los GC metastásicos, seis fueron macrometástasis, y uno correspondió a una micrometástasis a izquierda, habiendo un cambio de estatus vinculado a la micrometástasis detectada por ultraestadificación.
En los especímenes de linfadenectomía pélvica se identificaron 276 GNC. Ninguno de los GNC fue positivo, por lo que la tasa de falso negativo fue 0%.
No hubo complicaciones intraoperatorias severas.
El conjunto de datos que soportan estos resultados no se encuentra disponible.
Discusión
En ginecología oncológica se intenta lograr tratamientos más efectivos con menores efectos adversos, evitando sobretratamiento, como es el caso del GC en CC.
En 1977, Cabanas describió la utilidad fisiológica del GC en pacientes con cáncer de pene, aportando que era el primer relevo linfático con mayor probabilidad de albergar metástasis, pudiendo ser el único ganglio involucrado16,17.
En este estudio se retoma el trabajo de validación en la técnica de GC iniciada en el año 2002 por investigadores uruguayos, ajustando los criterios de selección de pacientes según la evidencia actual18.
Se comprueba la viabilidad y utilidad diagnóstica del uso de la técnica de detección de GC con 99mTc en el CC uterino en estadio precoz.
La sensibilidad de la técnica de GC utilizando el radiotrazador 99mTc en nuestro estudio fue de 100% y el VPN fue de 100%. A nivel internacional se recomienda la utilización de 99mTc o verde de indocianina para la detección, siendo estos lo que logran mayor marcación. El azul patente puede ser utilizado de manera adicional al 99mTc, pero utilizándolo como único marcador es el de menor rendimiento. Las tasas de detección de GC arrojadas por nuestros resultados son similares a las reportadas en el estudio multicéntrico SENTICOL, uno de los estudios más grandes realizados hasta la fecha, que reportó una sensibilidad por paciente de 92,0% y un VPN de 98,2%, utilizando doble marcación11.
En nuestro trabajo los niveles de detección fueron altos, con una tasa de detección de 98,33% por región, con una tasa de detección bilateral de 96,66%.
Si lo comparamos con hallazgos de otros centros, como los que reportan G. Salvo y colaboradores19, en el que la sensibilidad de la técnica de GC, luego de la marcación con 99mTc o azul patente, o ambos, fue de 96,4% (IC95% 79,8% - 99,8%) y VPN de 99,3% (IC95% 95,6% - 100%), con tasa de falsos negativos de 3,6%, los hallazgos son similares, por lo que planteamos que la marcación con 99mTc es altamente efectiva y adecuada para realizarse en nuestro centro.
No encontramos falsos negativos en este estudio, lo que es un punto clave en la seguridad de la técnica, es decir, ningún GNC fue positivo con el GC negativo. El estudio de Arribeltz y colaboradores presentó una tasa de falsos negativos elevada de 16%18. Es de destacar que los criterios de inclusión del estudio eran diferentes a los utilizados actualmente, siendo un factor determinante el tamaño tumoral.
El tamaño tumoral mayor a 4 cm y el compromiso imagenológico ganglionar son factores que aumentan los falsos negativos y son considerados actualmente criterios de exclusión.
Destacamos de nuestros hallazgos que uno de los GC positivos fue una micrometástasis detectada por ultraestadificación, lo cual provocó un cambio de estatus. Se trató de una paciente de 44 años portadora de un carcinoma escamoso de 25 mm que presentaba invasión del espacio linfovascular, estadio final FIGO 2018 IB2. Esta micrometástasis se detectó por ultraestadificación, pudiendo haber pasado por alto con técnicas convencionales, lo cual evidencia que la biopsia de GC aumenta la sensibilidad de la detección de metástasis ganglionares en estadios iniciales del CC.
Si comparamos la técnica de GC con la linfadenectomía convencional, es importante destacar que ésta es un procedimiento que aumenta el tiempo quirúrgico, es costoso, y está asociado a complicaciones que incluyen lesión vascular y nerviosa, quiste linfático, linfedema de las extremidades inferiores y fuga linfática13, con las consiguientes repercusiones en la rehabilitación y calidad de vida de las sobrevivientes.
GK Lenox y colaboradores analizaron la tasa de supervivencia libre de enfermedad, comparando biopsia de GC negativa y linfadenectomía pélvica negativa en pacientes con CC en estadio precoz. Realizaron un estudio prospectivo en el que se siguieron 1.188 pacientes por 31 años, de las cuales a 1.078 se les realizó linfadenectomía convencional y a 110 se les realizó biopsia selectiva de GC. Sus resultados demuestran que la biopsia negativa de GC no está asociada a una diferencia en la tasa de supervivencia libre de enfermedad cuando se compara con la linfadenectomía pélvica negativa en pacientes con CC en estadio precoz20.
El estudio multicéntrico aleatorizado SENTICOL 2 comparó el efecto de la biopsia del GC con el de la biopsia de GC + linfadenectomía pélvica (PLND), determinando la morbilidad linfática posoperatoria en los dos grupos. La supervivencia libre de enfermedad después de cuatro años para el grupo biopsia GC y el grupo biopsia GC + PLND fue 89,51% y 93,1% (p = 0,53), similar en ambos grupos. El único factor estadístico asociado a recurrencia en el análisis univariante fue la radioterapia adyuvante. Ningún otro factor fue significativo en los análisis univariados o multivariados. Las tasas de supervivencia global después de cuatro años en los grupos biopsia de GC y biopsia de GC + PLND fueron 95,2% y 96% (p = 0,97). Este estudio aleatorizado confirmó los resultados de SENTICOL 1 y respalda la técnica del GC como una técnica segura para su uso en pacientes con CC uterino en etapa temprana tratadas exclusivamente con biopsia de GC21,22. Evitar linfadenectomías innecesarias podría mejorar la calidad de vida en estas pacientes.
Analizando los factores que probablemente influyeron en nuestros buenos resultados, destacamos la experiencia del equipo quirúrgico en biopsia de GC, que se desarrolla en el CHPR en cáncer de mama y cáncer de vulva, habiendo previamente validado estas dos técnicas, y la amplia experiencia del laboratorio de Anatomía Patológica y Citología en el procesamiento de las muestras23.
A partir de esta etapa de validación, la técnica de GC en CC se transforma en el estándar de tratamiento para el abordaje linfático en el Hospital de la Mujer, siendo el primer centro validado en Uruguay.
Conclusiones
De acuerdo con los resultados obtenidos, la biopsia de GC en estadios precoces de cáncer cervicouterino es una técnica segura y efectiva, y el equipo interdisciplinario del Hospital de la Mujer está en condiciones de utilizar la biopsia de GC de cuello uterino como estándar de tratamiento.