Introducción
La fotomarcación es una técnica simple, no invasiva, en la cual un fotosensibilizador es aplicado sobre las lesiones tumorales cutáneas y el área circundante, para luego realizar su lectura mediante lámpara de Wood1-3. Con esta luz se observa una fluorescencia roja debido a la acumulación de Protoporfirina IX (PpIX) en células tumorales, la que se utiliza para determinar los márgenes del tumor. Los agentes fotosensibilizantes en la lesión son absorbidos preferentemente por las células tumorales. Tales agentes son el ácido 5-aminolevulínico (ALA) y el éster metílico de ALA (MAL). Ambos se convierten, una vez absorbidos, a protoporfirina tipo IX y se acumulan de manera preferencial en las células tumorales.4,5
Estudios han demostrado que el límite visible observado en la terapia fotodinámica corresponde cercanamente al límite histológico, esto es de ayuda para determinar la extensión de la cirugía.4
Se considera una técnica diagnóstica preoperatoria que puede ayudar a detectar bordes tumorales ocultos o mal definidos antes de la cirugía micrográfica de Mohs (CMM).4
La CMM consiste en la extirpación de los cánceres cutáneos a través de una serie estandarizada de pasos. Primero se realiza el “debulking”, que corresponde a la extirpación del tumor a margen mínimo, para luego resecar una seccion de piel de aproximadamente 2 mm de espesor tanto hacia lateral como en profundidad, la que se analizará en el microscopio de manera intrapoeratoria. Esta fase se repite hasta que la totalidad de los márgenes esten libres de tumor. Las ventajas que tiene son que permite el control paso a paso, a través de los cortes sucesivos, del 100% de los márgenes del tumor, lo que la hace una técnica que obtiene elevados porcentajes de curación en comparación con otros métodos de tratamiento para los carcinomas basocelular (CBC) y espinocelular (CEC).6
El objetivo general de este estudio es comparar los límites tumorales entre la demarcación clínica, la dermatoscópica y la demarcación con ALA en carcinomas cutáneos, y corroborarlos con el defecto quirúrgico obtenido por la CMM.
Los objetivos específicos incluyeron el análisis en la población estudiada de:
Las características epidemiológicas de los pacientes que se incluyeron en el estudio.
Los diámetros de los tumores clínicos, dermatoscópicos y fotomarcados.
Analizar la cirugía micrográfica en cuanto a fases, fragmentos, tamaño del defecto final.
Comparar el área tumoral objetivada clínicamente versus el área objetivada por dermatoscopía.
Comparar el área tumoral objetivada clínicamente versus el área objetivada por fotomarcación con ALA.
Comparar el área tumoral objetivada dermatoscópicamente versus el área por fotomarcación con ALA.
Comparar el área del defecto final luego de la cirugía de Mohs con las áreas objetivada clínicamente, dermatoscópicamente y por fotomarcación con ALA.
Materiales y métodos
Realizamos un estudio observacional, descriptivo y prospectivo. Los criterios de inclusión fueron pacientes mayores de 18 años con diagnóstico confirmado por bipsia de CEC in situ, CEC invasor o CBC, con indicación de cirugía micrográfica de Mohs que concurren a la Unidad de Cirugía Dermatológica del Hospital de Clínicas “Dr. Manuel Quintela”, entre mayo de 2018 hasta enero de 2019.
Los criterios de exclusión fueron: pacientes con hipersensibilidad al producto ácido 5-aminolevulínico y embarazo o lactancia.
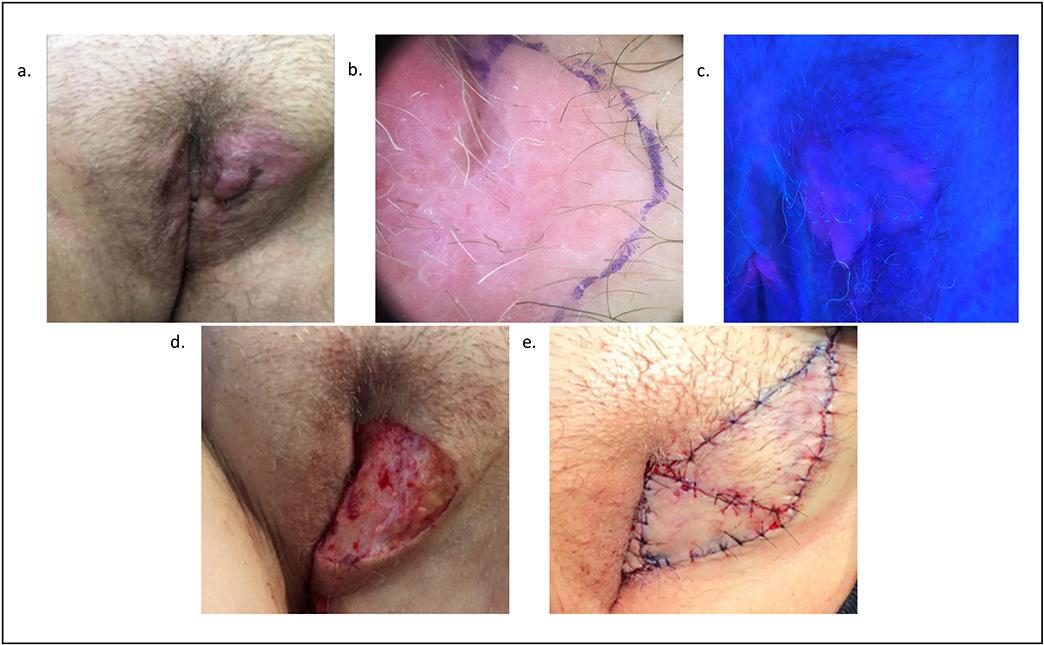
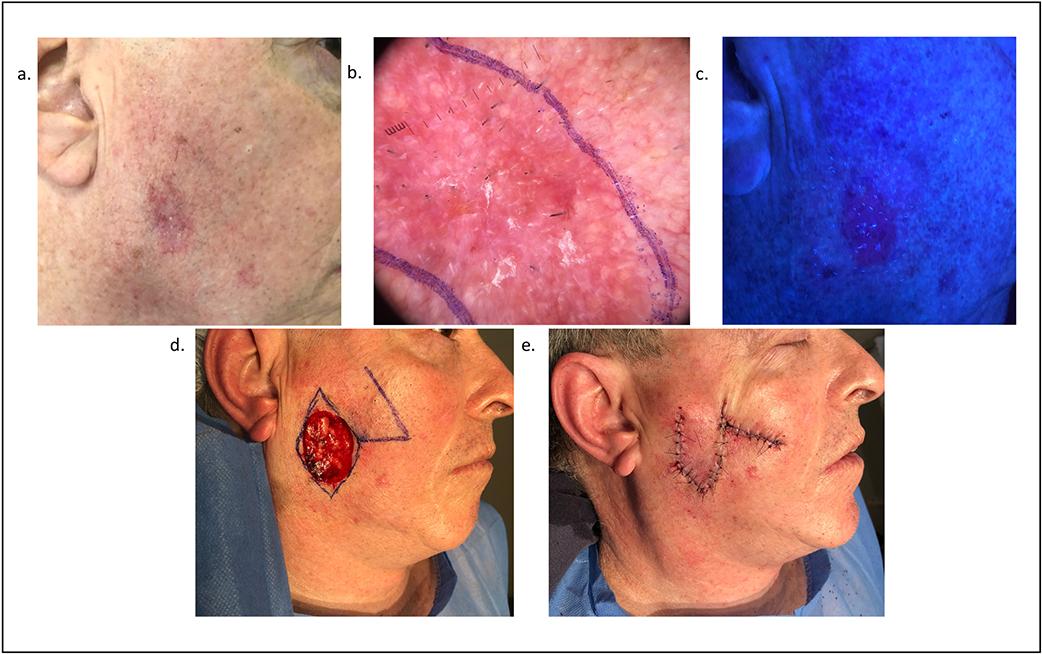
Previo a la cirugía, se realizó la medición del área de la extensión tumoral de manera clínica, lo observable a simple vista, a través del diámetro mayor (D) y diámetro menor (d) de la extensión.
Luego se realizó la medición del área de la extensión tumoral con dermatoscopía, la que se utilizó solo para determinar el límite entre piel sana y lesión tumoral mediante el aumento 10x. Para esto se utilizó un dermatoscopio Dermlite 3Gen DL4 con adaptador para registro de imágenes.
Para la medición del área delimitada por la fotomarcación con ALA, se colocó la crema de ALA sobre el tumor y 2 cm más allá del mismo, luego se cubrió con gasa y se dejó actuar 2 horas. Después de este tiempo, en un cuarto prácticamente sin luz, se procedió a la visualización con una lampara de Wood (Luz ultravioleta (UV)), demarcación del área fluorescente y cálculo del área.
Para el cálculo de las áreas (cm2) se utilizó la siguiente ecuación: 0,25*3,14*D*d.
Después de las mediciones, se procedió a realizar la CMM. Primero se realiza el debulking, que consiste en la resección completa de la lesión con un margen mínimo, para luego extraer una sección de piel de 2 mm de espesor en sentido lateral y en profundidad. Esta sección se examina al microscopio para verificar que los márgenes sean libres de tumor. Si se observa tumor, se prosigue con la cantidad de etapas necesaria hasta que el 100% de los márgenes estén libres de enfermedad.
Se calculó el área del defecto quirúrgico final, libre de tumor, de la misma manera que para los procedimientos antes mencionados. Esta medición se realizó en todos los pacientes inmediatamente después de finalizada la cirugía, para así homogenizar el efecto de la elasticidad de la piel sobre el defecto quirúrgico, ya que no fue considerado.Luego de finalizada la CMM, el paciente se va a su domicilio con una cura plana e indicación de evitar el contacto con la radiación UV en la piel fotomarcada. Cada una de las etapas del estudio se ilustra en las figuras 1 y 2.
La recolección de los datos se obtuvo a través de la entrevista con el paciente, de la historia clínica y de los procedimientos antes mencionados. Las variables con las que se trabajó fueron registradas en una planilla para el posterior análisis estadístico de los datos.
Para la recolección de datos se diseñó un instrumento con las variables de interés.
Se obtuvieron las siguientes variables: sexo, edad, tipo tumoral (forma clínica), localización y tamaño del carcinoma (área de extensión visible clínicamente), área de tumor evidenciada dermatoscópicamente, tumor primario o recurrente, tratamientos previos en caso de tumor recurrente, número de etapas que requirió la CMM y tamaño del defecto final posterior a la escisión completa del tumor mediante CMM.
El presente trabajo de investigación está realizado de acuerdo con las normas éticas del comité responsable de la experimentación humana del Hospital de Clínicas, Montevideo, Uruguay, y fue aprobado por el mismo. Todos los pacientes firmaron el consentimiento informado.
Para el análisis estadístico se utilizó el software STATA v.12. Para la comparación entre los promedios de tamaños (cm2) medidos se utilizó test T de Student para muestras dependientes. Se fijó un umbral de significación en alfa 0,05.
Resultados
Se incluyeron un total de 16 tumores operados por CMM en 14 pacientes. El 62,5% de los tumores correspondían a pacientes mujeres y el 37,5% a pacientes hombres. El promedio de edad fue de 68,9 años (con un rango de 43 y 87 años).
La mayor proporción de pacientes provenía de la zona metropolitana con el 50% de los casos.
Con respecto al fototipo de Fitzpatrick, el de mayor frecuencia correspondió al II, con el 62,5% de los pacientes, y un 37,5% a pacientes con tipo III. No se registraron fototipos I, IV, V y VI.
De los 16 tumores intervenidos, el 37,5% correspondieron a CBC, y el 62,5% restante correspondieron a CEC, de los cuales, 31,2% eran CEC invasor y el 31,3% eran CEC in situ.
En relación con la localización tumoral, el 31,3% se localizó en una zona de alto riesgo (H), el 18,8% en zona de riesgo medio (M) y el 50% en zona de bajo riesgo (L).
El 81,3% de los tumores correspondía a tumores primarios y el 18,8% a recidivas.
En lo que respecta al número de fases realizadas, el 87,5% se resolvieron con una sola fase, mientras que el 12,5% restante requirió 2 fases. Para la reconstrucción, se utilizó el cierre simple en 87,5% de los casos y colgajos locales en el 12,5%.
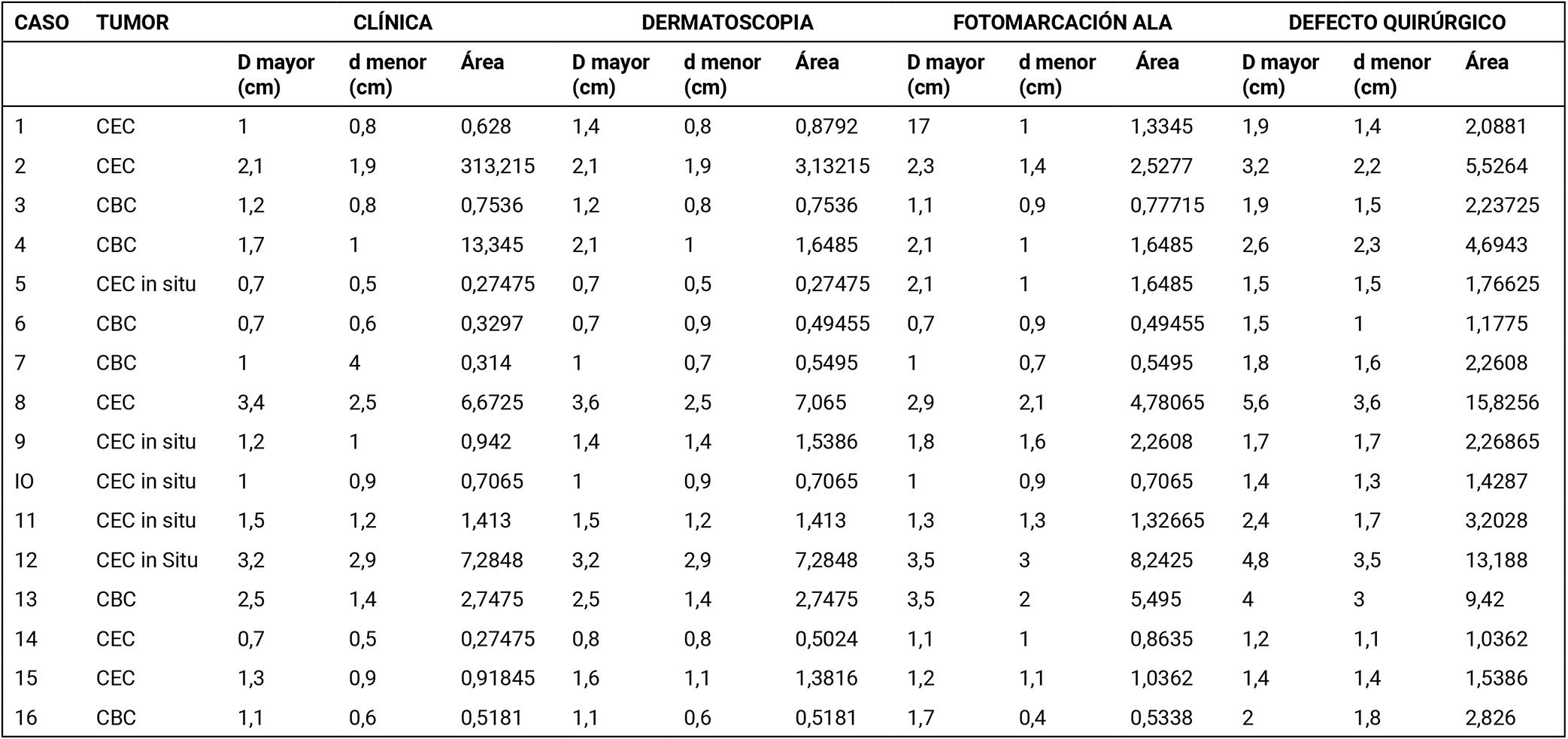
Las mediciones realizadas por la clínica, la dermatoscopía, la fotomarcación y el defecto quirúrgico final se resumen en la tabla 1.
Comparación inspección clínica versus dermatoscopia
Si tenemos en cuenta el D mayor (cm) según el área clínica, se encontró una media de 1,52 cm (DE 0,21) con un mínimo y un máximo en 0,70 cm y 3,40 cm, respectivamente. La misma medida por dermatoscopia presentó un tamaño de 1,62 cm (DE 0,22), con un mínimo de 0,70 cm y un máximo de y 3,60 cm, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 0,1 cm (IC 95% 0,01 – 0,18), valor p = 0,018.
Si tenemos en cuenta el D menor (cm) según área clínica, se encontró un tamaño de 1,12 cm (DE 0,18), con un mínimo de 0,40 cm y un máximo de 2,90 cm, respectivamente. La misma medida por área dermatoscópica presentó un tamaño de 1,21 cm (DE 0,17) con un mínimo de 0,50 cm y un máximo de 2,90 cm, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 0,09 cm (IC 95% 0,01 – 0,17), valor p = 0,023.
Si tenemos en cuenta el tamaño de área clínica encontramos un promedio de 1,77 cm2 (DE 0,55) con 0,27 cm2 y 7,28 cm2 como mínimo y máximo, respectivamente. En relación con el área dermatoscópica el promedio fue de 1,93 cm2 (DE 0,55), con mínimo y máximo de 0,27 cm2 y 7,28 cm2, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 0,17 cm2 (IC 95% 0,06 – 0,27), valor p = 0,004.
Comparación inspección clínica versus fotomarcación con ALA
Si tenemos en cuenta el D mayor (cm) según área clínica, se encontró un tamaño de 1,52 cm (DE 0,21), con un mínimo de 0,70 cm y un máximo de 3,40 cm, respectivamente. La misma medida por fotomarcación presentó un tamaño de 1,81 cm (DE 0,22), con un mínimo de 0,70 cm y un máximo de 3,50 cm, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 0,29 cm (IC 95% 0,03 – 0,55), valor p = 0,029.
Si tenemos en cuenta el D menor (cm) según área clínica, se encontró un tamaño de 1,12 cm (DE 0,18), con un mínimo de 0,40 cm y un máximo de 2,90 cm, respectivamente. La misma medida por fotomarcación presentó un tamaño de 1,27 cm (DE 0,16), con un mínimo de 0,40 y un máximo de 3,00 cm, respectivamente. La diferencia entre ambas medidas fue de 0,15 cm (IC 95% −0,02 – 0,32), valor p = 0,086, por lo que no se estableció una diferencia significativa.
Si consideramos el tamaño de área clínica, encontramos un promedio de 1,77 cm2 (DE 0,55), con 0,27 cm2 y 7,28 cm2 como mínimo y máximo, respectivamente. En relación con el área de fotomarcación, el promedio fue de 2,14 cm2 (DE 0,55), con mínimo y máximo de 0,49 cm2 y 8,24 cm2, respectivamente. La diferencia entre ambas medidas fue de 0,37 cm2 (IC 95% −0,16 – 0,9), valor p = 0,154, por lo que no se estableció una diferencia significativa.
Comparación dermatoscopía versus marcación ALA
Si tenemos en cuenta el D mayor (cm) según área dermatológica, se encontró un tamaño de 1,62 cm (DE 0,22), con un mínimo de 0,70 cm y un máximo de 3,60 cm, respectivamente. La misma medida por fotomarcación presentó un tamaño de 1,81 cm (DE 0,22), con un mínimo de de 0,70 cm y un máximo de 3,50 cm, respectivamente. La diferencia entre ambas medidas fue de 0,19 cm (IC 95% −0,08 – 0,47), valor p = 0,149, por lo que no se estableció una diferencia significativa.
Si tenemos en cuenta el D menor (cm) según área dermatoscópica, se encontró un tamaño de 1,21 cm (DE 0,17), con un mínimo de 0,50 cm y un máximo de 2,90 cm, respectivamente. La misma medida por fotomarcación presentó un tamaño de 1,27 cm (DE 0,16), con un mínimo de 0,40 cm y un máximo de 3,00 cm, respectivamente. La diferencia entre ambas medidas fue de 0,06 cm (IC 95% −0,09 – 0,2), valor p = 0,431, por lo que no se estableció una diferencia significativa.
Si consideramos el tamaño del área dermatoscópica, encontramos un promedio de 1,93 cm2 (DE 0,55), con 0,27 cm2 y 7,28 cm2 como mínimo y máximo, respectivamente. En relación con el área de fotomarcación, el promedio fue de 2,14 cm2 (DE 0,55), con mínimo y máximo de 0,49 cm2 y 8,24 cm2,respectivamente. La diferencia entre ambas medidas fue de 0,26 cm2 (IC 95% −0,36 – 0,76), valor p = 0,435, por lo que no se estableció una diferencia significativa.
Comparación del área del defecto final luego de la cirugía de Mohs con las áreas objetivada clínicamente, dermatoscópicamente y con fotomarcación con ALA
El promedio del área objetivada clínicamente correspondió a 1,77 cm2 (DE 0,55), con un mínimo de 0,27 cm2 un máximo de 7,28 cm2, respectivamente. La misma medida para el área del defecto final luego de la cirugía de Mohs correspondió a 4,41 cm2 (DE 1,12), con un mínimo de 1,04 cm2 y un máximo de 15,83 cm2, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 2,64 cm2 (IC 95% 1,32 – 3,96), valor p < 0,001.
El promedio del área dermatoscópica correspondió a 1,93 cm2 (DE 0,55), con un mínimo de 0,27 cm2 y un máximo de 7,28 cm2, respectivamente. La misma medida para el área del defecto final luego de la cirugía de Mohs correspondió a 4,41 cm2 (DE 1,12), con un mínimo de 1,04 cm2 y un máximo de 15,83 cm2, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 2,47 cm2 (IC 95% 1,15 – 3,80), valor p = 0,001.
El promedio del área de fotomarcación correspondió a 2,14 cm2 (DE 0,55), con mínimo y máximo en 0,49 cm2 y 8,24 cm2, respectivamente. La misma medida para el área del defecto final luego de la cirugía de Mohs correspondió a 4,41 cm2 (DE 1,12), con un mínimo de 1,04 cm2 y un máximo de 15,83 cm2, respectivamente. Se estableció una diferencia estadísticamente significativa entre ambas medidas de 2,27 cm2 (IC 95% 0,80 – 3,73), valor p = 0,005.
Discusión
La CMM se considera la técnica más adecuada para aquellos tumores considerados de alto riesgo, teniendo en cuenta su localización, tamaño, clínica, histología, recurrencias y estado inmunológico del paciente. Esta técnica prioriza la exéresis tumoral en su totalidad, examinando el 100% de los márgenes, y a su vez, minimiza la resección de tejido sano.7
En una serie publicada de nuestro servicio de pacientes operados por CMM, se observó que el 62,3% de las CMM fueron realizadas en hombres y 37,7% en mujeres. Sin embargo, en los pacientes en quienes realizamos fotomarcación, encontramos un predominio en sexo femenino, sabiendo que esto no es comparable dada la pequeña muestra y características de los tumores seleccionados.7
La mayoría de los pacientes son mayores de 60 años, esto es concordante con la literatura donde el CPNM se presenta en individuos de mayor edad que otros canceres de piel, como el melanoma, que se presenta a edades más tempranas.4
Coincidiendo con la literatura, los carcinomas cutáneos se presentan frecuentemente en los pacientes de piel clara. En nuestro estudio, la mayoría corresponde al fototipo II (62,5%), mientras que el fototipo III representa el 37,5%. Destacamos que el fototipo es una variable a tener en cuenta, ya que se ha observado que en fototipos altos (IV, V, VI), las células tumorales captarían menos PpIX, ya que la melanina absorbe la luz en toda la región de longitud de onda utilizada para la fotomarcación.2
Con respecto a la procedencia de los pacientes, un 50% correspondía a pacientes de Montevideo y el restante 50% a pacientes del interior del país. Esto es importante porque, en primer lugar, indica que nuestro servicio es un centro de referencia en lo que concierne a los tumores cutáneos y, por otro lado, destacar la actualización y concientización de los médicos en referir a los pacientes que presentan carcinomas con indicación de CMM.
Nuestro estudio muestra una frecuencia mayor de CEC (62,5%) sobre CBC (37,5%), lo cual es diferente en la literatura. Esto podría corresponder a que el subtipo de CBC incluido para nuestro trabajo es un subtipo histológico menos frecuente dentro de estos carcinomas y a que se incluyeron varios subtipos de CEC planos, que algunos autores las consideran como una lesión premaligna.7
La mayoría de los tumores eran primarios (81,3%), coincidiendo con Macfarlane et al., que presentó un 72% de los tumores operados.8 El 87,5% de los tumores se resolvieron en una fase de CMM y el 12,5% en dos fases. Macfarlane et al., describen que 90% de los tumores se resuelven en las dos primeras fases de la CMM.10
Con respecto al tamaño de defecto quirúrgico, destacamos que en nuestro estudio encontramos que, de las 16 CMM, el 50% presentó un tamaño entre 1 y 1,9 cm, y el 50% restante fue mayor o igual a 2 cm. Leibovitch et al., en su trabajo de 11.127 pacientes con CBC operados con CMM en 10 años, encontraron que el 41,9% de los defectos fueron menores a 2 cm y el 58,1% fueron mayores a 2 cm.11 Mientras que, en su trabajo para CEC, también con 10 años de experiencia y 1.263 pacientes, los defectos luego de la CMM fueron menores a 2 cm en el 33,9% y mayores a 2 cm en el 66,1%.11 Ningún paciente presentó efectos adversos al fotomarcador.
En 1981 Kennedy et al., usaron el diagnóstico fotodinámico con ALA y terapia fotodinámica en humanos por primera vez.9
Jeon et al., en su estudio “eficacia de la cirugía micrográfica de Mohs guiada por diagnóstico fotodinámico (PDD) en el carcinoma primario de células escamosas”, examinaron 67 casos de CEC faciales primarios confirmados por biopsia y tratados con CMM. Los dividieron en dos grupos: aplicación de PDD (n = 38, 56,7%) y sin aplicación de PDD (n = 29, 43,3%). Demostraron el beneficio del diagnóstico fotodinámico para delimitar márgenes de CPNM evidenciando que el borde encontrado por fotomarcación se corresponde al borde histológico.2
En nuestro estudio, encontramos que los márgenes tumorales obtenidos clínicamente versus dermatoscópicamente presentan diferencias estadísticamente significativas a favor de esta última. Carducci et al., encontraron que los márgenes de resección determinados mediante dermatoscopía se correspondieron con los márgenes reales de CBC en el 93% de los casos, en comparación con la inspección clínica, la cual demostró que el 22% de los pacientes presentaban lesión residual postcirugía convencional. En conclusión, el análisis dermatoscópico prequirúrgico de los márgenes del CBC es más específico que la observación clínica para determinar los márgenes tumorales.13 Terushkin et al., demostraron que los bordes de CBC obtenidos por dermatoscopía se corresponderían a los obtenidos por la histopatología, reduciendo así el tiempo quirúrgico y el número de fases de CMM.14
En nuestro estudio, al comparar la inspección clínica versus fotomarcación, obtuvimos sólo diferencias estadísticamente significativas en D; sin embargo, el d y el área se comportaron de manera similar. Casey et al., encontraron que la fotomarcación con fluorescencia de PpIX conduce a márgenes de resección más claros que la inspección clínica, sobre todo para tumores de bordes mal definidos, tanto CBC como CEC.2
De nuestro estudio, obtuvimos que, en cuanto a la dermatoscopía versus la fotomarcación, no se pudo establecer una diferencia estadísticamente significativa entre ambas medidas, con un valor p = 0,435. Sin embargo, si consideramos los valores del área dermatoscópica y el área de fotomarcación, encontramos un promedio de 1,93 ± 0,55 cm2 y de 2,14 ± 0,55 cm2, respectivamente, existiendo una diferencia de 0,21 ± 0,55 cm2. Aunque la diferencia entre el área demarcada con la dermatoscopía y el área fotomarcada es muy pequeña, esto demuestra que, en muchas ocasiones, el tumor se extiende más allá que lo que se puede ver dermatoscópicamente. Desde el punto de vista clínico-práctico, creemos que la fotomarcación podría ser una herramienta útil que aporte mayor precisión al margen tumoral en comparación con la dermatoscopía.
Andrade et al., evaluaron la eficacia de un protocolo de diagnóstico fotodinámico con ALA en la detección de 29 casos de CBC (sin identificar subtipo), 31 casos de queratosis actínicas y 11 casos de queratosis seborreicas, y concluyeron que esto mejora la detección de los márgenes tumorales en los CBC.15
Magliano et al., analizaron con la técnica micrográfica de Mohs 101 CBC y 26 CEC tratados con cirugía convencional e informados con márgenes libres mediante la técnica de la rebanada de pan. El 8,7% de los tumores presentaban márgenes comprometidos al ser analizados con la técnica micrográfica de Mohs, mostrando la importancia de la CMM como estándar de oro para el análisis de márgenes de estos tumores.14
En cuanto a la fotomarcación y la CMM, encontramos que existen diferencias entre ambas técnicas, donde el valor promedio del área para el ALA fue de 2,14 ± 0,55 cm2, y el área del defecto final luego de la cirugía de Mohs correspondió a 4,41 ± 1,12 cm2. Aplicado a la clínica, esta diferencia es una característica a tener en cuenta, ya que el borde tumoral real no pudo ser establecido por fotomarcación, como se observó en otros estudios. (p = 0,005). Se tomó como tamaño tumoral real al área luego de la cirugía de Mohs, sabiendo que el tamaño real es difícil de saber porque lo que se analiza en las fases son el margen lateral y no se puede saber cuánto dista el tumor de este margen.
Autores han publicado que la fotomarcación sería útil para medir márgenes tumorales en CPNM. Su-Young et al., en un estudio de 67 casos de CEC faciales primarios confirmados con biopsia tratados con CMM, y luego divididos en dos subgrupos (uno con aplicación de fotomarcador y otro sin el mismo), concluyeron que la fotomarcación aumentó la eficacia quirúrgica de la CMM para delimitar los márgenes tumorales, presentando, por lo tanto, efectos favorables en los resultados quirúrgicos en CEC primarios durante la CMM.7 Won et al., en su estudio de 50 muestras de tejido obtenidas de 10 pacientes con CBC, concluyeron que la imagen de fluorescencia con PpIX podría ser una herramienta útil para detectar el borde lateral entre el tumor y el área libre de tumor en CBC faciales. Por lo tanto, tiene el potencial de ser un método de imagen in vivo prequirúrgico eficiente para determinar los márgenes laterales quirúrgicos apropiados de CBC.4,17
Jeon et al., en su trabajo sobre eficacia de la fotomarcación en diagnóstico fotodinámico guiado para CMM en CBC pigmentados versus CBC no pigmentados, estudiaron 258 tumores, de los cuales 199 eran pigmentados. Concluyeron que la fotomarcación mejora los resultados quirúrgicos en los casos de CBC no pigmentados.16
Dentro de las limitaciones de nuestro estudio, destaca el pequeño tamaño muestral, debido principalmente al elevado costo y a la poca accesibilidad del fotomarcador en nuestro medio. Se ha descrito el descostrado de lesiones queratinizantes para favorecer la absorción del fotomarcador,15 lo cuál no se realizó en nuestro estudio, ya que el objetivo era evidenciar las zonas subclínicas en la periferia del tumor, y la costra se interpretó como tumor clínicamente visible.
Por otro lado, el tiempo del fotomarcador en la piel antes de la CMM fue de 2 horas, mientras que en otras series como la de Jeon et al., fue de 6 horas, además de colocación de vendaje con papel aluminio2; la de Stenquist et al., fue de 3 horas y utilizó un vendaje para protección de luz18; en la series de Redondo et al., y Xiaoqiong et al., también el tiempo fue de 3 horas.1,19 Creemos esto pudo haber sido una de las variables que modificó nuestros resultados.
Otra limitación de nuestro trabajo fue que la lectura de la fluorescencia con lámpara de Wood fue realizada a ojo desnudo por un dermatólogo cirujano de Mohs. Por lo tanto, los limites fluorescentes dependieron únicamente del observador, lo que podría haber llevado a una subestimación de los márgenes tumorales. Otra explicación sería que, a medida que las capas de CMM se extraen con márgenes de 2 mm, la capa final incluye un perímetro de tejido normal, lo que aumenta el tamaño del defecto quirúrgico final.
Una posible explicación de la menor eficacia del fotomarcador en nuestro estudio podría ser la falta de acumulación de PpIX asociada con la profundidad de penetración del fotosensibilizante. Un estudio de Sandberg et al., mostró que las concentraciones acumuladas de ALA o MAL a profundidades de 1 a 2 mm se obtuvieron en solo el 50% de las lesiones investigadas.20
Los CEC tienen patrones de crecimiento más agresivos y patrones infiltrativos más profundos que otros CPNM. Además, los queratinocitos de estos tumores producen menos PpIX que los queratinocitos de la piel normal. Otra explicación puede ser que el fotomarcador conduce a falsos negativos debido a la falta de acumulación intracelular de PpIX en células de CEC. Lee et al., cultivaron diferentes tipos de células, incluyendo queratinocitos epidérmicos humanos, fibroblastos dérmicos humanos, células de CEC y células de melanoma antes del tratamiento con fotosensibilizante, y midieron las cantidades de PpIX sintetizadas en cada célula en función de la fluorescencia. El estudio mostró que las células del CEC producían menos PpIX que los queratinocitos normales.2,21,22 Estas características biológicas de las células de CEC pueden explicar la menor eficacia de fotomarcador en nuestro estudio.
La fotomarcación con ALA mostraría márgenes tumorales más cercanos a los valores obtenidos con el defecto quirúrgico final por CMM. Por lo tanto, sería útil antes del mismo para delimitar los márgenes laterales de CPNM, disminuyendo así el número de fases y agilizando el procedimiento quirúrgico. Sin embargo, también debemos tener en cuenta el tiempo prolongado de incubación que requiere el fotomarcador tópico, además de que debe ser aplicado por personal capacitado. Por un lado, con la fotomarcación se intenta delimitar bien el tumor para ahorrar tiempo en la CMM, y comenzar la primera fase del margen real del tumor, pero, por otro lado, tenemos el aumento del tiempo que lleva el procedimiento de fotomarcación previo a la CMM, lo que plantea la pregunta de si realmente es útil o no.
Este estudio también estuvo limitado por su diseño de un solo centro y un pequeño número de tumores. Se requiere un estudio multicéntrico y prospectivo, con un tamaño de muestra más grande y mayor tiempo de incubación del fotomarcador. Se necesitan futuros estudios que utilicen tecnología de imágenes computarizadas, lecturas espectrofotométricas y tiempos de incubación de fotomarcadores variables para superar estas limitaciones y facilitar su aplicabilidad clínica antes de la CMM.
Conclusión
Mediante el presente trabajo no se logró comprobar que la fotomarcación tenga una ventaja estadísticamente significativa en comparación con la marcación clínica y dermatoscópica. Sin embargo, se demostró una ventaja estadísticamente significativa de la marcación dermatoscópica respecto a la clínica.
Aunque creemos que la fotomarcación puede acortar el tiempo de la CMM debido a la mejor visualización de las áreas tumorales subclínicas, el tiempo en total que le llevaría al paciente realizar la fotomarcación y la cirugía sería mayor que realizar solo esta última, ya que es necesario aplicar el fotosensibilizador por lo menos 3 horas antes del inicio de la cirugía.
Consideramos que se necesitan estudios con un mayor tamaño muestral para comprobar si esta técnica puede tener un rol previo a la CMM.