Introducción
La atrofia muscular espinal (AME) 5q es una enfermedad neuromuscular generada por la mutación en el gen SMN11. Posee una incidencia aproximada de 1 en 10.000 recién nacidos y se considera la causa genética más frecuente de muerte en la infancia2-4. La AME se hereda como un trastorno autosómico recesivo en el cromosoma 5q135-7 que afecta la supervivencia de las motoneuronas. Se caracteriza por hipotonía, atrofia muscular progresiva, debilidad axial y proximal, afectando además a los músculos respiratorios y a los músculos bulbares inervados (MBI), causando insuficiencia ventilatoria y tusígena8,9. Habitualmente la sospecha clínica está dada por hipotonía marcada en los primeros meses de vida, con extremidades inferiores en flexión y rotación externa (postura de rana), respiración paradojal y fasciculaciones linguales (en presentaciones más severas) o retraso del desarrollo psicomotor (en presentaciones más leves)10. Actualmente en muchos países se diagnostica precozmente a través del screening neonatal e incluso antes del nacimiento por medio de pruebas durante el embarazo o exámenes sanguíneos a la madre11. Si no fue posible realizar un diagnóstico precoz de la enfermedad y se presenta la sospecha clínica de AME, esta debe ser confirmada a través de un examen genético específico que verifique la deleción de exones del gen SMN1 y que además pueda informar del número de copias del gen SMN2. Este segundo gen y el número de copias existentes, presente solo en humanos, se relaciona inversamente con la severidad de la enfermedad, ya que usualmente a mayor número de copias del gen SMN2, el compromiso clínico es menos intenso4,12.
La AME se puede clasificar clínicamente en cuatro tipos de acuerdo a los hitos motores que puedan alcanzar los pacientes. La AME tipo 1 se define por la incapacidad de sentarse de forma independiente; tipo 2, por la capacidad de sentarse, pero no caminar; tipo 3, por la capacidad de caminar durante algún tiempo, y tipo 4, por inicio en la edad adulta13. La AME tipo 1 es el tipo más frecuente y afecta aproximadamente al 58% de todos los pacientes con AME4. Los niños con AME tipo 1 suelen presentar dos o a veces tres copias de SMN2. Los que tienen tres copias suelen tener una forma de presentación menos progresiva o de aparición más tardía (tipo 1c) en comparación a los que tienen dos copias (tipo 1a o 1b)4,12.
Una clasificación complementaria a los hitos motores, en una línea de tiempo de presentación clínica y funcional, fue postulada considerando el estatus respiratorio alcanzado midiendo la capacidad vital al llanto (CVL), observando el compromiso deglutorio y pérdida de la autonomía respiratoria, y considerando el momento de la dependencia continua de soporte ventilatorio13. La debilidad progresiva de los músculos intercostales da como resultado el desarrollo insuficiente de los vértices pulmonares con la forma típica de tórax en campana, junto con la presencia de respiración paradojal. Este hecho clínico, al existir indemnidad diafragmática, fija un criterio observacional básico para entender que ese paciente tiene una insuficiencia ventilatoria. Los volúmenes medidos de la CVL de los niños diagnosticados con AME 1 tiene gran relevancia, ya que ellos presentan mayor compromiso respiratorio, y mientras menores sean las CVL obtenidas, se relacionan con mayor severidad y precocidad, asociadas a tos ineficaz e incapacidad para eliminar las secreciones de las vías respiratorias inferiores, elementos condicionantes de fallo ventilatorio14,15. Es así, como la primera causa de muerte prematura evitable en los infantes con AME tipo 1 es el compromiso ventilatorio por falla de la bomba de los músculos respiratorios, principalmente los músculos inspiratorios con respiración paradojal e incapacidad para ventilar. También presentan debilidad de los músculos espiratorios con incapacidad para toser y de los MBI con incapacidad para deglutir y tener una protección glótica apropiada16. Las condiciones antes mencionadas pueden llevar al fallo de la bomba ventilatoria con la consecuencia de intubación endotraqueal para ventilación mecánica invasiva, luego de lo cual estos pacientes son difícilmente detectables y presentan múltiples fallos de extubación.
El objetivo de este artículo es hacer una revisión de los protocolos de extubación publicados en la literatura médica y actualizar las propuestas para estos fines en pacientes con AME tipo 1 con el propósito de evitar traqueostomías innecesarias.
Metodología
Estrategia de búsqueda
Se realizó una búsqueda de literatura médica en la base de datos PubMed/MEDLINE y LILACS y la base de datos de texto completo SciELO. Las palabras clave “Spinal Muscular Atrophy”, “Weaning Ventilator”, “Noninvasive Ventilatory Support”, “Cough Assistance”, “Extubation” (y sus sinónimos en español) fueron utilizadas en combinación para la selección de los artículos. El resto de los artículos se obtuvo mediante la búsqueda de las referencias dentro de los estudios seleccionados.
Criterios de selección
Se incluyeron estudios realizados en pacientes pediátricos con diagnóstico de AME tipo 1 y que requirieron ventilación mecánica invasiva a través de tubo orotraqueal. Los autores debían reportar el uso de protocolo de extubación a terapias ventilatorias no invasivas. Los trabajos podían estar escritos en español o en inglés, con acceso a texto completo.
La búsqueda inicial identificó 98 estudios que fueron revisados por título y abstract en una primera instancia, y luego se evaluaron a texto completo aquellos considerados potencialmente incluibles. Finalmente, cuatro artículos cumplieron los criterios de selección establecidos para esta revisión.
Resultados
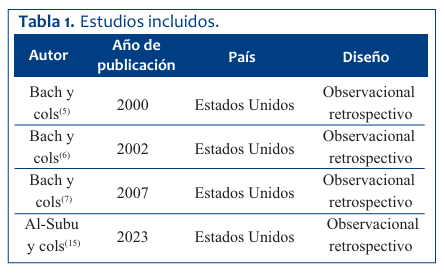
Se realizó una búsqueda bibliográfica de los métodos reportados para la extubación en pacientes con AME tipo 1 en la literatura médica en los últimos 30 años. Se incluyeron cuatro artículos en esta revisión que pueden observarse en la (Tabla 1). Todos los estudios fueron desarrollados en Estados Unidos5-7,15, analizando datos entre 1993 a 2018 de manera retrospectiva. Se incluyeron un total de 227 sujetos con diagnóstico de AME, de los cuales 203 correspondían a AME tipo 1.
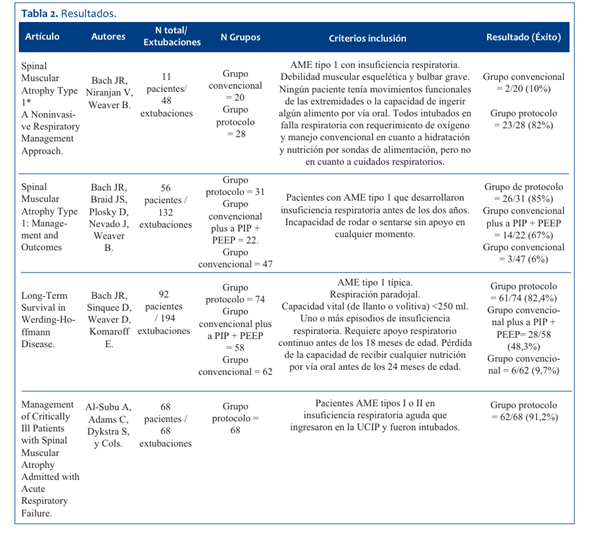
En el año 2000, Bach y colaboradores5 publicaron su protocolo original de extubación en 11 pacientes con diagnóstico de AME 1 que desarrollaron insuficiencia respiratoria con necesidad de oxigenoterapia e intubación endotraqueal. El protocolo requería de estabilidad clínica, con resolución del compromiso del parénquima pulmonar previo a la extubación, una línea de SpO2 con oxígeno ambiente normalizada, utilizando insuflación-exsuflación mecánica (IEM) con presiones de insuflación desde +25 a + 40 cm H2O y exsuflación de -25 a -40 cm H2O a través del tubo endotraqueal y posterior a la extubación, a través de mascarilla nasobucal. Se intentó la extubación independientemente de si el paciente estaba destetado o no del ventilador, y, una vez extubado, se le entregaba soporte ventilatorio no invasivo (SVN) vía nasal en el concepto de programación completa con un diferencial de presión alto (>13 cm H2O) con IPAP máximo de 20 cm H2O, con el EPAP mínimo posible que permitiera el ventilador (3 cm H2O) y sin la utilización de oxígeno suplementario. Por medio de este protocolo, 23 de 28 extubaciones fueron satisfactorias, con un porcentaje de éxito de 82%. Posteriormente, en el año 2002, Bach y colaboradores6) presentan una nueva publicación siguiendo el mismo protocolo con la diferencia de que en esta ocasión se utilizaron presiones de IEM de +35 a +40 y -35 a- 40 cm H2O. De los 31 pacientes adscritos al protocolo, 26 fueron extubados satisfactoriamente, con un porcentaje de éxito de 85%. En el tercer reporte generado por Bach y colaboradores7, en el año 2007, los investigadores presentaron datos de 74 pacientes AME tipo 1, quienes requirieron intubación endotraqueal, asociado a insuficiencia respiratoria, 61 fueron extubados satisfactoriamente siguiendo el mismo protocolo de las publicaciones anteriores, aunque con una leve diferencia presentada con respecto a los protocolos publicados anteriormente5,6, donde en forma posterior a la extubación, si bien se mantuvo el diferencial de presión alto (> 13 cm H2O), las presiones de IPAP llegaron hasta 22 cm H2O, en comparación a los 20 cm H2O informados en 20026. Siguiendo este protocolo los investigadores obtuvieron un porcentaje de éxito de 82,4%.
El segundo protocolo existente en la literatura para pacientes con AME fue publicado muy recientemente por Al-Subu y colaboradores15. Se trata de un estudio retrospectivo que analiza en un período de 15 años los datos de 137 pacientes con AME tipos 1 y 2 ingresados a un solo centro con insuficiencia respiratoria y que fueron tratados con ventilación mecánica no invasiva y protocolos intensificados de IEM. Los autores refieren que alrededor del 50% de los ingresos requirieron intubación endotraqueal. Para el proceso de extubación utilizaron un protocolo que consideró como estándar de cuidado para la preparación de la extubación los siguientes pasos: tolerar un PEEP de 5 cm H2O; que tuviese una frecuencia respiratoria del ventilador igual a la frecuencia de VNI utilizada previamente en el hogar; que el paciente tolerase una presión de soporte suficiente para compensar la resistencia de los tubos endotraqueales de menor tamaño, que se suministren volúmenes corrientes fisiológicos y que el paciente tolerara una FiO2 ≤0,4 para lograr una SpO2 >90%-92%. Todos los pacientes fueron extubados a VNI entregada con el ventilador y la interfaz (nasal o facial completa) que utilizaban en el hogar en modo S/T con presiones de IPAP de 14-20 cm H2O y EPAP de 3-6 cm H2O. Los ciclos de IEM se realizaron cada dos horas inicialmente y luego se distanciaba según tolerancia. La IEM se realizó a través de una máscara facial a una presión de insuflación de 30 a 40 cm H2O y una presión de exsuflación de -30 a -40 cm H2O, con un mínimo de cuatro series de cinco respiraciones o hasta que se eliminaron las secreciones cada vez que se usó. De los 68 pacientes que requirieron de intubación endotraqueal, 61 fueron extubados satisfactoriamente, con un porcentaje de éxito de 91,1% en el primer intento. Los criterios de inclusión y los resultados se presentan en la (Tabla 2) y los protocolos se detallan en la (Tabla 3).
Discusión
Los niños con AME 1 que tienden a desarrollar insuficiencia respiratoria aguda (IRA) generalmente antes de los 12 meses de vida, son intubados y solo 6% de las extubaciones convencionales son exitosas6,16-18. Existen ciertas estrategias que pueden llevar a evitar la intubación endotraqueal cuando existe IRA en este tipo de pacientes. En el año 2014, Chen y colaboradores19 presentaron un estudio prospectivo con el objetivo de evaluar la eficacia y las complicaciones de la VNI combinada con asistencia mecánica de la tos en niños con enfermedad neuromuscular (ENM) que presentaron IRA. Las presiones utilizadas tanto en la VNI como en la IEM fueron en aumento hasta acercarse a los valores usados por Bach y colaboradores5-7. Se describió un 75% de éxito para evitar la intubación, concluyendo los autores que la combinación de VNI más IEM es un enfoque seguro y eficaz para mejorar rápidamente los índices fisiológicos y disminuir la necesidad de intubación en niños con enfermedad neuromuscular e IRA y ofrecer una buena alternativa para quienes se niegan a la intubación19. En años posteriores los mismos investigadores confirmaron estos resultados, resaltando la importancia del manejo precoz con esta estrategia para evitar la intubación20,21.
Los protocolos de extubación convencionales en UCIP, de pacientes sin ENM, tienen una baja tasa de fracaso, lo que lleva infrecuentemente a reintubaciones y al requerimiento de traqueostomía. Estos protocolos incluyen pruebas de ventilación espontánea (PVE), y, en algunas situaciones, utilización de ventilación mecánica no invasiva u oxigenoterapia con cánula nasal de alto flujo como escalón de bajada22. En ENM y específicamente en pacientes AME los protocolos de extubación son menos conocidos por la escasa literatura existente, lo que lleva al fracaso de la extubación y en consecuencia, luego de uno o más intentos fallidos, se opta por la traqueostomía para ser transferidos a ventilación mecánica prolongada6,17,18,23-27. En la mayoría de los pacientes con AME tipo 1, luego de ser traqueostomizados, pierden la capacidad de respiración autónoma fuera del ventilador de forma inmediata y definitiva, y se vuelven totalmente dependientes de ventilación mecánica por traqueostomía continua (VMTC). Los pacientes AME 1 que son traqueostomizados antes de desarrollar el habla, no podrán adquirir nunca la habilidad para poder hablar6,7; además, no debe olvidarse el riesgo latente de complicaciones y accidentes de cánula que están presentes en los pacientes con vía aérea artificial y dependencia completa de VMTC.
Otra condición relevante que se suma a la debilidad de los músculos ventilatorios, al momento del destete de la ventilación mecánica invasiva (VMI) y agrega complejidad al proceso de extubación, es el compromiso de los MBI que resulta en un trastorno de la deglución y mala gestión de la saliva28. Esta condición podría requerir de vía de alimentación especial, de preferencia gastrostomía, pero no necesariamente de traqueostomía.
En Latinoamérica, en el año 2020, en relación con la extubación de pacientes AME 1, Canzobre y colaboradores29 reportaron el caso de un paciente de 5 meses utilizando un protocolo de destete de la VMI, para su posterior extubación. El estudio cita el protocolo realizado por Bach y colaboradores5-7 con la utilización de IEM, normalizando la SpO2 previo a la extubación a VNI. Los autores, además, describen la utilización de prueba de ventilación espontánea (PVE) previo a la extubación y posextubación, la utilización de VNI con presiones diferenciales bajas, presiones de fin de espiración altas y utilización de interfaz facial completa. El resultado final no fue favorable, ya que pese a lograr la extubación, algunos días después el paciente requirió reintubación. Posteriormente, hubo una segunda extubación fallida, por lo cual se decidió traqueostomizar al paciente29.
Cabe destacar que el protocolo original utilizado por Bach y colaboradores5-7 no considera la utilización de PVE, ni de VNI con diferenciales de presión bajos, ni el uso de interfaz facial completo. La prueba de ventilación espontánea es una práctica ampliamente utilizada y validada dentro de las unidades de pacientes críticos adultos como un estándar de evaluación de la capacidad para ventilar autónomamente y que se realiza previo al destete de la VMI y la extubación. Su utilización en el contexto pediátrico con los mismos objetivos es también una práctica frecuente en las UCIP. La aplicación de esta prueba en pacientes con ENM, especialmente en pacientes AME tipo 1 intubados, es una práctica muy cuestionable. Los pacientes con AME tipo 1 presentan una debilidad muscular muy marcada, con respiración paradojal, capacidades vitales muy reducidas y fallo ventilatorio precoz antes de los 6 meses de vida. El incurrir en pruebas de ventilación espontánea previo a la extubación de un paciente con una condición basal tan disminuida es una práctica que no debería realizarse, ya que implica necesariamente fatigar la bomba muscular ventilatoria previo a un proceso crítico como lo es la extubación. El paradigma clásico que se utiliza en las unidades de paciente crítico es el de destetar de la ventilación mecánica para luego extubar, proceso que debería cuestionarse en el contexto de pacientes con ENM, los cuales posiblemente y dependiendo de la severidad de su patología y condición, no puedan destetarse del soporte mecánico de la bomba y requieran de SVN continuo para tener éxito en la extubación. Este hecho cobra la máxima relevancia en los niños con AME tipo 1.
Eventualmente, como lo detalla el protocolo del año 20005, de utilizarse equipos de ventilación para la entrega de presión en dos niveles, la EPAP utilizada fue la mínima posible para asegurar el flujo bias necesario en estos equipamientos, pero no se utilizó el EPAP como una estrategia para lograr el reclutamiento de la capacidad residual funcional frente a una estabilidad alveolar disminuida, como suele hacerse en las enfermedades del parénquima pulmonar, ya que esto no es necesario en pacientes con pulmón sano, donde al haber debilidad de los músculos respiratorios este objetivo es subsanado con el apropiado reclutamiento por un volumen corriente que normalice la hipoventilación. Además de que la presión al final de la espiración puede vincularse a consecuencias hemodinámicas deletéreas y aumentar las fugas no intencionales26.
Si bien el protocolo original de Bach y colaboradores utiliza presión al final de la espiración, esta estrategia se fue optimizando a través de los años con la utilización de ventiladores no invasivos y circuitos de exhalación activa e interfases nasales no ventiladas que permiten ventilar con PEEP/EPAP = 0. Lo que también facilita, ante la presencia de sialorrea, que esta pueda fluir por gravedad26.
Los resultados reportados por Al-Subu y colaboradores15 refuerzan la propuesta sustentada por Bach y colaboradores5-7, más de 20 años antes, donde el eje principal para extubar un paciente con enfermedad neuromuscular es la estabilidad clínica del paciente, con mejoría de la insuficiencia respiratoria aguda previo a la extubación y la utilización de IEM con presiones adecuadas (de al menos +40/-40 cm H2O) para despejar las vías aéreas antes y después del retiro del tubo endotraqueal, más la utilización del SVN inmediatamente en forma posterior a la extubación. Hay ciertos aspectos en los que difieren ambos protocolos, como es el uso de PEEP/EPAP de 5 cm H2O o FIO2 > 0,21 para extubar, pero que demuestran una alta tasa de éxito y lograron evitar múltiples procesos de extubación fallidos que finalmente terminarán en traqueostomías totalmente evitables.
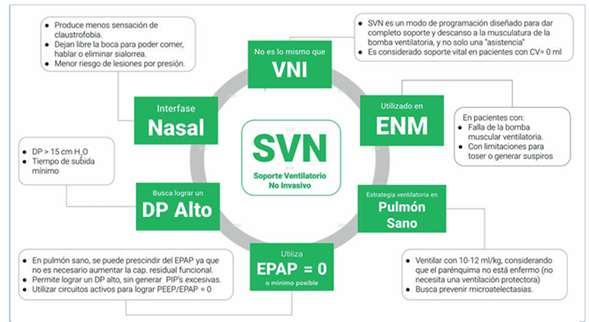
En los equipos tratantes de las UCIP es frecuente la preocupación en torno a algunos aspectos que son parte de los protocolos de destete específico para AME y otras ENM propuestos por Bach y colaboradores. En las enfermedades pulmonares u otras condiciones con compromiso parenquimatoso del pulmón, las presiones de empuje programadas para la ventilación mecánica invasiva y también no invasiva están asociadas a los conceptos de ventilación protectora, con volúmenes corrientes (Vt) objetivos bajos. Pero, debe tenerse en cuenta que en el caso de las ENM y otras condiciones afines, el problema es la insuficiencia de los músculos de la bomba ventilatoria y a raíz de esto se compromete el parénquima pulmonar por atelectasias y neumonías secundarias al fallo ventilatorio y tusígeno. En este sentido la utilización de SVN (Figura 1) considerando presiones inspiratorias pico (PIP) más altas, diferencial de presión (PIP-EPAP/PEEP) >15 cm H2O, con PEEP/EPAP = 0, frecuencias respiratorias de respaldo normales según la edad, tiempo de subida mínimo e interfaz nasal, no causan injuria alguna, sino que logran el apropiado reclutamiento de todos los volúmenes y capacidades pulmonares. Es importante destacar que luego de la utilización por años de esta programación “intensificada” para lograr Vt habitualmente al doble de lo planificado como objetivo en la ventilación protectora convencional, los reportes de neumotórax u otras lesiones secundarias a volumen trauma son muy infrecuentes26,30.
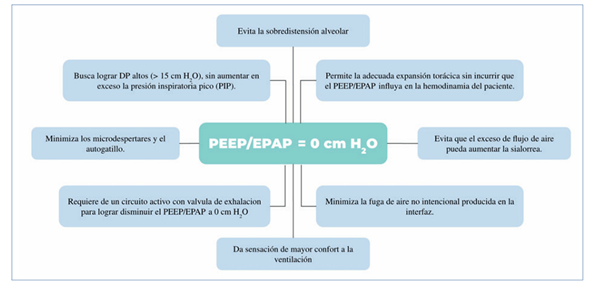
El uso de PEEP/EPAP = 0, como estrategia complementaria, tiende a ser resistido y a veces desconocido por el eventual “desreclutamiento alveolar” que podría ocurrir en forma secundaria. El pulmón sano de un paciente con ENM, bien ventilado usando SVN con diferenciales de presión apropiados, no debería producir desreclutamiento y microatelectasias, que de presentarse pueden ser eficazmente revertidas con técnicas de reclutamiento de volumen (RVP) pasivo con bolsa de resucitación manual y válvula unidireccional, que siempre deben ser utilizadas en pacientes con ENM. El fundamento principal para la entrega de PEEP/EPAP = 0 es lograr adecuados diferenciales de presión, sin necesariamente aumentar excesivamente las PIP, permitiendo la completa expansión torácica, sin incurrir en presiones mantenidas excesivamente altas que puedan influir en la hemodinamia del paciente26; disminución de flujos excesivos de aire que puedan aumentar la sialorrea, presente habitualmente en estos pacientes; minimizar la fuga de aire no intencional a través de las interfases de ventilación; minimizar la presurización secundaria insuficiente; microdespertares (arousal) y el autogatillo (Figura 2).
En relación con la IEM una preocupación habitual por parte de los clínicos es la utilización de presiones > 40 cm H2O, pero cabe consignar que las presiones pulmonares que se generan durante la tos normal están dentro de los 407 cm H2O31, por lo que generar presiones > 40 cm H2O han demostrado durante más de 60 años, desde que se implementó IEM, ser seguras y no generar riesgos potenciales de daño pulmonar26,32-34. Las presiones de insuflación-exsuflación adecuadas suelen mejorar los flujos necesarios para movilizar las secreciones sin lesionar la vía aérea y el parénquima pulmonar, incluso en lactantes muy pequeños. La utilización de presiones subóptimas < 40 cm H2O podría incurrir en la inefectividad de la terapia sin movilizar las secreciones en las vías aéreas distales, desreclutamiento pulmonar, menor adaptación del paciente-máquina y aumento de la fatiga muscular respiratoria30,35-38. Finalmente, para apoyar la utilización de las presiones antes mencionadas hay que recordar que 40 cm H2O es el umbral de apertura alveolar eficiente en alveolos colapsados39-41, por lo cual la utilización de esta presión debería establecerse sobre todo en los pacientes con ENM que están en riesgo de generar microatelectasias o que francamente ya tienen zonas comprometidas con pérdida de volumen y cierre alveolar secundario, como habitualmente sucede en los niños con AME tipo 1 y otras ENM, debido a la debilidad muscular y la imposibilidad de generar suspiros37.
Es interesante cómo en las series de seguimiento prolongado de pacientes con AME tipo 1, con progresión a capacidad vital (CV) no medible y requerimiento de SVN continuo, Bach y colaboradores han observado que los flujos exsuflados por IEM (FE-IEM), que son un valor entregado por algunos equipos de IEM y que indican la efectividad de la terapia, aumentan durante los años. Es esta observación la que permite a los pacientes evitar la traqueostomía26,42. Por otro lado, si bien es cierto que los equipos de IEM pueden hacer reclutamiento pasivo de volúmenes pulmonares, esto es virtualmente imposible con presiones inspiratorias < de 40 cm H2O26,30,37,42.
Se hace importante precisar, respecto a los protocolos de Bach y colaboradores5-7, que las recomendaciones hechas con anterioridad por nuestro grupo, para la utilización de presiones de IEM ≥50-60 cm H2O, mayores a las señaladas en los artículos que forman parte de esta revisión, se fundamentan en la práctica clínica y períodos prolongados de observación del mismo autor26,42 para optimizar los resultados clínicos, considerando la apropiada expansión del tórax, movilización de secreciones, retorno a la línea de SpO2 sin aporte de oxígeno suplementario, como también la mejoría de los FE-IEM, logrando finalmente evitar la intubación y permitir la extubación. Es así como los únicos pacientes que se ven beneficiados con presiones <50-60 cm H2O son aquellas ENM con compromiso de la primera motoneurona, inestabilidad de la laringe y una eventual obstrucción de la vía aérea superior durante el ciclo de atención, en quienes se puede lograr mayores FE-IEM con menores presiones, utilizando interfases no invasivas. En todos los demás pacientes con ENM, los FE-IEM son mayores cuando las presiones programadas son ≥50-60 cm H2O, e incluso aún más cuando las interfases son invasivas27,42. Recientemente, la información obtenida a través del análisis de las curvas de flujo y presión30, entregadas por los equipos de IEM, permiten observar que no sólo se logra optimizar los FE-IEM, sino que también se logra que el RVP pasivo sea mayor en los pacientes que no pueden cerrar voluntariamente su glotis, como Bach y colaboradores han observado desde 1957, sin efectos adversos42.
Una vez revisados los puntos clave en torno a los protocolos de extubación presentes en la literatura, hay que destacar la efectividad demostrada por la aplicación combinada de SVN e IEM, los que pueden lograr manejar los cuadros de IRA en pacientes con enfermedad neuromuscular y evitar la intubación endotraqueal. Del mismo modo, si finalmente el paciente debió ser intubado, la combinación de IEM y SVN ha demostrado ser la estrategia más adecuada para poder extubar a este tipo de paciente evitando los riesgos que una traqueostomía implica (Figura 3).
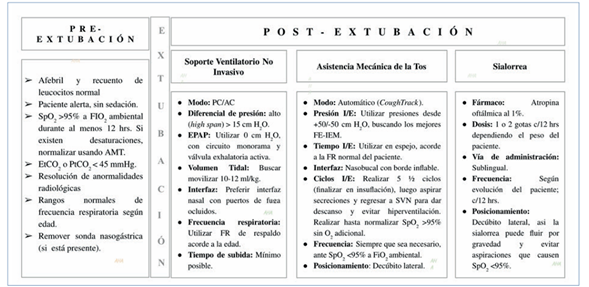
Figura 3 Propuesta de Extubación para Atrofia Muscular Espinal y otras Enfermedades Neuromusculares.
Los protocolos de extubación de pacientes con atrofia muscular espinal, en especial las variantes más agresivas y de presentación temprana, como es AME Tipo 1, y que hayan sido publicados con resultados exitosos, son limitados. Sin embargo, a lo largo de los años se han consolidado aquellos que utilizan el SVN e IEM, incluyendo las presiones de empuje apropiadas para normalizar la ventilación y la SpO2, utilizando PEEP/EPAP igual a 0 con sistemas de exhalación activa o EPAP mínimo con generadores de flujo y PAP bi-nivelado, sumado a la asistencia mecánica intensificada de la tos antes e inmediatamente después de la extubación. Utilizando estas terapias no invasivas los pacientes también pueden ser tratados exitosamente en las agudizaciones respiratorias evitando la intubación endotraqueal.
Glosario
AME: atrofia muscular espinal.
MBI: músculos bulbares inervados.
CVL: capacidad vital al llanto.
IEM: insuflación-exsuflación mecánica.
SVN: soporte ventilatorio no invasivo.
IPAP: presión positiva inspiratoria en la vía aérea.
EPAP: presión positiva espiratoria en la vía aérea.
PEEP: presión positiva de final de espiración.
VNI: ventilación no invasiva.
FIO2: fracción inspirada de oxígeno.
SpO2: saturación periférica de oxígeno.
S/T: spontaneous/timed.
IRA: insuficiencia respiratoria aguda.
ENM: enfermedad neuromuscular.
UCIP: unidad de cuidado intensivo pediátrico.
PVE: prueba de ventilación espontánea.
VMTC: ventilación mecánica por traqueostomía continua.
VMI: ventilación mecánica invasiva.
Vt: volumen tidal.
PIP: presión inspiratoria pico.
RVP: reclutamiento de volumen pulmonar.
CV: capacidad vital.
FE-IEM: flujos exsuflados con insuflación-exsuflación mecánica.
PAP: presión positiva en la vía aérea.