Introducción
El lavaje broncoalveolar, difundido en la literatura con la sigla BAL (del inglés broncho-alveolar lavage), permite la toma de muestras de las vías aéreas distales y se utiliza para el diagnóstico de enfermedad pulmonar difusa, particularmente de causas no infecciosas. Esta técnica se ha utilizado para la caracterización de la prevalencia de la inflamación de las vías aéreas bajas a través del análisis citológico y sus consecuencias desde el punto de vista clínico en equinos. La realización del BAL está indicada en animales con problemas respiratorios de las vías aéreas bajas que cursan con tos, diferentes tipos de secreciones por ambos ollares, epistaxis tras el esfuerzo o presencia de disnea. Está indicada también cuando existe evidencia de bajo rendimiento deportivo, aunque los signos respiratorios típicos estén ausentes (Bullone y Lavoie, 2017; Couëtil et al., 2007; Frezza, 2017; Hermange et al., 2019). Los valores de referencia para la citología proveniente del fluido del BAL (BALF) en equinos, según los criterios adoptados por el American College of Veterinary Internal Medicine (ACVIM), son los siguientes: normal ≤5 % neutrófilos, ≤2 % mastocitos y ≤1 % eosinófilos; asma leve/moderada >10 % neutrófilos, >5 % mastocitos y >5 % eosinófilos; asma severo >25 % neutrófilos (Couëtil et al., 2016).
Nos referimos a asma en equinos con base en la nomenclatura moderna, que permite clasificarlo en dos tipos -según la presencia o ausencia de esfuerzo respiratorio en reposo y otras variables clínicas-: asma leve/moderado, antes llamada inflamación de las pequeñas vías aéreas (IPA), y asma severo, antes llamada obstrucción recurrente de las vías aéreas (ORA). En el caso de asma severo el examen clínico es considerado como una herramienta de alta especificidad, no así en el asma leve/moderado, debido a la baja especificidad de los signos clínicos observados, como baja performance, tos o descarga nasal. Es por este motivo que métodos complementarios como el BAL son necesarios para mejorar la precisión de los diagnósticos entre ambos tipos de asma equino y diferenciarlos de otras afecciones pulmonares como la hemorragia pulmonar inducida por el ejercicio (HPIE), inflamación pulmonar inespecífica, bronquitis, bronquiolitis e inclusive es útil para realizar el diagnóstico diferencial con procesos infecciosos (Couëtil et al., 2016; Hoffman, 2008).
El diagnóstico citológico precoz de asma tiene una gran relevancia debido a que ya existen trabajos que asocian el aumento de determinado tipo celular inflamatorio con la disminución de performance deportiva del equino. Ivester et al. (2018), en su trabajo, observaron que una proporción mayor al 5 % de mastocitos se asocia negativamente el rendimiento de equinos pura sangre de carrera (SPC) y mostraron que por cada punto de porcentaje que aumentan estas células disminuye su velocidad. Asimismo, describieron un efecto negativo similar con la proporción mayor a un 5 % de neutrófilos.
Por otra parte, la HPIE es una afección relevante en equinos deportivos porque afecta de forma negativa su rendimiento, por ello, la técnica del BAL es una gran herramienta debido a que permite el diagnóstico precoz en etapas en las que no es detectado por endoscopia. Para su diagnóstico por citología se utiliza como referencia la proporción de hemosiderófagos en relación con los macrófagos alveolares (H/M). Entonces, una relación >17 % de H/M se puede clasificar como HPIE a través del análisis citológico del BALF (Depecker et al., 2015; Hermange et al., 2019).
A nivel local, la literatura sobre el estudio de desórdenes respiratorios a través del BAL es incipiente, encontramos solo dos trabajos de tesis publicados por integrantes de nuestro equipo, estos abarcan la puesta a punto de esta técnica y su uso en el diagnóstico (Carluccio y Felvinczi, 2021; Guerrero, 2023). Asimismo, las herramientas de rutina utilizadas a nivel nacional, como son el examen clínico y el estudio endoscópico, no permiten la detección de algunas afecciones respiratorias en estadios tempranos. Por ello, surge la hipótesis de la existencia de afecciones respiratorias, como son el asma leve/moderado, HPIE e inflamación pulmonar inespecífica sin diagnóstico precoz en equinos deportivos. El objetivo del presente trabajo fue implementar y utilizar el BAL en caballos SPC de carrera activos y radicados en el Hipódromo Nacional de Maroñas con el fin de diagnosticar en forma precoz estos desórdenes inflamatorios a nivel respiratorio.
Materiales y métodos
Animales
Para este trabajo se seleccionaron 12 equinos SPC de 2 a 6 años y un peso de 400-500 Kg, en condiciones de estabulación y entrenamiento, residentes del Hipódromo Nacional de Maroñas, Montevideo, Uruguay. Se incluyeron en el estudio equinos que presentaron una alteración citológica del BALF compatible con un desorden inflamatorio de las vías aéreas bajas. Los procedimientos realizados contaron con la aprobación del protocolo experimental de la Comisión de Ética en el Uso de Animales (CEUA) de la Facultad de Veterinaria, Udelar (Exp. N.o 1536).
Examen clínico
Se realizó la anamnesis al responsable de los equinos incluidos en este estudio. Utilizando el índice HOARSI (del inglés horse owner asessed respiratory signs index) se categorizaron del 1 al 4, en saludable, medianamente, moderadamente y severamente afectados, respectivamente (Laumen et al., 2010; Ramseyer et al., 2007). En una segunda instancia se procedió a realizar un examen objetivo particular (EOP) del aparato respiratorio, en la cual se examinaron los animales valorando la relación de la respiración en estación, relación toracoabdominal, inspiración y espiración, presencia de disnea marcada en reposo y presencia de moco en los ollares o morro. Se realizó la prueba de reflejo tusígeno manual, la auscultación pulmonar de ambos hemitórax y la percusión en los espacios intercostales en la zona de referencia semiológica pulmonar para la especia equina. Luego, a cada animal se le extrajo una muestra de sangre de la vena yugular externa con una aguja 18 G y en un tubo con EDTA, para la realización de un hemograma de rutina (analizador hematológico automático, Mythic 18, Orphée, Ginebra, Suiza).
Técnica del BAL
Los animales fueron sedados utilizando xilacina 10 % (1 mg/kg de peso vivo, endovenoso) y sujetados mediante mordaza, se desinfectaron los ollares con clorhexidina (0,045 g/L). Para el BAL se utilizó una sonda broncoalveolar de 300 cm de largo, 10 mm de diámetro externo y 2,2 mm de diámetro interno (BAL 300, MILA, EE. UU.), previamente desinfectada en solución de clorhexidina. A continuación, se introdujo la sonda flexible a través del ollar, por el meato nasal ventral hacia la tráquea y se avanzó de forma suave hasta que esta ofreció resistencia (bronquio más distal del lóbulo caudal). De forma simultánea, se aplicaron bolos de lidocaína al 2 % (20 mg/mL) con un volumen de 10 mL para abolir el reflejo tusígeno durante la maniobra. Una vez que la resistencia a la maniobra no permitió el avance de la sonda, se insufló el balón con 5 a 10 mL de aire para fijarla y se procedió a tomar la muestra. Para ello, se introdujeron 300 mL de solución fisiológica estéril a 37 °C en alícuotas de 60 mL con jeringas y luego se recuperó el BALF. Procedimiento adaptado a lo descrito por Frezza (2017).
Valoración macroscópica del BALF
Las muestras fueron evaluadas macroscópicamente a trasluz, sobre fondo claro y girando de forma suave el tubo para poder observar las características del fluido (color, olor, turbidez, presencia de surfactante, flóculos, detritos y partículas en suspensión). Protocolo adaptado de Frezza (2017).
Valoración microscópica del BALF
Las muestras fueron procesadas en las primeras 6 horas de su colecta en tubos Falcon estériles de 50 mL. Se centrifugó todo el volumen recuperado del BAL por animal a 1000 rpm (70 g) por 10 minutos a 21 °C. Se retiró el sobrenadante de cada uno de los tubos y se recuperó el pellet para conformar un pool por individuo. Posteriormente, se repitió la centrifugación y se concentró en un único pellet para la preparación de un extendido y su posterior tinción con May-Grünwald-Giemsa (MGG). Para la cuantificación del perfil citológico se realizó el recuento de 300 células nucleadas consecutivas mediante la visualización microscópica, utilizando el objetivo de inmersión para alcanzar una magnificación de 100×, de varios campos por extendido. El número de cada tipo celular se expresó en porcentaje en relación con el total de células. Las células se identificaron como macrófagos, linfocitos, neutrófilos, eosinófilos, mastocitos y hemosiderófagos, acorde a la clasificación descrita por Frezza (2017).
Resultados
Diagnóstico precoz de desórdenes respiratorios a través del BAL
En el análisis del BALF recolectado se recuperó entre el 70 y el 85 % del volumen total instilado. Asimismo, a nivel macroscópico se pudo apreciar que la mayoría (10/12) de las muestras tenían una tonalidad clara, escasa turbidez, con flóculos asociado a la presencia de moco y espuma, lo que muestra la presencia de surfactante e indica una correcta toma de muestra (figura 1 A). Sin embargo, dos muestras presentaron cambios en la coloración, tonalidad rojiza/amarronada (figura 1 B). Por otra parte, a través del estudio citológico del BALF se detectaron recuentos compatibles con tres patologías: asma leve/moderado, HPIE e inflamación pulmonar inespecífica (tabla 1 y figura 2). En el caso de asma leve/moderado se encontró un aumento en mastocitos o eosinófilos (2/12 equinos), para HPIE se encontró un aumento en la relación de H/M mayor al 20 % (3/12 equinos). Por último, para la inflamación pulmonar inespecífica se encontraron valores altos de macrófagos (7/12 equinos).
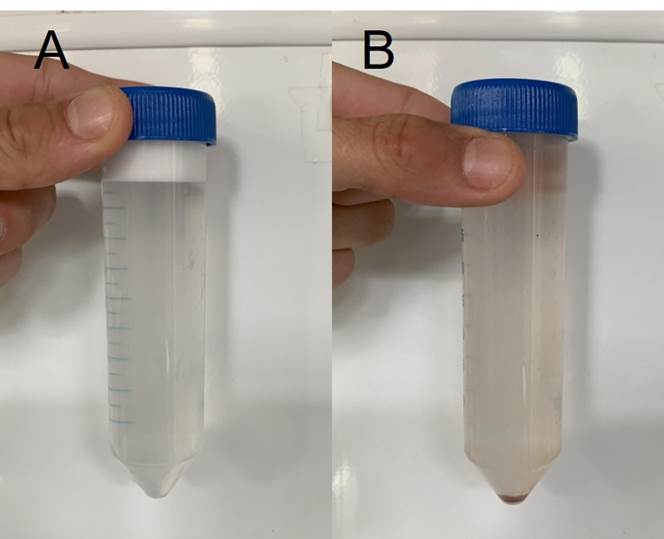
Figura 1: Aspecto macroscópico de las muestras obtenidas en el fluido del lavaje broncoalveolar (BALF): A) Se observa tonalidad clara, escasa turbidez y presencia del surfactante con flóculos. B) Se ve un tono rojizo-amarronado de la colecta con flóculos.
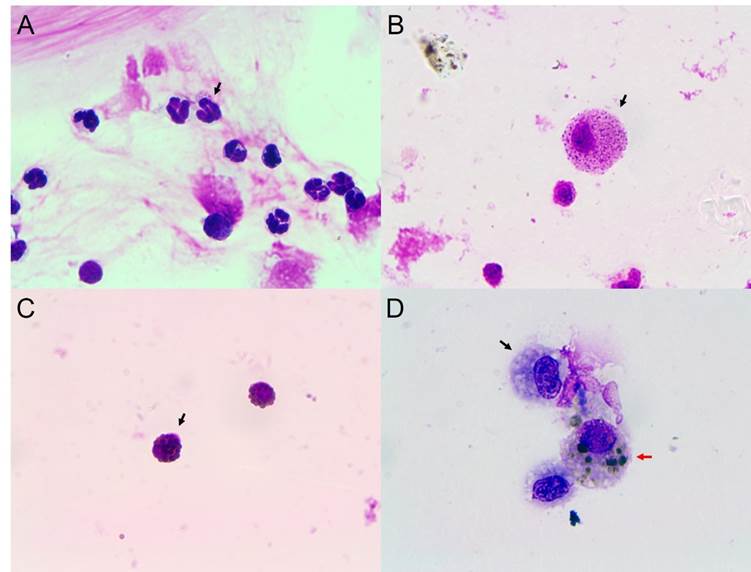
Figura 2: Imágenes microscópicas de la citología del fluido del lavaje broncoalveolar (BALF) magnificadas 100× y teñidas con May-Grünwald-Giemsa. Se identifican diferentes tipos celulares en cada imagen señalada con una flecha: A) Neutrófilo, B) Mastocito, C) Eosinófilo, D) Macrófago (flecha negra) y hemosiderófago (flecha roja).
Tabla 1: Resultado de análisis del BALF de animales con desórdenes respiratorios detectados
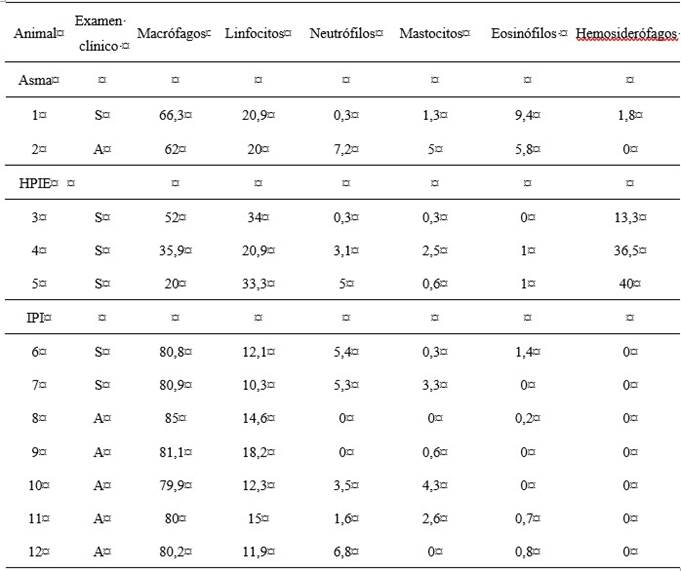
Los resultados son expresados en % de un total de 300 células contadas. A: asintomático S: sintomático
Al explorar los datos del examen clínico de los equinos seleccionados por tener una citología alterada, encontramos tanto animales sintomáticos, en los grados 1, 2 y 3 del índice HOARSI, como asintomáticos. Los principales signos observados fueron corrimiento nasal, tos y bajo rendimiento, se presentaron solos o combinados. Asimismo, el grupo sin signología clínica fue conformado por los equinos que no presentaban signos clínicos evidentes ni antecedentes de haber sufrido enfermedades relacionadas al aparato respiratorio (tabla 2).
Discusión
La descripción del uso de la técnica del BAL para el diagnóstico en equinos solo tiene incipientes reportes de dos trabajos académicos de nuestro grupo (Carluccio y Felvinczi, 2021; Guerrero, 2023), por lo que este reporte resulta relativamente novedoso para Uruguay. Sin embargo, la técnica del BAL esta descripta desde 1980 en América del Norte y, en la actualidad, sigue siendo de gran utilidad para la colecta de secreciones respiratorias considerándose una muestra representativa para el diagnóstico de enfermedad pulmonar difusa. Asimismo, en Canadá la evaluación citológica del BALF es utilizada de manera rutinaria en clínica y en la investigación para el monitoreo y diagnóstico de enfermedades difusas de las vías aéreas inferiores (Jean et al., 2011), al igual que en Australia (Secombe et al., 2015) y Estados Unidos (Ivester et al., 2018). Por ello, parece importante incorporar esta herramienta diagnóstica en medicina equina a nivel nacional.
Los animales muestreados en este trabajo toleraron bien el procedimiento del BAL, sin presentar complicaciones tales como broncoespasmo o síntomas de infección pulmonar posterior. Todos los individuos continuaron con su actividad regular a las 48 h de reposo posterior a la extracción de muestras, lo que revela que fue posible su implementación en el medio nacional -debido a su fácil realización y ausencia de complicaciones relevantes- y coincide con lo reportado a nivel internacional (Hoffman, 1999; Lessa et al., 2007).
En el presente trabajo se utilizó la técnica a ciegas para el muestreo de un pulmón a través del BAL, la que es considerada representativa de ambos pulmones y es el método de toma de muestra más utilizado (Couëtil et al., 2016; Frezza, 2017; Hermange et al., 2019; Kinnison et al., 2022). Sin embargo, otros trabajos sugieren la utilización del endoscopio para el muestreo dirigido del BALF ya que permite seleccionar el pulmón a lavar (Lucas, 2012). Asimismo, otros trabajos realizan el muestreo de ambos pulmones debido a que existe evidencia de una potencial asimetría en la citología de cada pulmón y esto podría modificar el diagnóstico (Couëtil et al., 2020; Vargas et al., 2017). A pesar de ello, el muestreo ciego es el más utilizado, esto puede deberse a que el dirigido tiene mayor complejidad, ya que implica visualizar el sitio a lavar y seleccionar el pulmón, lo que requiere el uso de un endoscopio, además de realizar el procedimiento 2 veces para explorar ambos pulmones.
En nuestro estudio el volumen que se instiló en el BAL fue de 300 mL de solución fisiológica, siguiendo las recomendaciones internacionales. El volumen a utilizar varía entre 250 a 500 mL, según lo expresado en diferentes artículos (Couëtil et al., 2016; Couëtil et al., 2020). Sin embargo, volúmenes superiores a los 500 mL pueden alterar los porcentajes de recuento celular, observándose proporciones menores de neutrófilos, lo que altera el diagnóstico (Orard et al., 2016). Por otra parte, a la inspección macroscópica del BALF se pudo observar que las muestras presentaban características normales de tonalidad clara, escasa turbidez y presencia de surfactante, como se describe en la literatura (Lessa et al., 2005). No obstante, Hoffman (2008) describe que la coloración de las colectas puede presentar tonos rojizos debido a la presencia de sangre proveniente del pulmón asociada a la HPIE u otras causas de sangrado patológicas, o incluso a errores en la manipulación de la sonda del BAL. En este mismo sentido, 2 muestras de nuestro estudio presentaron una tonalidad rojiza, una de ellas con visualización clara de glóbulos rojos presentes al analizar la citología. Este hallazgo es congruente con hemorragia reciente, posiblemente provocada por traumas durante la técnica. En el segundo caso, se observó gran cantidad de hemosiderófagos lo que provoca un cambio en la coloración, esto indica la cronicidad del proceso compatible con HPIE y no asociado al procedimiento (Hermange et al., 2019; Mahalingam-Dhingra et al., 2023).
En nuestro trabajo para el análisis citológico de las muestras obtenidas del BAL, se utilizó la tinción de MGG acorde a lo reportado por varios autores (Gy et al., 2019; Hansen et al., 2018). Sin embargo, otros trabajos utilizan tinciones diferentes como Wright-Giemsa, Wright, Diff-Quick, pero no hay consenso al respecto (Kinnison et al., 2022). No obstante, algunos autores no recomiendan el uso de Diff-Quick, ya que no son apropiadas para la detección de mastocitos porque los gránulos metacromáticos se colorean débilmente (Hughes et al., 2003; Richard et al., 2010). Por otro lado, en cuanto al recuento de células, en este trabajo se realizó un recuento total de 300 células para el análisis citológico del BALF, acorde a lo reportado por otros autores (Hue et al., 2020; Rossi et al., 2018). Sin embargo, no existe una estandarización de la cantidad mínima de células que se debe realizar para el diagnóstico citológico, se puede encontrar en la literatura rangos de recuento entre 200 hasta ≥ 500 células (Couëtil et al., 2020; Ivester et al., 2018; Kinnison et al., 2022; Miskovic Feutz et al., 2015).
En cuanto al diagnóstico de asma equina se encontraron 2 animales (animal 1 y 2) con asma leve/moderado: el primero sintomático, con una escala de HOARSI de 3, que presentó un 9,4 % de eosinófilos; el segundo asintomático, con una estatificación en la escala de HOARSI de 1, que presentó además mastocitos 5 % y eosinófilos 5,8 %. Los mastocitos son células vinculadas al diagnóstico de asma leve/moderado en equinos con signos o sin signos respiratorios. Además, su aumento en el porcentaje ha sido correlacionado con aumento de la hiperreactividad en la prueba de bronco-provocación con histamina en caballos con intolerancia al ejercicio (Bullone y Lavoie, 2017; Couëtil et al., 2016; Robins et al., 2023).
Referido al diagnóstico de HPIE se observó un alto porcentaje de hemosiderófagos en el BALF compatibles con esta afección para 3 de los animales estudiados. Dos de ellos (animal 3 y 4) presentaban signología respiratoria positiva (HOARSI de 2) y el otro (animal 5) no presentó alteraciones clínicas respiratorias (HOARSI de 1). En todos los casos el diagnóstico HPIE fue subclínico, ya que ninguno presentaba antecedentes. En este trabajo se tomó como criterio para el diagnóstico citológico de HPIE una relación H/M mayor ≥ 17 %, acorde a lo descrito en la literatura (Depecker et al., 2015; Hermange et al., 2019). Sin embargo, no existe acuerdo al respecto, encontramos en la literatura valores superiores al 20 % para considerar HPIE positivo (Depecker et al., 2014). Asimimo, otros autores tiene diferentes criterios citológicos para el diagnóstico de HPIE, uno de ellos se basa en la clasificación según la puntuación/cuantificación de hemosiderina en macrófagos alveolares (Depecker et al., 2015; Mahalingam-Dhingra et al., 2023; Richard et al., 2010). Por otro lado, Michelotto et al. (2011) plantean que la sola presencia de hemosiderófagos es suficiente para considerar a un animal HPIE positivo. El método para determinar que un animal es positivo a HPIE por citología del BALF varía acorde al criterio que se adopte. Entonces, el hallazgo de hemosiderófagos es clave en el diagnóstico de HPIE y determinar el punto de corte para considerarlo patológico es un desafío que se debe seguir estudiando para llegar a un consenso. Asimismo, la endoscopia y el examen clínico de los equinos son complementarios y no deben ser reemplazados por el estudio citológico para el diagnóstico de esta patología.
De los animales muestreados en nuestro estudio, 7/12 equinos presentaron inflamación pulmonar inespecífica reflejada a través de una proporción alterada de macrófagos alveolares (>60 %) en la citología del BALF. Los porcentajes de macrófagos pueden ser muy variables, se consideran normales recuentos con porcentajes en el rango de 50 a 70 % (Cian et al., 2015; Hoffman, 2008). En nuestro trabajo 5/7 equinos que presentaron alteraciones en el recuento de macrófagos fueron asintomáticos, los 2 restantes presentaban signos respiratorios positivos. Este aumento por encima del límite normal se ha relacionado con la presencia de tos crónica en equinos SPC (Michelotto et al., 2013). La tos se presentó como signo clínico en 2/7 animales con recuento elevado de macrófagos. Debido a la escasa información referente al predominio de macrófagos y su asociación con inflamación pulmonar, clasificamos a estos equinos con mayor predominio de macrófagos en pacientes con inflamación pulmonar inespecífica, ya que estas células representan una de las primeras líneas de defensa pulmonar (Wilson et al., 2020).
Conclusiones
La implementación de la técnica del BAL por primera vez a nivel nacional, en equinos SPC en actividad, permitió realizar el diagnóstico precoz de diferentes desórdenes respiratorios de las vías aéreas distales. Asimismo, el estudio citológico del BALF permitió identificar equinos con asma leve/moderado, HPIE e inflamación pulmonar inespecífica, tanto en sintomáticos como en asintomáticos. Este estudio muestra el valor del BAL como herramienta de rápida detección de animales subclínicos y fácil implementación. Se espera que pueda ser incluida como técnica de rutina al igual que la endoscopia, ecografía de tórax y aspirado transtraqueal en nuestro país.