Introducción
El linfoma, también llamado linfoma maligno o linfosarcoma, es un tumor linfoide que se origina en órganos sólidos (linfonódulos, hígado y bazo) y representa una de las neoplasias malignas más comunes, comprende del 1,3 al 2,8 % del total de los tumores de los equinos (Taintor y Schleis, 2011). Es, además, la neoplasia hematopoyética más frecuente en esta especie, se describen, también, la leucemia linfoide y el mieloma de células plasmáticas (Muñoz et al., 2010). No se han reportado factores de riesgo, predilección de sexo, raza o edad. Sin embargo, la mayoría de los casos reportados son caballos de entre 4 y 10 años, lo que sugiere que es una enfermedad de caballos jóvenes (Morales-Briceño et al., 2016; Muñoz et al., 2010).
Las presentaciones clínicas del linfoma en equinos son multicéntrico o generalizado, alimentario, mediastinal, cutáneo y tumores solitarios. La forma multicéntrica es la más frecuente y se caracteriza por linfadenopatía generalizada (linfonódulos superficiales o profundos) con o sin afectación hepática, esplénica, renal, pulmonar o de la médula ósea (linfoma leucemizado). El linfoma alimentario es el más frecuente de las neoplasias intestinales (Bacci et al., 2020; Taylor et al., 2006) y también existen reportes de casos de afección del sistema nervioso central y periférico (Torrent et al., 2019). Si bien los signos clínicos dependen de los órganos afectados y de su compromiso, los animales, por lo general, presentan signos inespecíficos, como pérdida de peso, edema ventral, linfadenopatía, depresión, letargia y fiebre recurrente (Muñoz et al., 2010). Las manifestaciones clínicas son típicamente de evolución lenta, aunque pueden aparecer de forma aguda. El diagnóstico de un caballo sospechoso de padecer linfoma debería incluir un examen físico; palpación rectal, para evaluar linfonódulos mesentéricos o masas abdominales; perfil hematológico completo y bioquímica sérica; abdominocentesis o toracocentesis, si se sospecha que estas cavidades están involucradas; ultrasonografía de hígado y bazo; y punción o biopsia de lesiones (Muñoz et al., 2010). Los equinos con linfoma suelen estar anémicos, ya sea por la destrucción prematura de eritrocitos recubiertos de anticuerpos, por su inadecuada producción medular, por inflamación crónica, por pérdida de sangre por úlceras intestinales o por una combinación de estos mecanismos (Muñoz et al., 2010; Taintor y Schleis, 2011). La leucocitosis con neutrofilia ha sido reportada en algunos casos (Luethy et al., 2019; Taintor y Schleis, 2011). El recuento de linfocitos se encuentra normal o levemente disminuido en la mayoría de los casos. Sin embargo, un reporte demostró que 14 de 37 equinos con linfoma presentaron leucemia linfocítica, por lo general, asociada al compromiso de la médula ósea. En estos casos, el estudio citológico de sangre periférica reveló la presencia de linfocitos atípicos o inmaduros (Taintor y Schleis, 2011). Los hallazgos de bioquímica sérica incluyen hiperfibrinogenemia, hipoalbuminemia e hiperglobulinemia. La hipercalcemia es considerada patognomónica para el diagnóstico de linfoma, sin embargo, muchos caballos se encuentran hipocalcémicos por la hipoalbuminemia (Taintor y Schleis, 2011). Tanto la punción con aguja fina como la biopsia (incisional o excisional) de lesiones sospechosas son los métodos de elección para confirmar el diagnóstico de linfoma (Taintor y Schleis, 2011). En muchos casos, el linfoma puede diagnosticarse de forma presuntiva mediante necropsia, en especial aquellos localizados en el bazo (Morales-Briceño, 2020). Histológicamente el linfoma es una neoplasia compleja que puede tener origen en tipos o subtipos celulares asociados a los linfocitos B o T. La inmunofenotipificación celular puede realizarse por inmunohistoquímica o citometría de flujo (Cian et al., 2013). Esta última permite la evaluación cuantitativa y cualitativa de las células hematopoyéticas al considerar el tamaño celular y la expresión/identificación de determinados antígenos en los linfocitos neoplásicos denominados clusters de diferenciación (CD), que permiten su tipificación y la detección de aberraciones (Sánchez et al., 2020). Si bien la citometría de flujo es ampliamente utilizada en caninos y felinos, en equinos se ve limitada por la baja disponibilidad de anticuerpos específicos de la especie (Parodi, 2001).
La Organización Mundial de la Salud (OMS) desarrolló un sistema de clasificación para el linfoma, publicado en 2001 y actualizado en 2008, que integra información de topografía, morfología celular, inmunofenotipo, características genéticas, presentación clínica y evolución, para su diagnóstico, plan terapéutico y pronóstico (Meyer et al., 2006; Seelig et al., 2016). Un estudio que comprendió 203 caballos con linfoma clasificados con el criterio de la OMS demostró que, a diferencia de los humanos y los perros, el linfoma más frecuente en los equinos es el T-cell-rich large B cell lymphoma (TCRLBCL), con el 43 % de los casos, seguido del linfoma periférico de células T (PTCL), con el 22 % (Durham et al., 2012).
El abordaje terapéutico del linfoma equino es similar al de animales de compañía y depende del estatus fisiológico del paciente, la localización y extensión de la enfermedad y el compromiso del propietario. Las opciones terapéuticas incluyen exéresis quirúrgica de tumores solitarios, radioterapia, corticoides y quimioterapia o una combinación de estas (Luethy et al., 2019). Al tratarse de una enfermedad sistémica, la quimioterapia es la alternativa de mayor utilidad, la doxorrubicina, la vincristina, la L-asparginasa, la lomustina, la ciclofosfamida, el arabinosido de citosina y los corticoides son los quimioterápicos más utilizados (Luethy et al., 2019). Sin embargo, cabe recordar que estas son opciones paliativas y no curativas.
Se plantea como objetivo reportar un caso de un linfoma alimentario en un caballo cuarto de milla. A su vez, se pretende discutir sus particularidades respecto a la bibliografía citada y los casos clínicos similares reportados en la literatura.
Materiales y métodos
Se describe el caso clínico de un equino macho castrado, cuarto de milla, de 10 años, pelaje alazán procedente de un haras del departamento de Maldonado, Uruguay. El haras tiene un plan sanitario de dos desparasitaciones anuales (junio y diciembre) con doramectina 1 % (rotación anual de drogas previo control por conteo de huevos en materia fecal) y vacunación con Lexington 8 (Vencofarma, Brasil) cada seis meses (junio y diciembre) de todas las categorías (los potrillos y yeguas de cría presentan dosificaciones adicionales según categoría), supervisado por profesional responsable. La historia clínica mostró que el equino presentaba pérdida de peso en invierno (junio, julio y agosto) desde hace dos años, que respondía a la suplementación de la dieta con ración peleteada con base en maíz laminado, avena laminada, afrechillo de trigo, harina de soja, melaza y aceite vegetal (energía metabolizable 3238,63 kcal por kilo en base materia seca, proteína 13 %, extracto etéreo 4 %) por períodos que no excedían los dos meses. El animal se encontraba en condiciones de campo, no realizaba ningún tipo de actividad deportiva ni de trabajo. Se alimentaba de pastura de campo natural exclusivamente. Las pasturas naturales de la región están compuestas de pastos nativos (Stipa nessiana, Setaria geniculata, Paspalum notatum, Piptochaetium stipoides, Bromus auleticus, Botriochloa laguroides y Chloris bahiensis), hierbas y pequeños arbustos.
El motivo de la consulta fue la pérdida crónica de peso (emaciación crónica) y diarrea aguda de 24 horas de evolución. En el examen clínico se observó una condición corporal 3/9 (Carter et al., 2009; Henneke et al., 1983), depresión, mucosas congestivas, fiebre, frecuencia cardiaca de 60 latidos por minuto, respiratoria de 35 respiraciones por minuto y motilidad intestinal normal en los cuatro cuadrantes. Los linfonódulos regionales palpables no presentaron alteraciones. Durante el examen el equino defecó materia fecal de consistencia líquida, color verde y olor normal. Se indicó dipirona (metamizol) como antipirético (22 mg/kg IV cada 12 horas), terapia de fluidos (10 L de suero Ringer Lactato intravenoso a una tasa de 5 ml/kg/hora), antibioticoterapia con penicilina-estreptomicina (20 000 UI/kg IM cada 24 horas por 7 días) y gentamicina (6,6 mg/kg IV cada 24 horas por 7 días). Se consideraron dentro del diagnóstico diferencial colitis infecciosa, colitis parasitaria, enfermedad inflamatoria intestinal, neoplasia gastrointestinal (linfoma alimentario o carcinoma), falla hepática, enteropatía perdedora de proteínas y úlceras gastrointestinales (Tamzali, 2006).
Se extrajeron 10 mL de sangre de la vena yugular, con agujas 21G y se dividieron en 2 submuestras. Una de ellas se colocó en un tubo con EDTA, para la realización del hemograma, y la otra en un tubo sin anticoagulante, para la realización del funcional hepático. Las muestras fueron analizadas en el Laboratorio de Análisis Clínico, Endocrinología y Metabolismo Animal de la Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay. El hemograma se realizó en un contador hematológico (Orphée, Mythic 18 Vet, Ginebra, Suiza). Para el recuento diferencial de los leucocitos y valoración de la morfología celular se realizó un frotis sanguíneo teñido con técnica de May-Grünwald Giemsa. El funcional hepático se determinó en un equipo semiautomático, CB 350i (Wiener Lab. Group, Rosario, Argentina). El recuento hematológico reveló alteraciones del leucograma, como leucocitosis asociada a linfocitosis, marcada neutrofilia con desvío a la izquierda y monocitosis. Por otro lado, la línea roja se mantuvo dentro de los parámetros normales (tabla 1). El estudio de la morfología celular evidenció la presencia de linfocitos reactivos y atípicos, linfoblastos circulantes, así como también la presencia de agregados plaquetarios. El funcional hepático presentó aumento significativo de la actividad sérica de la enzima fosfatasa alcalina e hipoalbuminemia, mientras que las proteínas totales, la gamma glutamiltransferasa (gamma GT), la aspartato aminotransferasa (AST), el colesterol y la bilirrubina no presentaron alteraciones.
Tabla 1: Análisis hematológico y bioquímica sérica del caso clínico.
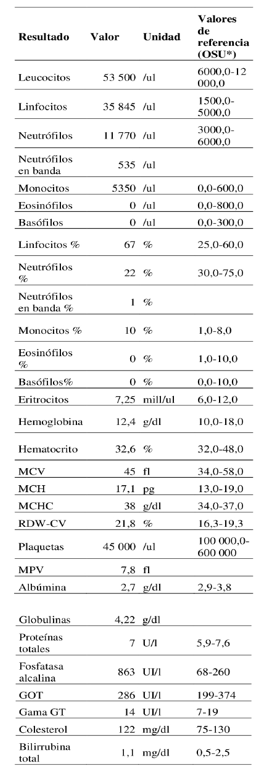
Nota: *Los valores de referencia son tomados de la Oregon State University (https://vetmed.oregonstate.edu/sites/vetmed.oregonstate.edu/files/hematology_reference_intervals_6.5.23.pdf
Al día 7 postratamiento, el paciente no presentó una respuesta a la terapéutica y su evolución y pronóstico no fueron satisfactorios. Con el consentimiento del propietario se decide practicar la eutanasia mediante aplicación de clorhidrato de lidocaína 2 % intratecal con el animal en plano quirúrgico de anestesia general. La necropsia fue realizada en el establecimiento luego de 2 horas de la muerte del animal, mediante la técnica de necropsia descripta para équidos (Morales-Briceño, 2020). Se observó emaciación severa. En el abordaje de la cavidad abdominal, se encontraron en el bazo nódulos pálidos de hasta 1 cm de diámetro aproximadamente sobre su superficie, homogéneos, bien delimitados y apenas elevados. (Fig 1) Se encontraron alteraciones en los linfonódulos del bazo, colon mayor y ciego, de tamaño variable, desde 3 hasta 10 cm de diámetro aproximado y forma irregular, con áreas de necrosis y hemorragia.
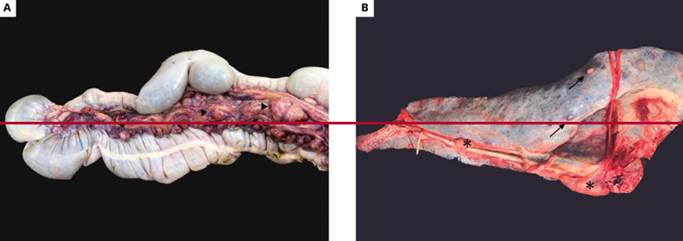
Figuras 1: A y B: A) Hallazgos de necropsia de colon izquierdo. Se destaca linfadenopatía de los ganglios cólicos (triángulos). B) Hallazgos de necropsia en bazo. Se observan nódulos (flechas) y linfadenopatía de la cadena ganglionar esplénica (asteriscos).
Se extrajeron muestras para análisis histopatológico de bazo, ciego, colon mayor y linfonódulos asociados a los tres órganos. Estas fueron fijadas en formaldehido al 10 % y remitidas al Laboratorio de Diagnóstico de la Unidad de Patología de la Facultad de Veterinaria, Universidad de la República, Montevideo, Uruguay.
Las muestras fijadas en formaldehído al 10 % fueron procesadas por los métodos convencionales histológicos y teñidas con coloraciones de rutina hematoxilina y eosina, luego se observaron en el microscopio óptico de luz transmitida (Nikon Eclipse E200, China).
Los resultados histopatológicos del bazo denotaron la presencia de abundantes linfocitos de aspecto tumoral, muy pleomórficos, con anisocitosis y anisocariosis evidentes (células gigantes, algunas de ellas, multinucleadas) y múltiples figuras mitóticas -11 mitosis por campo de alto poder (HPF), 40x-. (Fig 2) El proceso se acompañaba por focos de necrosis y hemorragia extensa. Los linfonódulos presentaron similares características histológicas, con proliferación de linfocitos de aspecto tumoral, muy pleomórficos, con presencia de anisocitosis y anisocariosis evidente, múltiples figuras mitóticas -9 mitosis por campo de alto poder (HPF), 40x-, acompañado de congestión, edema, hemorragia y necrosis focales. La lámina propia y las vellosidades del ciego y el colon estaban invadidas por linfocitos tumorales de aspecto similar a lo descrito antes. Se observó una estructura quística (parasitaria) sobre la superficie mucosa cecal. Adicionalmente, la superficie mucosa del colon estaba sustituida por un nódulo de alta celularidad constituido por linfocitos tumorales, muy pleomórficos, con necrosis y hemorragia extensas. Estos hallazgos fueron informados como linfoma alimentario.
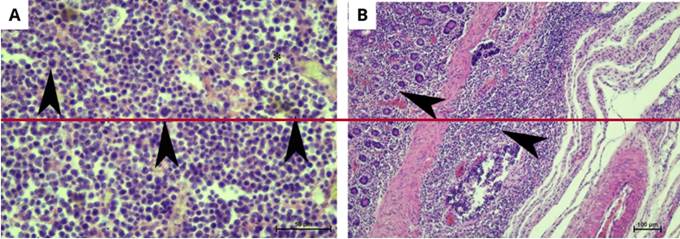
Figuras 2: A y B: A) Histopatología de linfonódulo. Se observa proliferación de linfocitos de aspecto tumoral muy pleomórficos, anisocitosis y anisocariosis evidente (asteriscos), múltiples figuras mitóticas (cabezas de flecha). (H-E. 40x. Barra de escala = 50 µm). B) Histopatología de muestra extraída de la totalidad de la pared intestinal. Se observa invasión de linfocitos tumorales de la lámina propia y entre vellosidades (cabezas de flecha). (H-E, 10x. Barra de escala = 100 µm).
Discusión
Este caso clínico-patológico describe por primera vez en Uruguay un linfoma alimentario en un equino de raza cuarto de milla. El linfoma multicéntrico es el tipo de linfoma más frecuente en caballos, seguido de la forma cutánea y, en tercer lugar, del linfoma alimentario o intestinal (Durham et al., 2012; Muñoz et al., 2010). Al igual que lo descrito en este caso clínico, la literatura reporta que la edad media de presentación de linfoma alimentario son los 10,7 años de edad, y la raza cuarto de milla es en la que se presenta con mayor frecuencia (Durham et al., 2012). El diagnóstico definitivo del linfoma en estadios avanzados es un desafío y requiere del análisis clínico, de laboratorio e histológico de las lesiones, lo que incluye el estudio citológico e inmunofenotípico para su confirmación.
Este reporte de caso coincide con los signos clínicos del linfoma alimentario equino descritos en la literatura, aunque el característico edema ventral no fue observado en nuestro paciente, a pesar de presentar hipoalbuminemia (Muñoz et al., 2010; Taintor y Schleis, 2011). Reportes previos han documentado a la anemia como la alteración hematológica más frecuente, mientras que la línea blanca presenta resultados variables (Muñoz et al., 2010). El hemograma realizado al paciente no evidenció alteraciones en la serie roja, pero sí en la serie blanca. Se destacó una leucocitosis asociada a linfocitosis junto con neutrofilia con desvío a la izquierda. El desvío a la izquierda hace referencia a una demanda tisular aumentada, para la cual la médula responde liberando formas inmaduras. La neutrofilia puede ser resultado de la inflamación en respuesta a la necrosis tumoral, que tendría que acompañarse de monocitosis, como ocurre en este caso. El aumento considerable de los linfocitos nos plantea el desafío de considerar a la leucemia linfoide como principal diagnóstico diferencial. La leucemia linfocítica crónica es una proliferación de linfocitos neoplásicos en la médula ósea que se caracteriza por un aumento persistente de linfocitos circulantes que son morfológicamente normales (maduros), pero no funcionales (Dascanio et al., 1992). Por otro lado, el linfoma es una neoplasia de los órganos linfoides sólidos que se caracteriza por presentar células neoplásicas grandes, con grandes núcleos y nucléolos visibles. Sin embargo, en el linfoma, la médula ósea podría estar infiltrada (linfoma leucémico) y en ese caso debería diferenciarse de la leucemia linfoide primaria, para ello sería necesaria una biopsia de médula ósea y mielograma. A pesar de no contar con estos estudios, los hallazgos de necropsia e histopatológicos son claros indicativos de linfoma. En la literatura se mencionan a la hiperfibrinogenemia, hipoalbuminemia e hiperglobulinemia como las alteraciones bioquímicas más frecuentes (Taintor y Schleis, 2011). En este caso clínico, los valores de albúmina coinciden con los reportados por la bibliografía, así como la relación albúmina/globulina, que se encontró alterada. Los valores de fibrinógeno y la calcemia no fueron evaluados en este caso. El aumento de la FAS en el funcional hepático no provee información relevante para el diagnóstico de la patología.
En el presente caso de estudio existió un fuerte predominio de células con características tumorales y abundantes figuras mitóticas (9/HPF) que infiltraron el ciego, el colon, el bazo y los linfonódulos asociados a los tres órganos. Utilizando el criterio sugerido por la OMS, podemos aseverar que estamos ante un cuadro de linfoma alimentario de grado 5b, que implica la manifestación de la enfermedad tanto en la sangre como en órganos internos y la presencia de signos sistémicos.
La ausencia de la inmunofenotipificación celular es una limitante de este caso. Cabe destacar que esta información, además del valor diagnóstico, representa una herramienta fundamental para el estudio de tratamientos diferenciales del linfoma según el tipo celular que lo genera en equinos.
Conclusión
Se reporta un linfoma alimentario en un caballo cuarto de milla, mediante un estudio clínico-patológico. Este caso corresponde al primer caso clínico descrito en equinos en Uruguay, por lo que debe ser incluido dentro del diagnóstico diferencial en casos de emaciación crónica. Esto promueve el desarrollo de técnicas complementarias de diagnóstico, como inmunohistoquímica y citometría de flujo, con fines de diagnóstico, para mejorar la valoración terapéutica y su pronóstico.















