Introducción
Descrita por primera vez por Abrams et al. 1 en 1973, la Sialometaplasia Necrotizante (SMN) es una lesión benigna rara, autolimitante y autoregenerativa que afecta predominantemente a las glándulas salivales menores 1-3. La SMN constituye aproximadamente el 0.03% de las biopsias orales 4. Aunque la mayoría de las lesiones afectan a las glándulas mucoserosas del paladar duro, también se han reportado casos en glándulas salivales mayores, como la glándula submandibular 5.
La fisiopatología exacta de la SMN aún es desconocida, pero se cree que esta entidad está relacionada con la isquemia local causada por factores como la inyección dental, el uso de prótesis, el alcohol, las drogas y el tabaco. Además, las infecciones respiratorias y la bulimia también han sido implicadas como posibles factores predisponentes 6-9.
Clínicamente, típicamente se manifiesta como una úlcera circunscrita con bordes elevados y una sintomatología variable 6. Esta presentación puede imitar diversas entidades malignas que exhiben características clínicas similares, incluyendo el carcinoma escamoso (CE), el carcinoma mucoepidermoide (CME) y enfermedades infecciosas como histoplasmosis, tuberculosis, paracoccidioidomicosis y sífilis 8,10-12.
La biopsia y la evaluación histopatológica son fundamentales para el diagnóstico de esta lesión 13. Dependiendo del tamaño y orientación de la inclusión del tejido biopsiado, el diagnóstico puede ser difícil, y además de las tinciones rutinarias de hematoxilina-eosina (HE), se puede emplear la inmunohistoquímica para que contribuyan al diagnóstico 12,14. Esto es crucial para evitar errores diagnósticos, dado que los diagnósticos diferenciales histopatológicos incluyen CE y CME 12-14.
Una vez diagnosticada, la SMN no requiere un tratamiento específico; sin embargo, se requiere un manejo sintomático y conservador, y las lesiones típicamente sanan espontáneamente en un período de 2 semanas a 3 meses 6,15.
Este trabajo tiene como objetivo informar sobre un caso que involucra el desafiante diagnóstico de SMN y enfatizar la importancia de la evaluación histopatológica e inmunohistoquímica para lograr el diagnóstico correcto y el manejo adecuado del paciente.
Reporte de caso
Un hombre de 45 años con antecedentes de úlcera en el paladar durante 10 días, fue remitido al Servicio de Medicina Bucal del Centro de Especialidades Odontológicas de São Sebastião (São Paulo - Brasil). Durante la anamnesis, negó el uso de tabaco, pero informó un consumo frecuente de alcohol. También mencionó un historial de consumo de cocaína durante 17 años, que cesó hace 7 años, antes de que ocurriera la lesión.
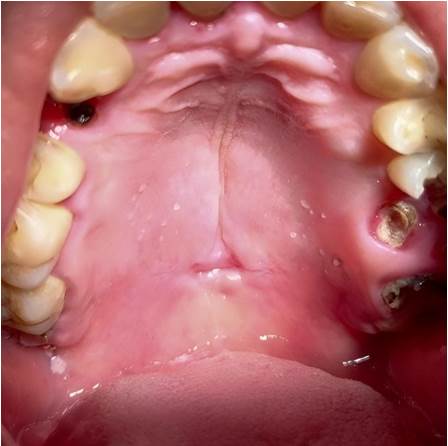
El examen físico extraoral no reveló alteraciones significativas. Intraoralmente, se observó una lesión ulcerada indolora (1,5 x 0,8 cm) con contenido necrótico y bordes ligeramente endurecidos, en la línea media del paladar blando (Figura 1), lo que generó consideraciones iniciales de sífilis y CE.
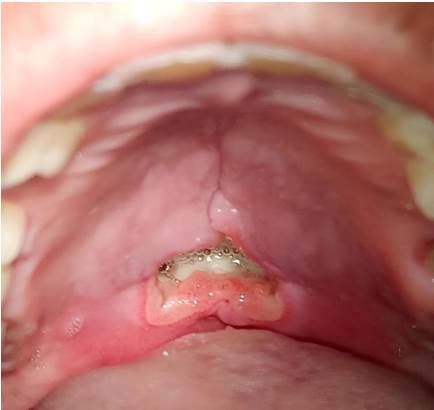
Figura 1 Apariencia clínica inicial. Lesión ulcerada indolora en la línea media del paladar blando, con contenido necrótico y bordes elevados, ligeramente endurecidos y eritroplásicos.
El paciente se sometió a una prueba rápida de sífilis (Syphilis Bio/Bioclin® - Quibasa Química Básica Ltda, Belo Horizonte, MG, Brasil), con resultado negativo. Posteriormente, después de la debridación del tejido necrótico y la irrigación local, se realizó una biopsia incisional.
Las secciones histológicas revelaron un fragmento de mucosa parcialmente revestido por un epitelio escamoso hiperplásico estratificado paraqueratinizado, que mostraba exocitosis, crestas interpapilares en forma de gota y desorganización de la capa basal. Se observaba una extensa área ulcerada cubierta por una membrana fibrinopurulenta, con pequeños nidos de células escamosas. Las células escamosas presentaban citoplasma eosinofílico, nucleolos evidentes y a veces múltiples, ligera atipia celular y varias figuras mitóticas. También se observaron conductos con metaplasia escamosa y acinos compuestos por células mucosas positivas para PAS, sin necrosis. Se identificaron pequeños grupos compuestos tanto por células mucosas como escamosas (Figuras 2 y 3).
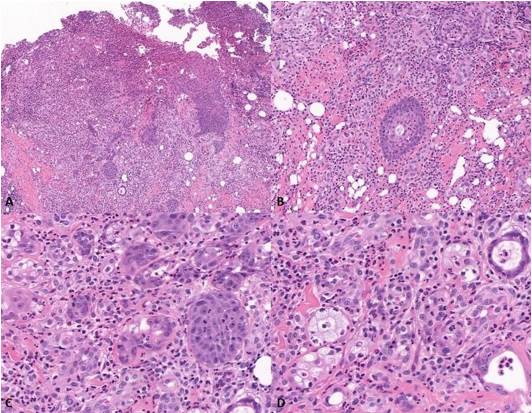
Figura 2 Secciones histológicas (Hematoxilina y eosina). A. Fragmento de mucosa parcialmente revestido por epitelio escamoso hiperplásico estratificado paraqueratinizado y una extensa área ulcerada cubierta por una membrana fibrinopurulenta (ampliación original 5x). B. Conducto con metaplasia escamosa (ampliación original 10x). C y D. Pequeños nidos de células mucosas y células escamosas con citoplasma eosinofílico, hipercromatismo nuclear, nucleolos evidentes y a veces múltiples, atipia celular y varias figuras mitóticas (ampliación original 20x).
Se observó positividad citoplasmática para AE1/AE3 en todas las células parenquimatosas, mientras que solo las células ductales y mucosas exhibieron positividad citoplasmática para CK7 y CK19. El estroma consistía en tejido conectivo fibroso con un intenso infiltrado inflamatorio mixto y numerosos vasos sanguíneos con endotelio engrosado. Debido a las similitudes histológicas entre el CME y el CE con infiltración de glándulas salivales, se llevó a cabo una inmunohistoquímica para calponina y actina de músculo liso, revelando células mioepiteliales rodeando algunas de las islas epiteliales (Figura 3).
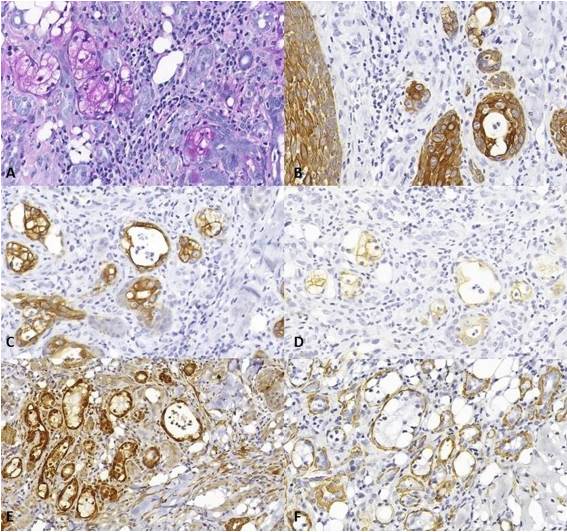
Figura 3 Secciones histológicas (PAS e inmunohistoquímica). A. Acinos compuestos por células mucosas positivas para PAS (ampliación original 20x). B. Positividad para AE1/AE3 observada en todas las células parenquimatosas (ampliación original 20x). C. Células ductales y mucosas exhiben positividad citoplasmática para CK7 (ampliación original 20x). D. Células ductales y mucosas exhiben positividad citoplasmática para CK19 (ampliación original 20x). E. Tinción para calponina en células mioepiteliales que rodean las islas epiteliales (ampliación original 20x). F. Tinción para actina de músculo liso en células mioepiteliales que rodean las islas epiteliales (ampliación original 20x).
Por lo tanto, dado que las características clínicas e histológicas de la lesión fueron indicativas de SMN, el paciente fue sometido a seguimiento clínico semanal, ya que se espera típicamente la resolución de los casos de SMN después de la biopsia incisional. No se observaron cambios clínicos significativos hasta la tercera semana de seguimiento, cuando empezó la remisión de la lesión. El cierre de la herida se logró después de 5 semanas (Figura 4), confirmando el diagnóstico de SMN. Desafortunadamente, después de la resolución de la lesión, el paciente se perdió en el seguimiento.
Discusión
La SMN es un proceso benigno y poco común que involucra tejido de glándula salival 15, observado típicamente en pacientes blancos con una proporción hombre:mujer de aproximadamente 2:1 16. Aunque puede ocurrir en un amplio rango de edad, desde 1.5 hasta 80 años, es más comúnmente reportado en pacientes mayores de 40 años, lo cual coincide con el perfil epidemiológico del paciente descrito aquí 17,18. Medeiros et al. 18, en su revisión de la literatura sobre casos publicados de SMN, revelaron un perfil similar al de nuestro paciente. Observaron que la SMN afecta principalmente a hombres de entre 20 y 68 años, con una predilección por el paladar duro. La lesión puede o no causar dolor, y otros síntomas adicionales pueden incluir fiebre, escalofríos, malestar general o hinchazón 18.
Aunque la etiología de la NSM no se entiende completamente, se cree que está asociada con lesiones fisicoquímicas o biológicas que llevan a una reducción del suministro sanguíneo local, causando el posterior infarto de los acinos de la glándula salival, seguida de inflamación y reparación de los tejidos. Este proceso induce metaplasia ductal y eventual cicatrización. Varias condiciones pueden desencadenar este proceso, incluyendo anestesia local, procedimientos quirúrgicos, uso de prótesis dentales mal ajustadas, consumo de tabaco o cocaína, consumo de alcohol, infecciones del tracto respiratorio superior, radioterapia, intubación, vómitos violentos o inducidos (por ejemplo, en pacientes con bulimia) y enfermedades sistémicas 7-9.
En este caso, el factor asociado principal fue el uso crónico de bebidas alcohólicas, que puede haber contribuido al desarrollo de la SMN. Aunque el paciente mencionó el uso pasado de cocaína, no consideramos que sea un factor causante de la SMN, dado que el paciente dejó de usarla desde hace 7 años.
Clínicamente, la SMN generalmente se manifiesta como úlceras profundas con bordes elevados, pero también se informan masas no ulceradas o hinchazones 1,6,9. Las lesiones palatales suelen ser únicas y unilaterales, ubicadas en el paladar duro posterior o en la unión del paladar duro y blando, con o sin afectar el hueso 13. Estas características clínicas de la SMN comparten similitudes con varias enfermedades infecciosas como histoplasmosis, tuberculosis, paracoccidioidomicosis y sífilis. En consecuencia, estas enfermedades infecciosas deben considerarse como posibles hipótesis diagnósticas 8. En nuestro caso, la hipótesis inicial de sífilis se descartó mediante pruebas serológicas y, bajo la hipótesis de CE, se realizó una biopsia incisional.
Según Anneroth y Hansen 19, la histopatogénesis de la SMN involucra cinco etapas histológicas: infarto, secuestración, ulceración, reparativa y curación. En consecuencia, se observa un espectro de hallazgos histopatológicos, que incluyen ulceración, proliferación vascular, necrosis coagulativa lobular de las glándulas salivales, secuestración de acinos necróticos, hiperplasia pseudoepiteliomatosa del epitelio de cobertura con metaplasia escamosa de los ductos y acinos adyacentes, junto con acumulaciones de mucina 2,3,8,10.
Aunque la SMN es una lesión autolimitada, un punto importante a tener en cuenta es que sus características clínicas y microscópicas son similares a las de las neoplasias malignas, lo que puede llevar a patólogos y cirujanos a diagnósticos y tratamientos incorrectos 4,14. La hiperplasia pseudoepiteliomatosa, la metaplasia escamosa prominente del epitelio de los conductos salivales y la presencia de células mucosas residuales en los lóbulos de las glándulas salivales pueden llevar a un diagnóstico incorrecto como CE o CME 12. Esta identificación errónea puede resultar en tratamientos innecesarios, como cirugía radical, con efectos mutilantes 14. En un estudio retrospectivo de 69 casos de SMN, Brannon et al. (13 informaron diagnósticos erróneos en 8 pacientes que recibieron terapia inapropiada, que varió desde escisión amplía hasta maxilectomía total.
La diferenciación histológica entre la SMN y las lesiones neoplásicas se basa en la preservación de la arquitectura lobulillar de las glándulas, un aspecto citológico de las islas escamosas sin características displásicas y la evidencia de conductos residuales en estas islas 4,10,12. Aunque la diferenciación histológica parece ser directa, en el presente informe encontramos una ligera atipia, con múltiples y evidentes nucléolos, además de varias figuras mitóticas y la ausencia de áreas necróticas, lo que puede dificultar el diagnóstico.
Sin embargo, en casos donde el diagnóstico con tinción de HE no es claro, especialmente en muestras de biopsia pequeñas, la inclusión de un panel de anticuerpos puede proporcionar soporte adicional, aunque puede no ser definitivo 14. Marcadores mioepiteliales, como calponina y actina de músculo liso, pueden resaltar las células mioepiteliales residuales en la periferia de las islas escamosas presentes en la SMN y ausentes en CME y CE 14. Además, se espera positividad para CK7 solo en el epitelio glandular, contribuyendo a la diferenciación de CME y CE 20.
Una vez diagnosticada, la SMN es en su mayoría autolimitante y generalmente requiere tratamiento de apoyo, incluyendo debridamiento de la lesión, control del dolor y antisépticos locales. La cicatrización espontánea suele ocurrir en semanas, como se observó en este reporte de caso 6,10,15. Aunque la SMN rara vez recurre, un seguimiento cuidadoso es esencial. En casos de cicatrización autolimitada tardía, puede ser necesario una reevaluación y una biopsia repetida para descartar otras posibles lesiones 3.
Conclusión
La SMN es una lesión rara que afecta más frecuentemente a las glándulas salivales menores y, aunque sea autolimitante, puede presentar características clínicas e histopatológicas sugestivas de una neoplasia maligna, facilitando un diagnóstico erróneo y tratamientos agresivos. La inmunohistoquímica puede proporcionar soporte adicional para el diagnóstico de SMN, que se trata con debridamiento, control del dolor y antisépticos locales, además la SMN tiende a cicatrizar en unas pocas semanas.











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI