Introducción
La enfermedad por hígado graso no alcohólico (EHGNA) es actualmente considerada la enfermedad hepática crónica más frecuente en el mundo.
Este aumento significativo está en directa relación con la epidemia de sobrepeso-obesidad- diabetes mellitus y síndrome metabólico, en relación inversa con los significativos avances en la detección y tratamiento de otras enfermedades hepáticas como son las hepatitis virales.
Se estima que en un futuro cercano será la primera causa de indicación de trasplante hepático, asimismo dado su alta prevalencia condiciona la viabilidad del órgano donante.
Aunque tradicionalmente se ha considerado a la EHGNA como una enfermedad hepática de pronóstico benigno, en realidad, se trata de una entidad clínica de curso dinámico, que dejada a su libre evolución, puede derivar en situaciones clínicas graves hepáticas y no hepáticas que ensombrecen el pronóstico del paciente.
Está demostrado su rol como factor de riesgo para enfermedad cardiovascular (independiente de otras comorbilidades) siendo esta la principal causa de muerte en estos pacientes. 1
Como enfermedad hepática, engloba un amplio espectro de formas clínicas, desde la esteatosis simple, esteatohepatitis, cirrosis y hepatocarcinoma (aún en hígado no cirrótico).
Ante el impacto a nivel de la salud pública es necesario el desarrollo de herramientas diagnósticas, en lugar de la biopsia hepática, que sean aplicables y reproducibles en la población. De este modo entra en relevancia la utilización de métodos no invasivos.
1 Epidemiología
La EHGNA afecta a personas de cualquier edad, sexo y etnia. Aunque su prevalencia en la población general no se conoce con exactitud, los datos provenientes de estudios poblacionales la estiman en un 20 a 30% para países occidentales y un 15% en países asiáticos. 2,3
En 2016 se publicó un meta-análisis que incluyó 22 países (más de 8 millones de personas) observando una prevalencia de esta enfermedad en la población adulta a nivel global del 25% (IC 95%, 22.10 - 28.65). 4
En Uruguay no existen datos acerca de la prevalencia de la EHGNA, tomando en cuenta la fuerte asociación de comorbilidades y los estudios de prevalencia de obesidad ENSO II, realizados en el año 2009 mostraron que el 54% de la población uruguaya tiene sobrepeso/obesidad y el 25.6% una cintura mayor a 100 cm. La prevalencia de diabetes es del 8%, mientras que la de hipertensión arterial llega al 34%. Extrapolando estos datos nos permiten inferir una prevalencia de esta enfermedad de aproximadamente 600.000 personas (20%). 5
En nuestra experiencia, la prevalencia de EHGNA en los pacientes asistidos durante el período noviembre 2021 - noviembre 2022 en la policlínica de hepatología del Hospital Pasteur, es de 32% constituyendo la patología hepática más prevalente en la actualidad.
2 Definición e Historia natural
La EHGNA es una entidad clínico-patológica que engloba un espectro de lesiones caracterizada por la acumulación de grasa en el hígado, en ausencia de consumo significativo de alcohol (≤ 20-30 g de etanol/día), infección viral o drogas. 6)
En el congreso de Viena 2023 surgen el concepto de MASLD (enfermedad hepática esteatósica asociada a disfunción metabólica) que incluye a todos los pacientes con al menos un elemento de síndrome metabólico y el concepto de MetALD que asocia a los pacientes MASLD con consumo significativo de alcohol. 7
Al hablar de EHGNA se incluye: la esteatosis simple (ES), la esteatohepatitis no alcohólica (EHNA) y finalmente la cirrosis hepática.
La ES consiste en la acumulación de grasa en los hepatocitos fundamentalmente en forma de triglicéridos (esteatosis) de por lo menos un 5% a forma macrovesicular. No existe daño hepatocelular ni fibrosis. Aproximadamente el 10 al 40% de los pacientes con ES progresarán a EHNA en un período de 8 a 13 años.
La EHNA es considerada como la esteatosis asociada a cambios necro-inflamatorios con grados variables de fibrosis. Un 15% de estos pacientes con un estadio de fibrosis ≤ a 2 progresarán a CH en un período de 8 a 13 años, cifra que aumenta hasta el 25% en los pacientes con un estadio de fibrosis ≥ a 3. Estos pacientes tienen una sobrevida más baja que la población general, siendo las causas de muerte más frecuentes la enfermedad cardiovascular y la enfermedad hepática avanzada. 8,9)
3 Etiopatogenia
Los principales factores etiológicos son aquellos que integran el síndrome metabólico que tienen como sustrato la insulino-resistencia (IR). 10) Es por esta razón que para algunos autores la EHGNA es la repercusión hepática del síndrome metabólico. 11)
Aunque clásicamente se la ha considerado una enfermedad de las mujeres de mediana edad, obesas y diabéticas, en recientes publicaciones se ha observado un nuevo perfil de la EHGNA, el diagnóstico se realiza a una edad más temprana, la frecuencia en hombres es mayor (53%) y la mayoría de los pacientes no son diabéticos ni obesos. 9
Estudios poblacionales indican que la prevalencia de EHGNA es mayor en poblaciones hispanas que en las caucásicas y afroamericanas 6, lo que ha llevado a plantear la existencia de mutaciones puntuales (polimorfismos) de determinados genes, que aumentarían el riesgo de EHGNA.
En el 45% de los casos no se identifica ningún factor predisponente conocido para la EHGNA.
Con respecto a la patogenia de la enfermedad, aún hoy en día continúa mal definida. En 1988 Day y cols sugieren un proceso que se origina en dos etapas o impactos, dando origen a la teoría de los dos impactos o “two hits”. 12
El primer impacto consiste en una acumulación excesiva de grasas en el hígado (esteatosis) postulándose como determinante de esto a la insulino-resistencia. Se plantea que el estrés oxidativo correspondería al segundo impacto con la consiguiente activación de citoquinas proinflamatorias y la peroxidación lipídica. 13,14) Recientes publicaciones sugieren que la apoptosis puede tener un rol central y ser una manifestación del segundo impacto 15, existiendo además una correlación positiva entre la apoptosis, la relación de TGO/TGP (transaminasa glutámico oxalacética/ transaminasa glutámico piruvato) y el grado de inflamación y fibrosis. 16
4 Diagnóstico de inflamación y fibrosis hepática
El “gold standard” es la biopsia, siendo esta un método invasivo, costoso y que conlleva riesgos para el paciente. Tras el advenimiento de los métodos de diagnóstico no invasivos de fibrosis hepática, la biopsia está cayendo en desuso, siendo su práctica cada vez menos frecuente.
Dentro de los métodos no invasivos se encuentran aquellos que utilizan fórmulas matemáticas basadas en parámetros clínicos y séricos (scores) y otros basados en técnicas de imagen (ultrasonografía o resonancia magnética) de mayor sensibilidad y especificidad.(17
El principal método imagenológico es la elastografía, la cual puede realizarse por resonancia magnética o ultrasonido. Esta última puede darse por ondas de compresión o por ondas de cizalla y es la técnica de elección en la actualidad. La rapidez, fiabilidad y el gran volumen de tejido hepático analizado son sus principales ventajas, así como la posibilidad de repetirla sin riesgos para el paciente, a los efectos de realizar un control evolutivo de la situación clínica.(18,19)
El estudio informa la rigidez en Kilopascales (KPa), existiendo una correlación entre los mismos y los distintos grados de fibrosis (F0-F4).
La utilidad de estos scores reside en que son fácilmente reproducibles y la obtención de sus parámetros suele ser sencilla. Sin embargo, los parámetros utilizados no son específicos del hígado, encontrándose múltiples variables que influyen en sus valores. Los más utilizados para la EHGNA son el NAFLD score, FIB-4 y APRI. Los mismos son de libre acceso, existiendo calculadoras on line. 20,21
5 Rol de las citoqueratinas
Como se planteaba en la etiopatogenia, actualmente se considera que la apoptosis tiene un rol jerárquico en esta enfermedad. Las células destinadas a morir activan las caspasas que “clivan” las proteínas con residuos de aspartato, siendo uno de sus blancos moleculares la citoqueratina 18 (CK 18) que es la mayor proteína que forma parte de los filamentos intermedios de los hepatocitos. 22)
Los filamentos intermediarios son proteínas que forman parte de una familia muy diversa de elementos fibrilares celulares (CK 1 a CK 20) que constituyen uno de los tres principales grupos de la estructura del citoesqueleto. 23,24
A nivel del hepatocito se expresan CK 8 y CK 18, en los conductos epiteliales de la vía biliar y vesícula biliar CK 7, CK 8, CK 18 y CK 19, en la cápsula de Gleasson encontramos vimentina, CK 8 y CK 14. 25
En los últimos años surgen trabajos con el objetivo de determinar el uso de CK 18 como marcador de apoptosis hepática y su vinculación con la EHGNA.
Uno de los primeros estudios en 2006 incluyó 44 pacientes en los que se realizó biopsia hepática por sospecha de EHGNA, todos estos pacientes presentaban enzimas hepáticas persistentemente elevadas por más de 3 meses con evidencia clínica de síndrome metabólico, en ausencia de otra causa que explique la elevación de las transaminasas. A estos pacientes se les determinó mediante técnica de ELISA la concentración de los fragmentos de CK 18 generados por las caspasas mediante el reconocimiento de su anticuerpo monoclonal, encontrando que la CK 18 es un predictor independiente de EHNA en pacientes con sospecha de EHGNA. 23
En febrero de 2017 se publicó un meta-análisis (incluye 25 estudios) que tiene como propósito evaluar el valor diagnóstico de los biomarcadores del suero CK 18, factor de crecimiento fibroblástico 21 (FGF-21) y el papel combinado de ambos marcadores en el diagnóstico de EHNA. Los resultados sugieren que el aumento de circulación de ambos marcadores se asocia a EHNA y se pueden utilizar para la evaluación inicial. El uso combinado de ambos elementos tiene mayor especificidad y sensibilidad que cada uno por separado. 26
En agosto de 2022 se publica un estudio realizado en Alemania donde se estableció un modelo con ratones modificados genéticamente induciéndolos a la fibrosis hepática. Posteriormente a un grupo de casos se le inhiben los receptores de la CK 18 observando reducción de la fibrosis hepática. De este modo se identifica a la CK 18 y sus vías como diana para desarrollar tratamientos de la fibrosis. 27
El presente trabajo tiene por objetivo general validar el uso de CK 18 en sangre periférica como herramienta diagnóstica y evolutiva en pacientes con EHGNA. Los objetivos específicos son: a) cuantificar y comparar los valores de CK 18 en sangre periférica de pacientes con y sin EHGNA b) valorar la utilidad de la CK 18 en sangre periférica como parámetro evolutivo de los pacientes con EHGNA pre y post-tratamiento.
Metodología
1- Tipo de estudio: Para el objetivo de determinar el valor de CK 18 en pacientes con o sin EHGNA se realizó un estudio caso-control. Para el objetivo de determinar la utilidad del valor de CK 18 en la evolución del paciente con EHGNA pre y post-tratamiento se realizó un estudio prospectivo, analítico. Los casos son pacientes portadores de EHGNA captados en la Policlínica de Hepatología del Hospital Pasteur (Montevideo, Uruguay). Los controles son personas donantes de sangre macheados 1-1 por sexo. Se planteó que el grupo caso fuera de 17 pacientes en virtud de la cantidad de kits de CK 18 que se adquirieron.
2 - Período del estudio: El período de captación de los pacientes fue de 12 meses (06/2019 a 06/2020) y el período de seguimiento fue de 12 meses para cada paciente desde el momento de captación.
3 - Criterios de inclusión: Paciente de ambos sexos, mayores de 18 años, portadores de EHGNA en sus tres variantes clínicas (esteatosis simple, esteatohepatitis y cirrosis).
4- Criterios de exclusión: Sin criterio imagenológico compatible con EHGNA, presencia de otra enfermedad hepática concomitante, neoplasia activa extrahepatica o hepática (*), proceso infeccioso generalizado y/o hepático (colecistits, colangitis, absceso) en curso (*), no dar el consentimiento escrito para el ingreso al estudio. Aquellos pacientes que ingresados al estudio no concurran al 75% de los controles clínicos serán retirados del estudio.
(*) A efectos de evitar falsos positivos, ya que la CK 18 se eleva en situaciones de sepsis y enfermedad neoplásica como carcinoma de pulmón, hígado, próstata y colon.
5- Procedimiento: Se diseñó un formulario a efectos de la recolección de los siguientes datos:
a) Datos patronímicos. Antecedentes personales de consumo de alcohol, consumo de fármacos y/o hierbas en los últimos 3 meses, hipertensión arterial, diabetes mellitus, dislipemia, patología tiroidea. Antecedentes familiares y/o personales de enfermedad celíaca, colagenopatías, vitíligo. Síntomas de la esfera hepato-biliar. Tratamiento habitual.
b) Examen físico: datos antropométricos de peso y talla. Se calculó el IMC. Perímetro abdominal. Medición de presión arterial. Examen general se buscó la presencia de elementos de insuficiencia hepática y/o hipertensión portal, elementos de hiperinsulinismo clínico (acantosis nigricans). Examen abdominal (hepatomegalia, dolor hipocondrio derecho).
c) Ecografía de abdomen: para diagnóstico de esteatosis hepática y presencia de lesiones nodulares.
d) Analítica sanguínea de valoración general y hepática: a todos los pacientes se les realizó: hemograma, azoemia, creatininemia, glicemia, funcional y enzimograma hepático, crasis sanguínea, perfil lipídico.
e) Analítica screening de patología tumoral: a todos los pacientes se les solicitó PSI (tres determinaciones). A los hombres PSA.
f) Analítica sanguínea para descartar otras causas de daño hepático: a todos los pacientes se les realizó proteinograma electroforético, determinación de inmunoglobulina G y M, serología para VIH y VDRL, serología para hepatitis A, B y C, TSH, metabolismo del hierro (ferritina e índice de saturación de transferrina), en los pacientes con sospecha de enfermedad autoinmune hepática y/o sistémica se solicitó auto-anticuerpos ANA, ASMA, LKM1, AMA. En los pacientes con enfermedad hepática sin causa aclarada se solicitó cupremia.
g) Determinación de CK 18. La sangre extraída a los pacientes al inicio del estudio y al finalizar los 12 meses de control por paciente, fue procesada en el Laboratorio de Genética Humana, Departamento de Biodiversidad y Genética del IIBCE. A partir de la muestras de sangre de los pacientes se separó el suero y del resto se realizó la extracción de ADN que fue almacenado a 4ºC y el suero a - 80 °C en freezer. La cuantificación de CK 18 se realizó mediante un Kit comercial (RayBio® Human Cytokeratin 18 ELISA KIT) siguiendo las recomendaciones del fabricante. En el grupo control se realizó una única determinación de CK-18. En el grupo caso se realizaron 4 determinaciones de CK-18 al inicio del protocolo y al final del mismo. El valor promedio de dichas determinaciones es lo que se consideró para el estudio.
h) Elastografía de transición (Fibroscan ®). Fue realizada por el mismo técnico a todos los pacientes al momento del ingreso al estudio.
i) Cálculo de los scores FIB-4 y APRI al momento del ingreso al estudio.
j) Tratamiento. Se realizó tratamiento específico de acuerdo a las características biométricas del paciente y sus factores de riesgo. En cada control mensual se verificaba la presencia de síntomas, control de peso y se valoró adherencia al tratamiento.
6- Definiciones
Se consideraron las siguientes
EHGNA: pacientes con ecografía abdominal (u otro estudio imagenológico) que confirme la presencia de esteatosis hepática y que no presente otra causa posible de afección hepática aguda y/o crónica.
Cirrosis hepática: presencia de elementos clínicos y/o paraclínicos de insuficiencia hepatocítica crónica y de hipertensión portal. La insuficiencia hepatocítica se manifiesta clínicamente por la presencia de síndrome de hiperestrogenismo, síndrome hemorragíparo, pudiendo asociar o no, síndrome pigmentario y síndrome ascítico-edematoso. Las alteraciones paraclínicas son: tasa de protrombina ≤ 70%, INR > 1.2 y albúmina ≤ 3 g/l, en ausencia de otras enfermedades que lo expliquen. La hipertensión portal se evidencia por la presencia de alguno de los siguientes hallazgos: várices esófago-gástricas, gastropatía por hipertensión portal, esplenomegalia, circulación colateral por cortocircuitos portosistémicos y/o por la presencia de ascitis.
Consumo de alcohol: se considera significativo un consumo ≥ 20 g al día en mujeres o de 40 g/día en hombres. Para calcular la cantidad de gramos de alcohol que tiene una bebida hay que multiplicar los ml de alcohol por 0.8 (densidad del alcohol: 0.8 gramos por ml). La gradación alcohólica indica la cantidad de alcohol (en ml) que tiene cada bebida.
Obesidad: lo definimos como un índice de masa corporal (IMC) > 30 kg/m2. Se calcula sobre la fórmula del peso en kilogramos dividido (talla)2 en metros.
Enfermedad autoinmune hepática: se aplicará el score de hepatitis autoinmune con puntaje probable y/o posible. Se considerará cirrosis biliar primaria la presencia de patrón colestásico con AMA positivos y/o biopsia hepática compatible.
FIB-4 score incluye la edad, determinación de transaminasas y plaquetas. Los puntos de corte son < 1,30 (F0-F1) y > 2.67 (F3-F4), los valores intermedios son indeterminados (F2).
APRI score incluye la relación de transaminasas y el valor plaquetario. Los puntos de corte son < 0.5 (F0-F1) y > 1.5 (F3-F4), los valores intermedios son indeterminados (F2).
7- Análisis estadístico:
Las variables continuas se expresaron con su tendencia central y medidas de dispersión. Las variables cuantitativas se expresaron por su frecuencia y porcentaje en las muestras totales. Para el análisis univariado se utilizó las pruebas de t Student. En todos los casos se consideró como significativo un error α < 5%.
8 - Ética:
Se contó con el consentimiento de todos los pacientes que ingresaron al estudio.
El trabajo fue aprobado por el comité de ética en la investigación del Hospital Pasteur.
Resultados
Análisis global de la población
Grupo caso
De los 17 pacientes captados, 4 fueron excluidos por no completar los controles solicitados, por lo que la población de análisis fueron 13 pacientes.
En la tabla 1 se presentan las principales características epidemiológicas de la misma.
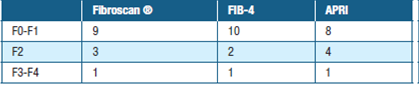
En la tabla 2 se presentan los resultados del estudio de elastografía de transición (fibroscan ®) y el cálculo de los scores realizados (FIB-4, APRI) vinculados con el grado de fibrosis hepática que cada uno estima (F0 - F4). F0 - F1 sin fibrosis significativa, F3-F4 con fibrosis significativa, F2 dudoso (se sugiere completar con otros métodos).
Grupo control
Estuvo integrado por 13 personas donantes de sangre, 12 mujeres y 1 hombre pareados por edad y sexo con el grupo caso. Edad media 43,4 ± 7.66 años.
En la tabla 3 y gráfica 1 se presentan los resultados globales del valor promedio de CK 18 para el grupo control y el grupo caso al inicio (pre-tratamiento) y final del proyecto luego de 12 meses de control y tratamiento (post-tratamiento)
Tabla 3: Valores promedios de CK 18 grupo control y grupo caso (pre y post - tratamiento) Abreviatura. CK 18: citoqueratina 18

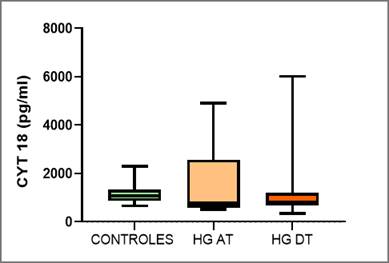
Gráfica 1: Resultados de CK 18 en el grupo controles y en el grupo caso pre tratamiento (HG AT) y pos tratamiento (HG DT). Abreviatura. CK 18: Citoqueratina 18
Se encontró una diferencia estadísticamente significativa entre ambos grupos (grupo caso vs grupo control) al inicio del proyecto (pre-tratamiento) con una p < 0.005.
Se encontró una diferencia estadísticamente significativa en el grupo caso entre el inicio y el final del proyecto (tras 12 meses de tratamiento) con una p < 0.001.
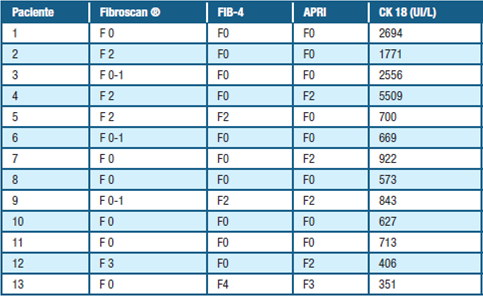
En la tabla 4 se presentan los resultados por paciente del fibroscan ®, scores realizados y valor promedio de la CK 18 pre-tratamiento.
Análisis según IMC
En el grupo caso 9/13 pacientes tenían un IMC mayor a 30 kg/m2, con un valor medio de CK 18 de 1506,4 ± 166 UI/l al inicio del proyecto y un valor medio de CK 18 de 120,6 ± 60 UI/l al finalizar el proyecto (luego de 12 meses de tratamiento).
Esta diferencia tuvo significación estadística con una p < 0.005 tanto para pre-tratamiento como para el post-tratamiento. En la gráfica 2 se presentan los resultados.
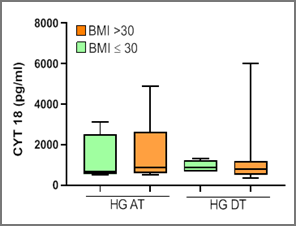
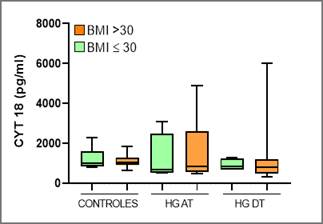
Gráfico 2: Determinaciones de CK 18 en el grupo caso pre -tratamiento (HG AT) y post-tratamiento (HG DT) para pacientes con IMC mayor o menor a 30 kg/m2
En el grupo control 7/13 personas tenían un IMC mayor a 30 kg/m2, con un valor medio de CK 18 de 207,4 ± 160 UI/l.
Se encontró una diferencia estadísticamente significativa entre ambos grupos tanto al inicio del proyecto (pre-tratamiento) como al final del mismo (post - tratamiento) con una p < 0.001 y p < 0.005 respectivamente
En la gráfica 3 se presentan los resultados de CK 18 del grupo control y caso (pre y post-tratamiento) para quienes presentan un IMC mayor a 30 kg/m2
Análisis según edad
En el grupo caso 7/13 pacientes tenían más de 50 años, con un valor medio de CK 18 de 1107 ± 82 UI/l al inicio del proyecto y un valor medio de CK 18 de 110 ± 37 UI/l al finalizar el proyecto (luego de 12 meses de tratamiento).
Se encontró una diferencia estadísticamente significativa, con p < 0.005 tanto pre-tratamiento como post-tratamiento. En la gráfica 4 se presentan los resultados.
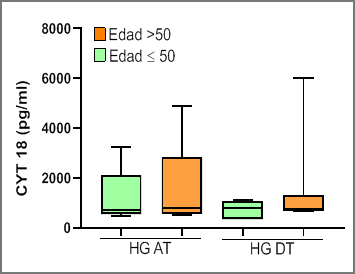
Gráfica 4: Resultados de CK 18 pre-inicio de tratamiento (HG AT) y post-tratamiento (HG DT) para el grupo de pacientes con EHGNA mayores o menores de 50 años.
En el grupo control 3/13 personas tenían más de 50 años, con un valor medio de CK 18 de 164 ± 105 UI/l.
Se encontró una diferencia estadísticamente significativa entre ambos grupos tanto al inicio del proyecto (pre-tratamiento) como al final del mismo (post - tratamiento) con una p < 0.005 y p < 0.05 respectivamente.
Discusión
Al igual que otros estudios poblacionales, en nuestro trabajo encontramos que predomina la población femenina, con una edad media de 54,4 años y con alta prevalencia de factores de riesgo metabólicos.
La obesidad definida como un IMC > 30 kg/m2 estaba presente en 9/13 pacientes (FR 0.69), la media poblacional del IMC fue de 33,59 ± 6,93 Kg/m2 y del perímetro abdominal de 110.30 ± 10,34 cm.
7/13 pacientes (FR 0.53) tenían diagnóstico de diabetes mellitus tipo 2, 8/13 (FR 0.61) eran hipertensos y la totalidad de ellos tenían diagnóstico de dislipemia.
Por tanto nuestra población pertenece al “grupo tradicional” de pacientes con EHGNA con alta prevalencia de elementos de síndrome metabólico, siendo posible plantear la insulino-resistencia como causa patogénica, destacamos que solo 2/13 pacientes tenían elementos clínicos sugestivos de hiperinsulinismo lo que pone de manifiesto que el hallazgo de los mismos tienen un bajo impacto clínico en el diagnóstico.(28
En cuanto a la forma clínica de la enfermedad, ningún paciente tenía síntomas y/o signos sugestivos de afección de la esfera hepatobiliar, lo que traduce la necesidad de la búsqueda de esta afección por métodos paraclínicos. Se recomienda la realización de ecografía de abdomen en todo paciente con síndrome metabólico a efectos de confirmar el diagnóstico de EHGNA, visto las implicancias que el mismo tiene en el pronóstico del paciente.
En cuanto al estadio de la enfermedad, si miramos globalmente los métodos no invasivos realizados en el estudio (tabla 3), encontramos que solo un paciente tenía un F3-F4 sugiriendo un grado de fibrosis significativa, mientras que la mayoría se encontraba en un F0-F1 (sin fibrosis significativa), estos hallazgos son similares a otros estudios poblacionales donde el cúmulo mayor de la población se encuentra en estadios iniciales (esteatosis simple).
Sin embargo cuando se analizan los resultados por paciente individual (tabla 4), se constata que los hallazgos no son uniformes por método no invasivo aplicado. El paciente con F3-F4 por los scores, tiene un F0 en la elastografía. Hay que destacar que los puntos de corte de KPa del fibroscan ® para la EHGNA aún están en revisión lo que podría explicar esta discordancia.
En cuanto al análisis de la CK 18 encontramos que los pacientes con EHGNA tienen un valor más elevado que la población normal (hallazgo estadístico significativo), lo que permite validar el uso de la misma en esta enfermedad, tal cual está siendo evidenciado por trabajos internacionales. 29
Asimismo se objetiva el descenso del valor de CK 18 en el grupo de pacientes con EHGNA tras un año de tratamiento, que incluso pasa a ser de menor valor que para el grupo control (población sana), por lo que puede considerarse de utilidad la determinación de la CK 18 para en control de los pacientes con EHGNA, valorando la respuesta al tratamiento (hallazgo estadístico muy significativo).
Es por tanto fundamental diagnosticar a los pacientes con EHGNA e iniciar un tratamiento individualizado, multidisciplinario enfocado en el control de los factores de riesgo metabólicos, teniendo como pilar del mismo el descenso de peso gradual y sostenido a través de cambios de hábitos nutricionales y la actividad física - ambos con nivel de evidencia IA. 30,31
La población de pacientes obesos tiene 65% más riesgo de EHGNA, que pasa a ser del 90% en el grupo de pacientes con obesidad mórbida.30 En este trabajo buscamos la relación de CK 18 en el grupo de pacientes con IMC mayor a 30 kg/m2, encontrado que la misma tiene valores estadísticamente significativa superior a la población de pacientes con EHGNA de menor IMC, y que ambos grupos presentaban un descenso significativo de los valores de CK 18 tras el año de tratamiento cuando se lo compara con el grupo control.
Se conoce que la incidencia de EHGNA tiene un incremento con la edad. Analizamos los pacientes mayores de 50 años, encontrando que esta población tiene un valor de CK 18 significativamente superior a los pacientes de menor edad, objetivándose un descenso de los mismos tras el año de tratamiento.
Presentamos los resultados de la media poblacional de CK 18 al inicio del proyecto por paciente (tabla 4), no siendo posible establecer conclusiones sobre los mismos, consideramos que esto sucede porque se trata de una muestra pequeña de pacientes y que metodológicamente no estaba enfocado para este análisis.
Si bien nuestro trabajo tiene un número muy reducido de pacientes, consideramos que es el primer trabajo nacional sobre el tema, que tiene la potencia de ser un trabajo caso-control y que pone sobre la mesa a la citoqueratina 18, presentándolo como un nuevo marcador serológico no invasivo en el diagnóstico y control evolutivo de los pacientes con EHGNA.
Conclusiones
Se encontraron valores elevados de CK 18 en pacientes con EGHNA en relación a la población control. Esta tendencia se mantiene en pacientes > 50 años o con IMC > 30 kg/m2.
CK18 plasmática disminuye en pacientes con EGHNA al año de tratamiento con significación estadística, tanto en la población general como en > 50 años y pacientes con IMC > 30 kg/m2.
CK18 plasmática puede ser útil como marcador inflamatorio en pacientes con EGHNA.
Es necesario continuar la línea de investigación, comparándolo con otros marcadores diagnósticos y buscar el punto de corte de CK 18 a correlacionar con los distintos estadios de la enfermedad.