El Virus del Papiloma Humano, es un miembro de la familia Papillomaviridae, agente causal del Cáncer de Cuello Uterino (CCU) y de un alto porcentaje de cánceres de otras localizaciones (63,3% en cáncer de pene, 68,8% en cáncer de vulva, 75% en cáncer de vagina, 91,1% en cáncer de ano, 70,1% en cáncer de orofaringe)1. El VPH ejerce su acción oncogénica a través de sus proteínas E6 y E7 que se unen a las proteínas celulares p53 y Rb, respectivamente, desregulando el crecimiento celular, inhibiendo la apoptosis y fomentando la transformación celular2.
El análisis de los genotipos de VPH presentes en CCU ha permitido definir grupos de alto y bajo riesgo oncogénico para humanos. Grupo 1, genotipos carcinogénicos: VPH16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59; Grupo 2A, genotipos probablemente carcinogénicos: VPH 68; Grupo 2B posiblemente carcinogénicos: VPH26, 53, 66, 67, 70, 73, 82; Grupo 3, no clasificables como oncogénicos: VPH 6 y 113.
Las infecciones por genotipos carcinogénicos siguen un curso predominantemente silente, pueden establecer infecciones persistentes y con frecuencia generan alteraciones citológicas características englobadas mayoritariamente en el grupo de las neoplasias cervicales NIC1 (neoplasia intraepitelial cervical grado 12. En una proporción menor las infecciones de VPH de alto riesgo pueden progresar a lesiones escamosas intraepiteliales de alto grado NIC2 o NIC3, (Neoplasia intraepitelial cervical grado 2 o 3, respectivamente) o CCU. Un 30% de las lesiones NIC3 progresarán a CCU si no son tratadas4. En nuestro país, el análisis de ciento setenta y seis cánceres invasores detectó la presencia de VPH en el 92,6% (163 casos) correspondiendo a los genotipos 16 (67,6%), 18 (8,5%), 45 (6,8%), 33 (3,4%) y una menor proporción de los genotipos 31, 35, 39, 51, 52, 58, 66 y 735, similar a lo que se encuentra en otras partes del mundo6. En un metaanálisis reciente que compiló los datos de 1.406.328 mujeres, determinó que el genotipo 16 es el que presenta mayor riesgo de NIC3+, seguido de un nivel de riesgo un poco menor para los genotipos 31, 18, 33 y 58. Los genotipos 31 y 33 presentaron un riesgo igual o algo superior que el genotipo 18 en períodos de 6 a 14 años de seguimiento. Los genotipos 35, 51, 56, 59, 66 y 68 presentaron los menores riesgos, dentro del grupo de VPH de alto riesgo7.
El CCU es la cuarta neoplasia más frecuente para las mujeres uruguayas con una incidencia de 313 casos anuales. Aproximadamente 134 mujeres promedio al año mueren por esta causa prevenible en nuestro país. La incidencia de CCU en Uruguay durante el período 2002-2019 ha mostrado una tendencia descendente en las tasas ajustadas con un porcentaje de cambio anual estimado de 1,738.
Se acepta internacionalmente que más de la mitad de las mujeres y hombres sexualmente activos son infectados por el VPH en algún momento de sus vidas. Aproximadamente el 70% de las mujeres resuelven la infección por VPH en un año y hasta el 91% a los dos años9. Las infecciones por VPH 16 tienden a persistir más tiempo, pero en su mayoría son indetectables a los 2 años10. El desarrollo gradual de una respuesta inmunitaria eficaz es el mecanismo más probable para el control de la infección por VPH y las mujeres inmunocomprometidas son las de mayor riesgo para el desarrollo de CCU a plazos menores11.
El VPH ingresa al epitelio mediante microlesiones e infecta las células poco diferenciadas de las capas basales del epitelio, uniéndose a su receptor de membrana, la molécula a6-Integrina. El virus se establece dentro del núcleo de las células basales y el ADN genómico viral permanece en estado episomal (circular) fuera de los cromosomas del hospedero, replicándose a niveles muy bajos en coordinación con la división celular12. El ADN viral puede integrarse al ADN humano lo cual hace más eficiente su poder oncogénico. En las lesiones invasoras, el ADN viral está frecuentemente integrado en los cromosomas de células neoplásicas. Excepcionalmente, la integración puede ocurrir en la vecindad de oncogenes conocidos, lo que puede derivar en una rápida activación del proceso oncogénico. Cuando las células infectadas se diferencian y migran desde la capa basal hacia el estrato espinoso del epitelio, se estimula la replicación viral y se acumulan viriones dentro del núcleo. Estos virus no presentan una fase lítica, por lo que su progenie es liberada cuando las células terminales del estrato córneo sufren su proceso natural de descamación, lo cual hace indispensable obtener células para su detección13.
La detección del CCU y sus lesiones precursoras se realiza tradicionalmente mediante el test de Papanicolaou (PAP), técnica citológica publicada en el año 1942 que detecta células transformadas precancerosas o cancerosas14. La aplicación del test de Papanicolaou logró salvar muchas vidas y fue muy importante para la detección del CCU, pero su sensibilidad es del 30-87% y su especificidad es del 86 al 100%15. El advenimiento de técnicas moleculares para la detección de muy pequeñas cantidades de ácidos nucleicos y el establecimiento del VPH como agente causal de CCU en el año 198316 derivó en el desarrollo de pruebas moleculares para la detección de VPH.
La primera generación de test de VPH se basaba en la detección del virus con o sin una cuantificación relativa de la señal detectada17. Cuando se observó que algunos genotipos como el VPH16 y VPH18 se asocian en mayor medida a la transformación a CCU18 los nuevos test de VPH de segunda generación fueron diseñados para distinguir estos genotipos del resto de los genotipos de alto riesgo. A partir del año 2014, diferentes estudios han probado la superioridad de métodos moleculares para la detección de CCU19. En nuestro país el Proyecto ESTAMPA ha encontrado resultados similares20. El Test de VPH como tamizaje primario de CCU y sus lesiones precursoras es más sensible que la citología21 permitiendo mayores intervalos de tiempo entre los controles, eliminando los elementos subjetivos del diagnóstico, reduciendo el impacto de los hallazgos de significado incierto (ASCUS, del inglés Atypical Squamous Cells of Undetermined Significance)19, incrementando la detección de adenocarcinomas19 y permitiendo la autotoma22.
El mayor problema de los test de VPH es que la mayoría de las infecciones detectadas nunca desarrollarán CCU. Esto lleva a la necesidad de un test de triaje que identifique las mujeres con mayor riesgo de desarrollar un CCU de entre las positivas para VPH. Existen varios test de triaje posibles: test de Papanicolaou, test de Papanicolaou leído con conocimiento del resultado del test de VPH, tipificación parcial de VPH y otros con menor eficiencia o no disponibles en el país (análisis de metilación, detección de proteína E6, tinción dual).
La mejor estrategia entonces es que sean derivadas a colposcopía aquellas mujeres en riesgo de presentar lesiones NIC3+23, mientras que las mujeres sin lesiones eviten los procedimientos invasivos innecesarios. Por este motivo, aquel test de triaje que detecte más eficientemente las lesiones NIC2+ será el que aporte mejores resultados al algoritmo.
La utilización de la citología convencional como método de triaje de los VPH positivos es una de las estrategias posibles. En teoría, la eliminación de las muestras VPH negativas para el test de PAP mejoraría su performance para la detección de CCU o sus lesiones precursoras pero esto no se ha demostrado consistentemente. Dada la baja sensibilidad del método se han sugerido repetir la citología a los 6 meses o 12 meses, dependiendo del algoritmo para evitar perder lesiones NIC3+24.
La tipificación parcial, detectando los genotipos 16 y 18 separadamente de los otros genotipos de alto riesgo ha demostrado ser efectiva como método de triaje por su asociación con CCU y sus lesiones precursoras12 y es uno de los métodos recomendados actualmente.
En una publicación reciente se analizaron 11 algoritmos diferentes que incluyeron detección de VPH de alto riesgo, tipificación parcial de VPH, citología con tinción doble y test de Papanicolaou. Los mayores niveles de sensibilidad se obtienen con la tipificación parcial de VPH como método de tamizaje inicial mientras que la especificidad es máxima con citología de doble tinción, técnica que se está poniendo en práctica en el país. Basándonos en los estudios internacionales sobre los posibles métodos de triaje y de acuerdo a nuestra infraestructura y posibilidades se eligieron la tipificación parcial de VPH y la citología para ser analizadas como métodos de triaje en este trabajo.
Materiales y métodos
El estudio es retrospectivo, observacional. Para el análisis de los test de triaje propuestos, se analizaron los resultados de test de VPH, test de Papanicolaou, colposcopias y estudios anatomopatológicos de las mujeres participantes del Proyecto ESTAMPA-Uruguay. Adicionalmente se realizó la tipificación de VPH para poder simular la tipificación parcial (ver Tipificación de VPH en esta Sección). El Proyecto ESTAMPA (Estudio multicéntrico de tamizaje y triaje de cáncer de cuello uterino con pruebas del Virus de Papiloma Humano)25 es financiado por la Agencia Internacional de Investigación sobre Cáncer (IARC, del inglés International Agency for Research on Cáncer) y es un estudio que evalúa diferentes métodos para la clasificación de las mujeres VPH positivas con el fin de recomendar abordajes de tamizaje en diferentes escenarios25. El Proyecto ESTAMPA se desarrolla en Uruguay desde Diciembre de 2014 y las mujeres participantes se beneficiaron del test de VPH y el test de Papanicolaou simultáneos y se derivaron a colposcopia las pacientes positivas para alguno o ambos tests. El reclutamiento de realizó entre Diciembre de 2014 y Julio de 2019 en el Centro de Salud de la Costa, el Centro de Salud de Pando de la Red de Atención Primaria (RAP-ASSE) y el Hospital Policial.
Se consideraron 1.984 mujeres Uruguayas de entre 30 y 64 años, asintomáticas, no histerectomizadas, no embarazadas y sin antecedentes de enfermedades neoplásicas del aparato genital, que participaron voluntariamente en el Proyecto ESTAMPA-Uruguay.
Recolección de muestras
Las mujeres fueron invitadas a participar del estudio piloto durante un control de rutina, se les informó de los objetivos y alcance del proyecto y se les solicitó la firma del consentimiento. En esa visita se le realizó una toma de células cervicales para Test de Papanicolaou con Papette Wallach SurgicalDevice®, se realizó un extendido sobre lámina de vidrio y se fijó con una mezcla de alcohol y laca en aerosol. Luego el cepillo fue agitado en un vial de transporte PreservCyt para desprender las células obtenidas para realizar un test de VPH y tipificación viral.
Test de Papanicolaou
Los test de Papanicolaou se realizaron en dos laboratorios de citología. Las primeras 1.000 muestras se procesaron en el laboratorio de citología de la Red Integrada de Efectores Públicos de Salud (RIEPS) de la RAP, a los que se derivan rutinariamente y las restantes muestras se procesaron en el Laboratorio de Citología del Hospital Policial. Para la lectura de la lámina de Papanicolaou no se conocía si la paciente presentaba VPH, si bien en los algoritmos analizados la citología se ubica posteriormente al test de VPH. Las muestras estaban identificadas como del proyecto ESTAMPA. Se utilizó la clasificación Bethesda para los resultados de la citología considerándose anormal desde ASC-US26.
Test de VPH – Captura de Híbridos 2 (HC2)
El test de VPH y tipificación viral se realizó en el Laboratorio de Biología Molecular del Departamento de Patología Clínica del Centro Hospitalario Pereira Rossell. Para la detección del genoma viral se utilizó la Captura de Híbridos 2 (HC2). El fundamento de la técnica es lisar las estructuras celulares para liberar los ácidos nucleicos y formar híbridos entre el ADN de VPH y sondas RNA para 13 genotipos de alto riesgo. Los híbridos son fijados a una superficie por un anticuerpo anti-híbridos RNA: DNA. La detección de los híbridos se realiza mediante la unión de varios anticuerpos conjugados con fosfatasa alcalina que genera una reacción quimioluminiscente y amplifica la señal. La medida se realiza en unidades de medida de luz (RLU, del inglés Relative Light Unit) y se determina una medida de Cut-off que separa los resultados negativos (RLU <1) de los positivos (RLU ≥1).
Tipificación de VPH
Las muestras de células cervicales positivas para VPH por Captura de Híbridos 2, almacenadas, se tipificaron para 24 genotipos de VPH por PapilloCheck®. Se extrajeron los ácidos nucleicos mediante el kit O-check (Greiner, Alemania). Se realizó la detección de VPH y tipificación de los casos positivos mediante el kit diagnóstico PapilloCheck® usado para la detección y genotipificación de un fragmento del gen E1 de VPH. Esto permitió detectar 24 genotipos de Papilomavirus en las muestras analizadas: 18 genotipos de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 70, 73 y 82) y 6 genotipos de bajo riesgo (6, 11, 40, 42, 43, 44/55). En la misma reacción, un fragmento del gen humano ADAT1 (RNAt específico para adenosina deaminasa) se amplificó para monitorear la presencia de muestra humana en el espécimen cervical (control de muestra) y un control interno presente en Papillocheck PCR MasterMix se amplificó para monitorear el rendimiento de la PCR (control de PCR). Los productos de PCR son luego hibridados con sondas específicas de ADN sobre chips que son escaneados, analizados y evaluados usando un Check scanner y el software Check report.
Derivación a colposcopía
Según el diseño del proyecto ESTAMPA sobre el cual se realiza este análisis, todas las usuarias cuyo resultado de VPH fue positivo por captura híbrida o citología anormal (ASCUS+) en el momento del tamizaje, fueron derivadas a colposcopia en su centro de salud correspondiente. Cuando fue necesario por el hallazgo colposcópico se realizaron biopsias y/o legrados endocervicales para estudio histológico y confirmación del diagnóstico. Esto permitió obtener resultados de anatomía patológica para casos con resultado negativo en VPH o en citología.
Estudio histológico
Las biopsias y legrados endocervicales se procesaron en el Laboratorio de Anatomía Patológica del Hospital de la Mujer del Centro Hospitalario Pereira Rossell y se realizó inmunohistoquímica manual P16 para las H-SIL (NIC2+) con clonas JC2 y BC42, de acuerdo al Sistema LAST (Lower Anogenital Squamous Terminology Standarization).
Diseño de la simulación de los algoritmos diagnósticos
Con los datos disponibles, se analizaron dos posibles algoritmos que diferían en el test de triaje, con el fin de pronosticar cómo hubieran sido clasificadas y/o estudiadas las pacientes si estos algoritmos se hubieran aplicado en la vida real. Si bien en los algoritmos los test de HPV y test de Papanicolaou aparecen secuencialmente, durante el proyecto ESTAMPA se realizaron al mismo tiempo. Esto significa que la citología no se realizó conociendo el resultado de VPH. Ambos algoritmos se identificaron como A (triaje con tipificación de VPH, figura 1) y B (triaje con test de Papanicolaou, figura 2). Esto permitió evaluar la sensibilidad y especificidad en la detección de enfermedad, así como el valor predictivo positivo (VPP), el valor predictivo negativo (VPN) y la derivación a colposcopia de cada propuesta de triaje.
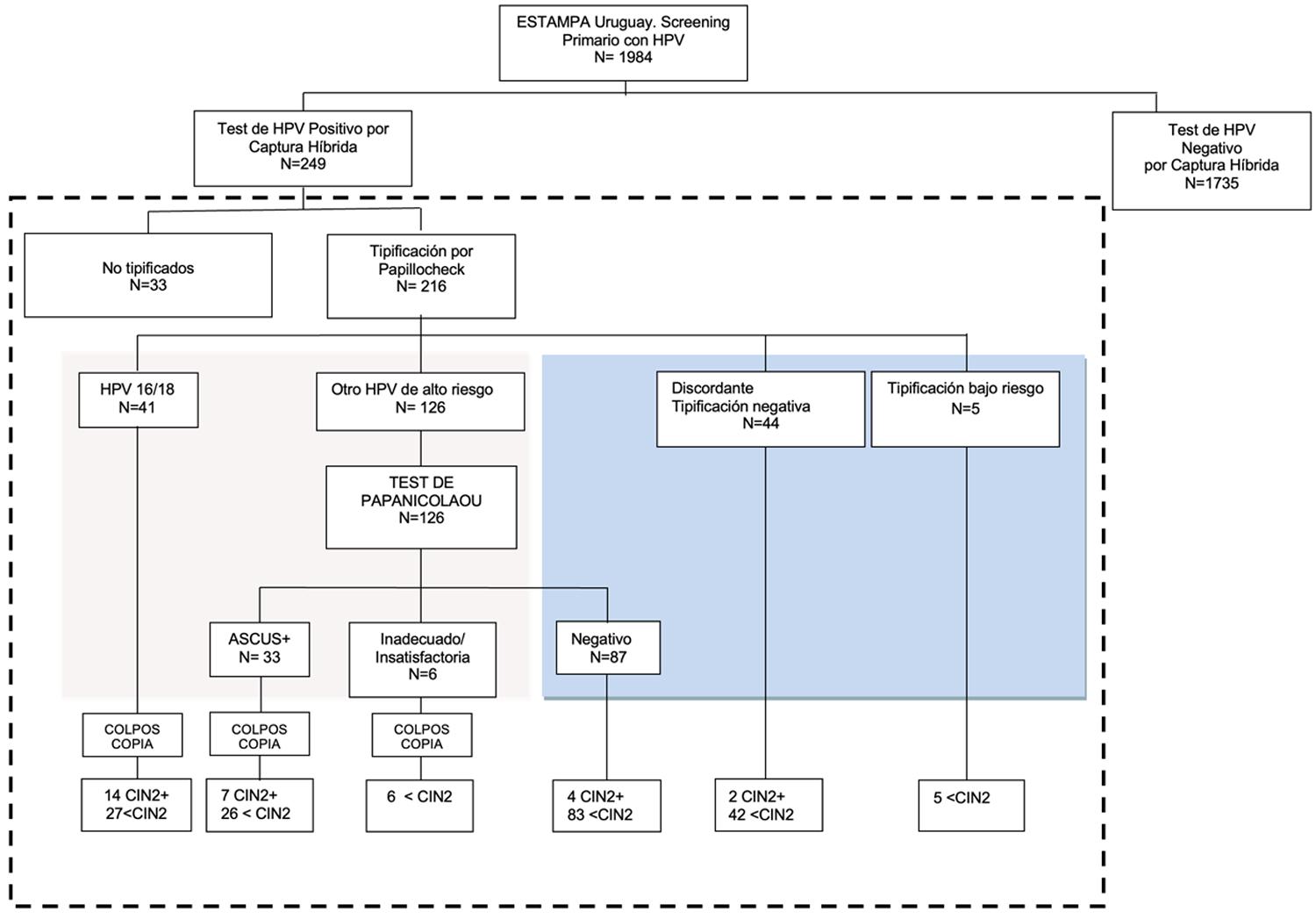
Figura 1. Simulación de algoritmo A con los datos del Proyecto Estampa-Uruguay. Se evalúa el tamizaje con test de VPH seguido de tipificación y posteriormente citología para los genotipos de alto riesgo no 16/18.
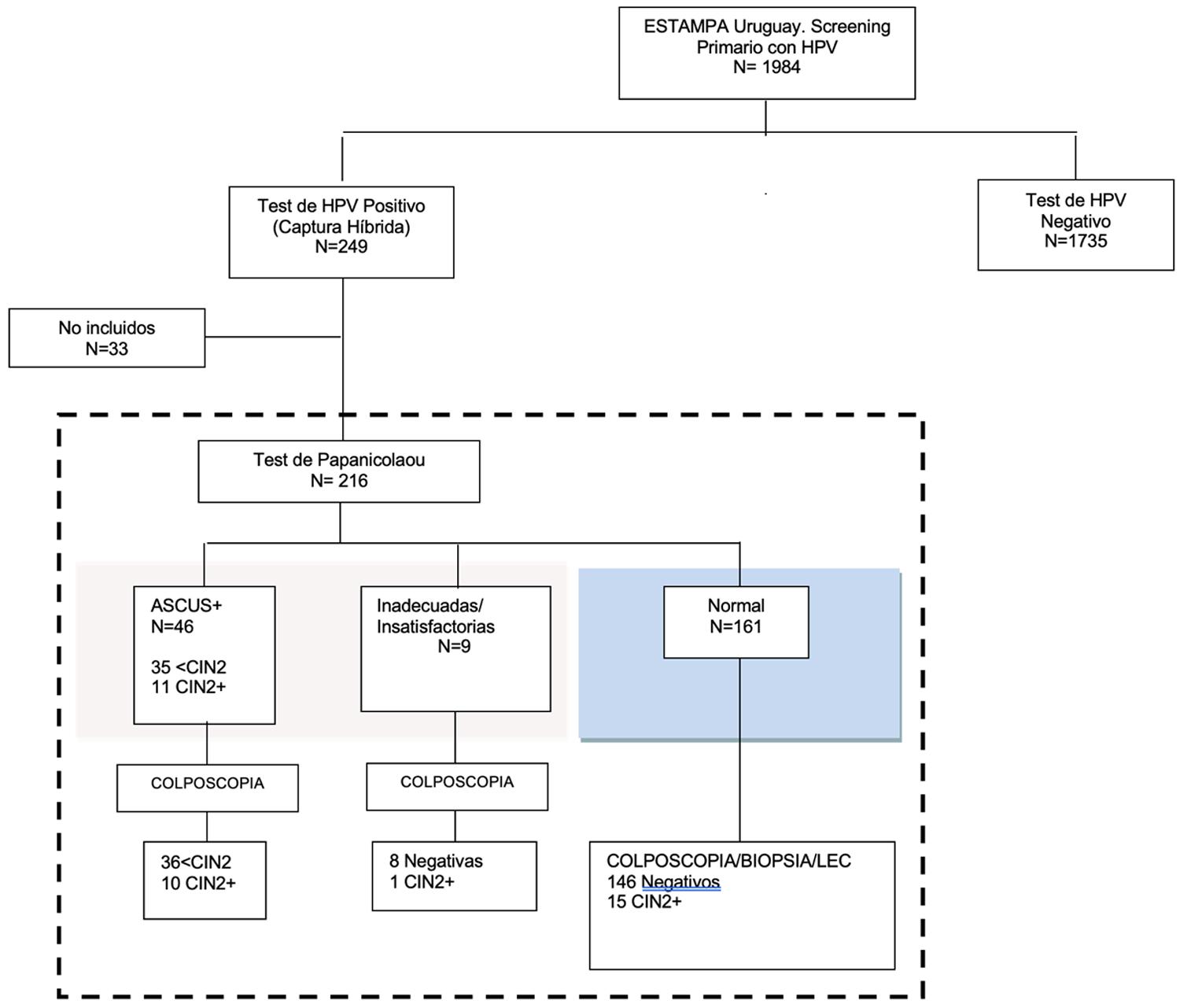
Figura 2. Simulación de Algoritmo B con los datos del Proyecto Estampa-Uruguay. Se evalúa el tamizaje con test de VPH sin tipificación, seguido de triaje con citología para los casos positivos a VPH.
Las pacientes que presentaron los genotipos de VPH 16 y/o 18 solos o con otros genotipos fueron clasificados como del grupo 16/18. Las que presentaron los genotipos de VPH de alto riesgo 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 70, 73 y/o 82, solos o agrupados, fueron clasificados como del grupo Alto Riesgo no 16/18. Las pacientes que sólo presentaron genotipos de bajo riesgo 6, 11, 40, 42, 43, 44/55 fueron clasificados como bajo riesgo.
El algoritmo A realiza el tamizaje mediante test de VPH seguido de triaje con tipificación parcial de VPH 16/18 y citología para los genotipos de alto riesgo distintos de 16/18. Según esta estrategia serían derivados a colposcopía aquellos casos con subtipos 16 o 18, así como aquellos con ASCUS+ en la citología de triaje. En aquellos con tipificación negativa o citología negativa podría corresponder seguimiento o retorno a tamizaje.
El algoritmo B realiza el tamizaje con Test de VPH, seguido de triaje con citología. En esta estrategia aquellos casos con citología ASCUS+ (e insatisfactorios) serían derivados a colposcopía y los restantes podría corresponder seguimiento o retorno a tamizaje.
Análisis estadístico
Los datos se tomaron de la base de datos de ESTAMPA-Uruguay. Para la evaluación del test de captura híbrida se analizaron los resultados según el valor de corte obtenido en el ensayo. Para los resultados de Papillocheck® se consideró positiva si se observaba una señal visible para los 5 lugares correspondientes a cada genotipo. Los resultados de las biopsias se consideraron con la máxima validez diagnóstica.
Se comparó la sensibilidad, especificidad, razón de verosimilitud positiva (LR+), razón de verosimilitud negativa (LR−), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) entre los dos algoritmos mediante el test pareado.
Se calcularon los intervalos de confianza al 95%. Para la comparación de los algoritmos, se usó la librería DTComPair del software R para test pareados y el software Stata v17. Se consideró un nivel de significación de 5% para las pruebas.
Consideraciones éticas
El Proyecto ESTAMPA obtuvo la aprobación de los comités de ética de la Agencia Internacional de Investigación sobre Cáncer (IARC, del inglés International Agency for Research on Cancer) el 26 de septiembre de 2012, del Centro Hospitalario Pereira Rossell (CHPR) el 18 de junio de 2014, de la División de Evaluación Sanitaria del Ministerio de Salud Pública (MSP) el 1 de diciembre de 2014 y del Instituto Nacional de Trasplantes de Órganos y Tejidos el 5 de noviembre de 2015.
Descargo de responsabilidad
Los autores identificados como personal de la Agencia Internacional para la Investigación sobre el Cáncer/Organización Mundial de la Salud, son los únicos responsables de las opiniones expresadas en este artículo y no necesariamente representan las decisiones, políticas u opiniones de la Agencia Internacional para la Investigación sobre el Cáncer/Organización Mundial de la Salud.
Resultados
Aplicando los algoritmos A y B, se realizó la simulación de la clasificación para cada paciente con los resultados disponibles. Los resultados de la aplicación del algoritmo con tipificación de VPH, seguido de citología para los casos VPH no 16/18 (Algoritmo A) se muestran en la figura 1. El Test de VPH fue positivo para 249 muestras (12,6%) y 1.735 (87,4%) fueron negativas. De las positivas, 216 se tipificaron. De las 216 muestras tipificadas, 41 (19,0%) fueron positivas para los genotipos 16 y/o 18, 126 (58,3%) positivas para otros genotipos de alto riesgo, 5 (2,3%) muestras con tipificación de bajo riesgo y 44 (20,4%) negativas.
Los resultados negativos para la tipificación de estas muestras, originalmente positivas en el tamizaje, posiblemente se deba a falsos positivos cerca del límite de corte del método de tamizaje o cargas virales cercanas al límite de detección en la tipificación. De estas muestras discordantes, 2 (4,54%) presentaron lesiones NIC2+, una de ellas se acompañaba de un test de Papanicolaou normal y la otra presentaba un test de Papanicolaou ASCUS+. Por lo tanto, en el algoritmo A ambos CIN2+ representan 2 de los 6 falsos negativos lo cual estaría afectando negativamente el desempeño del algoritmo A. Mientras que en el algoritmo B, uno de los CIN2+ se encuentra en el grupo ‘normal’ y el otro en el grupo ‘ASCUS+’ y por lo tanto, sólo uno de estos casos afectaría negativamente el desempeño del algoritmo B.
Ninguna de las muestras positivas para genotipos de bajo riesgo presentó lesiones NIC2+. De las mujeres negativas para test de VPH de alto riesgo, con test de Papanicolaou patológico, ninguna presentó lesiones en la colposcopía/biopsia. Las pacientes negativas para VPH y test de Papanicolaou no fueron enviadas a colposcopía.
En este algoritmo las 41 pacientes positivas para los genotipos de VPH 16 o 18 fueron derivadas directamente a colposcopía en donde se encontró que 14 pacientes (34,1%) presentaron lesiones NIC2+.
Se evaluó la combinación de los resultados de genotipificación con citología para el grupo de VPH positivos para genotipos de alto riesgo no 16/18 (n=126) (Figura 1). 33 (26,2%) pacientes presentaron alguna alteración citológica (ASCUS+), 87 (69,0%) presentaron citologías normales, 6 (4,8%) citologías fueron inadecuadas/ insatisfactorias. De las pacientes con citologías ASCUS+ (n=33) 7 (21,2%) presentaron lesiones NIC2+. En el grupo de pacientes VPH+ con citología normal, 4 (4,6%) presentaron lesiones NIC2+ y son considerados falsos negativos del algoritmo A que combina genotipificación con citología.
La simulación de los resultados de la aplicación del algoritmo sin tipificación de VPH (algoritmo B), basado en triaje con citología solamente se muestran en la figura 2. En este esquema, el triaje de 249 mujeres VPH positivas se realiza con citología. Se excluyeron 33 pacientes con resultados discordantes entre el test de VPH y la genotipificación por considerarse posibles falsos positivos de VPH dado que presentaban valores cercanos al corte (RLU=1). Se detectaron 46 pacientes con citología ASCUS+ (21,3%) que se derivaron a colposcopía, de las cuales 10 presentaron lesiones CIN2+. 9 pacientes con citología inadecuada/insatisfactoria (4,2%) también se derivaron a colposcopía resultado en la detección de 1 lesión CIN2+. 161 muestras (74,5%) fueron normales para la citología y se controlarían nuevamente a los dos años sin otros estudios en esta instancia. El análisis colposcópico y sus correspondientes biopsias mostró que 15 (9,3%) de estas pacientes presentaban lesiones NIC2+: 3 carcinomas (1,9%), 8 NIC3 (4,9%) y 4 NIC2 (2,5%) y son considerados falsos negativos.
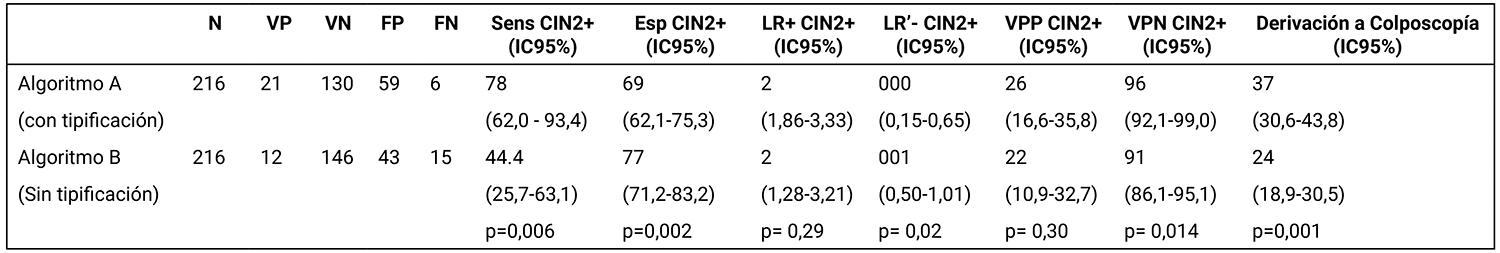
La comparación del desempeño de los algoritmos con y sin tipificación (A y B, respectivamente) se muestra en la tabla 1. La sensibilidad del algoritmo A con tipificación es mayor que la sensibilidad del algoritmo B sin tipificación (77,7% vs 44,4%) para las lesiones NIC2+, (p=0,006). La especificidad fue superior para el algoritmo B (77,2% vs 68,7) (p=0,002). La comparación LR+ no mostró diferencias estadísticamente significativas (p=0,29). El LR- mostró un mejor desempeño del algoritmo A con una diferencia significativa (p=0,02) lo cual indica que la tipificación de VPH es más eficiente en descartar enfermedad en los casos con resultados negativos.
La derivación a colposcopía fue mayor para el algoritmo A, con respecto al B (37,0% vs 24,4%, respectivamente) pero el número de colposcopías necesarias para la detección de una lesión NIC2+ fue menor para el algoritmo A (3,8 vs 4,6, respectivamente) (ver Tabla 2).
El riesgo absoluto de NIC2+ en la presencia de los genotipos de VPH 16 y/o 18 es 3,91 veces mayor en comparación con el riesgo de NIC2+ para los genotipos de alto riesgo distintos de 16/18 (Tabla 3).
Discusión
La detección del CCU y sus lesiones precursoras implica un equilibrio entre la sensibilidad y la especificidad de los métodos utilizados, la adecuada indicación de los procedimientos potencialmente invasivos y la eficiencia diagnóstica. La gran mayoría de las infecciones por VPH no llegarán a desarrollar cáncer por lo que su sola detección no es suficiente para un adecuado acercamiento a este problema. Por este motivo se han implementado a nivel internacional diversos algoritmos diagnósticos con test de tamizaje que clasifican los riesgos de presentar NIC3+ y optimizan los recursos disponibles. En este trabajo analizamos dos métodos de triaje disponibles en nuestro país, a fin de aportar respuestas a las preguntas que generalmente surgen cuando se toman decisiones acerca de cuál es el mejor abordaje según las herramientas diagnósticas disponibles y qué se espera de ellas. El Proyecto ESTAMPA no fue diseñado específicamente para realizar este análisis, sino que se utilizaron sus datos para realizar este trabajo, que es el resultado de interrogantes que fueron surgiendo en la implementación de las estrategias diagnósticas.
La comparación de los algoritmos analizados ha demostrado que la tipificación parcial duplica la sensibilidad para la detección de lesiones NIC2+, presenta un mayor VPP y VPN que la aplicación del Test de VPH sin tipificación. Distinguir la presencia de los genotipos VPH 16 y 18 es de utilidad diagnóstica, como ya fuera señalado por otros autores24,28, dada su relación de causalidad en la generación CCU.
Según Bonde7 en el momento del tamizaje primario y en etapas posteriores, el genotipo 16 presenta el riesgo mayor para NIC3+: 15% - 35% para cualquier citología y 8% - 25% para citologías negativas independientemente de la edad, el resultado citológico o el país de origen de la paciente7. El estudio ATHENA reportó un riesgo de NIC3+ para los genotipos 16/18 de 17,8%28. Otros autores reportaron un riesgo en presencia del genotipo 16 del 11,0% para NIC3+ y 19,5% para NIC2+29, así como 75,7% para NIC3+ y 81,0% NIC2+ en pacientes con citología de alto grado30. En otros estudios se determinó que el genotipo 18 tiene un riesgo intermedio entre el genotipo 16 y el resto de los genotipos de alto riesgo27,29,30 pero su importancia radica en su relación con adenocarcinomas de difícil detección por citología31.
En el presente estudio, el riesgo absoluto de tener una lesión NIC2+ para portadoras de los genotipos 16 y/o 18 fue de 34,1% por lo que su derivación a colposcopia no debe dilatarse. Además, el riesgo de tener una lesión NIC3+ en presencia de los genotipos 16/18 aumenta 5 veces a los 3 años28 por lo que los falsos negativos aumentan considerablemente el riesgo de CCU. El resto de los genotipos de alto riesgo presentan un riesgo absoluto para NIC2+ de 8,7%, similar al encontrado por otros autores (5,4%)28. A nivel mundial la prevalencia de lesiones NIC3 y adenocarcinoma in situ está en el orden del 0,5-1%32. En este trabajo la frecuencia encontrada de NIC3+ fue del 0,91% (18/1.984).
En los servicios donde la citología es la única opción de triaje, se deberá tomar en cuenta que la citología presenta una baja sensibilidad como método de tamizaje para NIC3+ y que puede afectar la sensibilidad final del algoritmo33, además de obligar a reducir el tiempo entre los controles, que generalmente se proponen entre 6 meses y un año24. La mitad de las lesiones NIC2+ son negativas para la citología28,34 y la tercera parte de los ASCUS (38,8%) son lesiones histológicas de alto grado35. En este trabajo encontramos resultados similares y la citología no pudo detectar 15 de 27 lesiones NIC2+ (55,5%) por lo que obliga a reducir el tiempo entre controles si no se dispone de una alternativa más eficiente en la detección de CCU y sus lesiones precursoras.
En un trabajo reciente se determinó que el riesgo de presentar NIC2+ para mujeres VPH positivas con citología negativa era de 24,4% para el genotipo 16, 16,2% para el genotipo 18, 9,2% para otros genotipos de alto riesgo y 12,1% para un resultado positivo para VPH, sin tipificación30. Por lo tanto, es correcto realizar un nuevo control al año y no diferirlo por un tiempo mayor. Se ha reportado que las lesiones NIC3+ encontradas en pacientes VPH positivas con citología normal al año del diagnóstico inicial fue del 29,5% para el genotipo 16, 15,6% para el genotipo 18 y 10,2% para otros genotipos de alto riesgo no 16/18. El riesgo general de tener un NIC3+ al año de presentar cualquier VPH de alto riesgo positivo fue del 14%30.
La derivación a colposcopia debe reservarse en primer lugar para aquellas mujeres que están en mayor riesgo de desarrollar un CCU. Uno de los mayores inconvenientes de un sistema de detección de CCU es la potencial saturación de los servicios de colposcopía por lo que la premisa básica, internacionalmente aceptada, para la referencia a colposcopia es: igual manejo para igual riesgo36. Se ha determinado que aquellas mujeres que tengan un 5,2% de riesgo de presentar NIC3+ dentro de los 3 años de su tamizaje positivo se refieren a colposcopia36. Este dato está determinado por el riesgo de NIC3+ para lesiones LSIL/VPH desconocido o ASCUS/VPH positivas23. La detección de los genotipos 16 y 18 no distingue entre infección transitoria o infección persistente pero la mayoría de los CCU se deben a estos dos genotipos, lo cual aumenta el riesgo de estas pacientes y deben derivarse a colposcopia37.
Se ha propuesto que para mujeres de 30 a 60 años de la población general la referencia a colposcopía sea cercana al 2%, con 2-4 colposcopías por cada NIC3 detectado38. En el presente estudio las colposcopias/NIC2+ realizadas fueron 3,8 para el algoritmo con tipificación (Algoritmo A) y 4,6 para el algoritmo sin tipificación (Algoritmo b) mostrando la mayor eficiencia de la tipificación parcial como test de triaje frente a la citología. La referencia a colposcopía de todas las pacientes estudiadas para el algoritmo A y B fue de 4,0% (80/1.984) y 2,7% (55/1.984) respectivamente. Las diferencias con la situación ideal posiblemente se deban a una mayor prevalencia de la infección.
Otros autores han reportado que el riesgo de desarrollar lesiones NIC3+ en pacientes positivas para VPH 16 en un seguimiento de 12 años fue del 47,4%39. En el mismo período, el riesgo de NIC3+ para el genotipo 18 fue del 19,1%, 14,3% para VPH 31 y 14,9% para VPH 33. La discriminación de los genotipos de VPH puede tener un impacto en la reducción de la derivación a colposcopía sin un aumento sustancial de la mortalidad o incidencia de lesiones NIC3+. Poder diferir los test de VPH, en comparación con la citología, también reduce las derivaciones a colposcopía innecesarias40.
La fortaleza del presente estudio es que se desarrolló dentro de un trabajo multicéntrico que incluyó capacitación y mejora continua de los procesos diagnósticos. Las limitantes del presente trabajo son el limitado número de muestras, que no fue posible utilizar un método de tipificación parcial sino que se disponía de captura híbrida y luego se realizó la tipificación con Papillocheck, que las muestras para test de Papanicolaou se procesaron en dos laboratorios diferentes y que al realizar la lectura de los Test de Papanicolaou, el operador desconocía el resultado de VPH y esto puede haber disminuido la sensibilidad del método.
Conclusiones
La tipificación parcial de VPH seguido de citología presenta una mayor sensibilidad para detectar lesiones NIC2+ con respecto a la citología sola como método de triaje. La tipificación parcial de VPH es más eficiente en descartar enfermedad en los casos con resultados de VPH negativos permitiendo diferir el siguiente control a 5 años. La presencia de los genotipos de VPH 16 y/o 18 determina un riesgo absoluto 2 veces mayor que un resultado VPH positivo sin tipificación y beneficia la selección de mujeres que deben derivarse a colposcopía. Se recomienda la tipificación parcial de VPH con detección de los genotipos 16 y/o 18 como método de triaje para la referencia directa a colposcopía.