Introducción
El delirium representa la manifestación más común y debilitante de disfunción aguda del sistema nervioso central (SNC)1–4. En pacientes sometidos a ventilación mecánica invasiva (VMI), su incidencia puede llegar hasta un 80%. Este trastorno no solo se vincula con un pronóstico desfavorable, que incluye mayor mortalidad y deterioro cognitivo a largo plazo, sino que también aumenta la duración de la VMI, la estadía en la unidad de cuidados intensivos (UCI), la longitud de la estadía hospitalaria (LEH), la tasa de eventos adversos y los costos sanitarios1–5.
Si se diseñara un experimento para ilustrar la magnitud del impacto del delirium como un problema grave en una UCI, la enfermedad por coronavirus 2019 (COVID-19), causada por el SARS-CoV-2, sería un ejemplo ideal6. La pandemia se asoció con una prevalencia notablemente alta de delirium entre los pacientes infectados, atribuible a una combinación de factores. Estos incluyen hipoxia, sedación profunda, inflamación sistémica, uso de corticoides, dolor, miedo, ansiedad, aislamiento familiar, privación del sueño y prolongada inmovilización, entre otros6,7. El manejo del delirium fue un problema recurrente en los pacientes con COVID-19, presentando desafíos significativos debido a la complejidad de sus condiciones clínicas y la imposibilidad de aplicar protocolos de prevención, dado que se requerían estrictas medidas de aislamiento. Además, el delirium tuvo un impacto negativo en la evolución de estos pacientes, generando secuelas que se investigan actualmente como parte del síndrome post-UCI y el Long COVID-196,7.
Según la Critical Care Medicine Society (CCMS), la piedra angular del tratamiento del delirium son las intervenciones no farmacológicas que se resumen en el paquete o bundle ABCDEF (Awakening and breathing coordination, delirium assessment, early exercise and mobilization and family: despertar, coordinación respiratoria, monitoreo del delirium, ejercicio, movilización precoz y empoderamiento de la familia)1,5,8–10.
Para cumplir la parte “D” del bundle, que se centra en la evaluación, prevención y manejo del delirium es esencial realizar el diagnóstico de delirium11.
A pesar de la creciente importancia del delirium y el aumento exponencial de investigaciones en este tópico a nivel mundial en los últimos años, en Uruguay las herramientas validadas para su diagnóstico, como el Confusion Assessment Method for Intensive Care Unit (CAM-ICU) y la escala de Richmond Agitation Sedation Scale (RASS). Utilizada en el paso 1 del CAM-ICU para evaluar los cambios en el nivel de conciencia, no se han incorporado de manera sistemática en la práctica clínica11–13. En 2015, se llevó a cabo el primer estudio prospectivo sobre el delirium en la UCI en el Hospital Pasteur, centrándose en pacientes con VMI mayor o igual a 48 horas. Este estudio reveló una alta incidencia de delirium (80%) en estos pacientes, coincidiendo con cifras internacionales14, observándose además un uso limitado de las herramientas diagnósticas por parte del personal de salud, reflejado en un bajo grado de cumplimiento del RASS (0,17 [DE 0,07]) y del CAM-ICU (0,20 [DE 0,11]), lo que contribuye al sub-diagnóstico del delirium. Esta situación destacó la necesidad de capacitar al personal clínico para mejorar la detección y el manejo del delirium11.
A partir de lo cual se emprendió en el 2016 un programa denominado Por una UCI sin delirium que involucró intervenciones educativas destinadas a capacitar al personal de salud en la aplicación de las herramientas diagnósticas para el delirium11.
Estas intervenciones educativas formaron parte de un programa de educación médica continua, diseñado a partir del conocimiento previo del personal de salud y los aspectos que requerían reforzarse. Las acciones educativas se dirigieron a todo el personal de la UCI del Hospital Pasteur, incluyendo auxiliares y licenciados en enfermería, fisioterapeutas y médicos, proporcionando formación y entrenamiento en el uso de herramientas diagnósticas como el CAM-ICU y el RASS a través de talleres y educación en la cabecera del paciente11.
En 2017, con el fin de comprender el impacto que las intervenciones educativas que formaron parte del programa Por una UCI sin delirium tuvieron en la detección y diagnóstico del delirium en la UCI del Hospital Pasteur, se diseñó el presente estudio con los siguientes objetivos:
Evaluar el impacto de las intervenciones educativas en la mejora de la aplicación del RASS y del CAM-ICU.
Estudiar la incidencia del delirium, sus factores de riesgo y su relación con la longitud de estadía hospitalaria y la mortalidad postintervenciones educativas.
Comparar la incidencia de delirium en pacientes con VMI ≥ a 48 horas, con los datos obtenidos en el estudio del 2015.
Métodos
Diseño del estudio
Se realizó un estudio descriptivo, prospectivo y de cohorte en un único centro, la UCI del Hospital Pasteur, unidad polivalente médico-quirúrgica con 25 camas, gestionada por el Ministerio de Salud Pública y perteneciente a la Administración de Servicios de Salud del Estado (ASSE) en Montevideo, Uruguay.
Población estudiada
El estudio incluyó a todos los pacientes ingresados entre el 1 de marzo y el 31 de mayo del 2017. Se incluyeron pacientes mayores de 18 años con una estadía en la UCI ≥ 24 horas, independientemente de si requirieron VMI o no.
Se excluyeron los pacientes con diagnóstico documentado de patología neurológica o neuropsiquiátrica severa que dificultara la comunicación efectiva y la realización del CAM-ICU. También se excluyeron aquellos con niveles de RASS sostenidos en −4 o −5, es decir, en estado de coma durante toda su estadía en la UCI, ya que la detección del delirium no sería posible. Se excluyeron además los pacientes readmitidos en la UCI en menos de 48 horas; pacientes trasladados desde otras unidades, y pacientes trasladados a otros centros de salud, puesto que dificultaría su seguimiento adecuado.
Características clínicas registradas y variables estudiadas
Las características clínicas de cada paciente fueron analizadas y divididas en tres grupos, según su posible relación con el desarrollo de delirium. Estas variables se clasificaron como:
Pre-UCI (previas a la admisión a la UCI): incluyeron edad, sexo, y antecedentes personales (AP) como patología psiquiátrica, consumo de alcohol, tabaco, cannabis, cocaína o pasta base de cocaína (PBC), portador de HIV, accidente cerebrovascular (ACV), hipertensión arterial (HTA), diabetes y enfermedad pulmonar obstructiva crónica (EPOC)1,10,14.
Al momento de la admisión a la UCI: se consideró la severidad de la enfermedad con el score Acute Physiology and Chronic Health disease Classification System II (APACHE II) aplicado después de las primeras 24 horas del ingreso, y el tipo de patología médica o quirúrgica que motivó la admisión a la UCI1,10,14.
-
Durante la estadía en la UCI (Intra-UCI): se estudiaron los días de estadía en la UCI, días de VMI, días de sedación y días de analgesia. La monitorización del RASS y del CAM-ICU se realizó mientras los pacientes estuvieron en la UCI.
Todas las variables del estudio, incluyendo el resultado (fallecimiento o recuperación), se registraron hasta el alta de la UCI. Posterior al alta de la UCI, se consideró la mortalidad en la UCI, la mortalidad al alta hospitalaria y la LEH.
Diagnóstico de delirium
Se empleó una versión validada en español del CAM-ICU como herramienta diagnóstica. El delirium fue diagnosticado cuando el CAM-ICU fue positivo. La presencia de delirium se evaluó dos veces al día por enfermería o médicos residentes utilizando el CAM-ICU, en los turnos de la mañana y de la tarde. Se definió delirium durante la estadía en la UCI como al menos un resultado positivo en el CAM-ICU15–18.
El delirium se clasificó de acuerdo con los subtipos motores de la siguiente manera: los pacientes hiperactivos eran CAM-ICU positivos y estaban agitados, inquietos o emocionalmente lábiles (es decir, con RASS entre +1 a +4). El delirium hipoactivo se caracterizó cuando los pacientes eran CAM-ICU positivos y el RASS estaba entre 0 y −3, y el delirium mixto cuando existió una combinación de ambos10,13,14,19.
Se analizó la incidencia de delirium, sus factores de riesgo, y se investigó la relación entre el delirium, la LEH y la mortalidad. Se consideró el primer día de aparición del delirium, como el primer día en que se detectó el delirium en la evolución del paciente en la UCI o sea el primer día que el CAM ICU fue positivo. La duración del delirium se definió como la cantidad de días que el CAM ICU fue positivo.
Evaluación de la aplicación de las herramientas diagnósticas
Para evaluar el impacto de las intervenciones educativas en la mejora de la aplicación del RASS y del CAM-ICU, se utilizaron medidas específicas:
Evaluación del uso de la herramienta diagnóstica: se midió a través de la proporción de pacientes evaluados: o sea, la relación entre el número de pacientes en los que se aplicó el RASS y el CAM ICU y el número total de pacientes18.
Grado de cumplimiento de la herramienta diagnóstica: se evaluó a través de la frecuencia de aplicación: o sea, la relación entre el número de veces que se aplicaron el RASS y el CAM-ICU y el número de aplicaciones recomendadas por los estándares establecidos en la literatura18.
La frecuencia recomendada: según las recomendaciones, el RASS debería aplicarse al menos cada 6 horas, así como ante cualquier cambio en el nivel de conciencia o sedación del paciente. El CAM-ICU se sugiere aplicarlo al menos una vez por turno de enfermería, aproximadamente cada 12 horas, o siempre que se observe un cambio en el estado mental del paciente10,11.
Incidencia de Delirium en pacientes con VMI mayor o igual 48 horas: estudio comparativo con datos del año 2015
En el presente estudio comparativo, se llevó a cabo un análisis de la incidencia de delirium en el subgrupo de pacientes sometidos a VMI durante 48 horas o más. Se realizó una comparación con los datos históricos recopilados en el año 201514.
Aspectos éticos
El estudio recibió la aprobación del Comité de Ética en Investigación del Hospital Pasteur, perteneciente a la ASSE en Montevideo, Uruguay, en octubre de 2017 con el número de referencia: 29/006/3/696/2017/0/0. Se especifica que se eximió el consentimiento informado para este estudio.
Análisis estadístico
Se empleó estadística descriptiva para resumir las variables demográficas y clínicas. Las variables continuas se describieron utilizando medias y desviación estándar (DE) o medianas y rango intercuartílico, según la distribución de los datos. Para comparar las variables continuas entre los grupos de delirium y no delirium, se utilizaron pruebas como el Test de Student o el test de Mann-Whitney, dependiendo de la distribución de los datos, mientras que para las variables cualitativas se emplearon pruebas como χ2 o el Test de Fisher.
La normalidad de las variables se verificó con el test de Kolmogórov-Smirnov. Para identificar los factores de riesgo asociados al desarrollo de delirium y a la mortalidad al alta de la UCI, se realizó un análisis univariado.
Se consideraron significativos los valores de p menores a 0,05. Luego, se llevó a cabo un análisis de regresión logística para determinar los factores de riesgo relacionados con el desarrollo del delirium en la UCI. Aquellas variables con p < 0,20 en el análisis univariado y consideradas clínicamente relevantes fueron seleccionadas para el análisis multivariado mediante regresión logística. Los resultados del análisis multivariado se presentaron como odds ratio (OR) con intervalos de confianza (IC) del 95%. Todos los cálculos se realizaron utilizando el software SPSS (State Corp LP, versión 13).
Resultados
Desde el 1 de marzo hasta el 31 de mayo de 2017, fueron admitidos 309 pacientes en la UCI, 84 de los mismos fueron excluidos, y 225 fueron estudiados. (Figura 1) (Flujograma).

Figura 1. Flujograma.UCI: unidad de cuidados intensivos; CAM-ICU: Confusion Assessment Method for the Intensive Care Unit.
Con respecto al uso de las herramientas diagnósticas, el RASS fue aplicado al 100% (N=225) de los pacientes, mientras que el CAM-ICU se aplicó en el 91,6% (N=206).
Al evaluar el grado de cumplimiento respecto de los estándares de las herramientas diagnósticas, se observó que el grado de cumplimiento respecto de la norma en el RASS fue del 54% (0,54) con una DE 0,3. Por otro lado, el grado de cumplimiento respecto de la norma en el CAM-ICU fue de 70%, (0,70) con una DE 0,4.
De los pacientes estudiados, el 7,1% (N=16) permanecieron en coma, lo que impidió la aplicación del CAM-ICU; además, en un 1,3% (N=3) no se pudo realizar dicha evaluación.
En la Figura 2 se muestra la comparación del grado de cumplimiento del RASS y del CAM ICU entre el año 2015 y el año 2017.
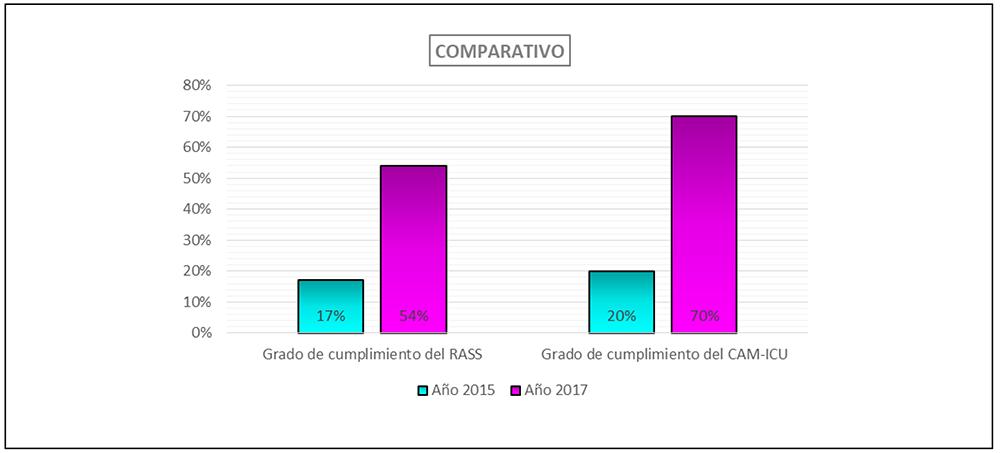
Figura 2. Comparación del grado de cumplimiento del RASS y del CAM ICU entre el año 2015 y el año 2017.Grado de Cumplimiento: se evaluó a través de la frecuencia de aplicación: definida por la relación entre el número de veces que se aplicaron el RASS y el CAM-ICU y el número de aplicaciones recomendadas por los estándares establecidos en la literatura.RASS: Richmond Agitation Sedation Scale.CAM-ICU: Confusion Assessment Method for the Intensive Care Unit.BED SIDE: Al lado de la cama.
En la Figura 3 se muestra la estructura cronológica del plan de trabajo respecto al grado de cumplimiento de la aplicación del RASS y del CAM ICU antes y después de las intervenciones educativas del 2016 y del proyecto Por una UCI sin delirium. Los datos demográficos y clínicos de la población se presentan en la Tabla 1. La población general se dividió en dos grupos: el grupo delirium y el grupo no delirium según si habían presentado delirium o no.
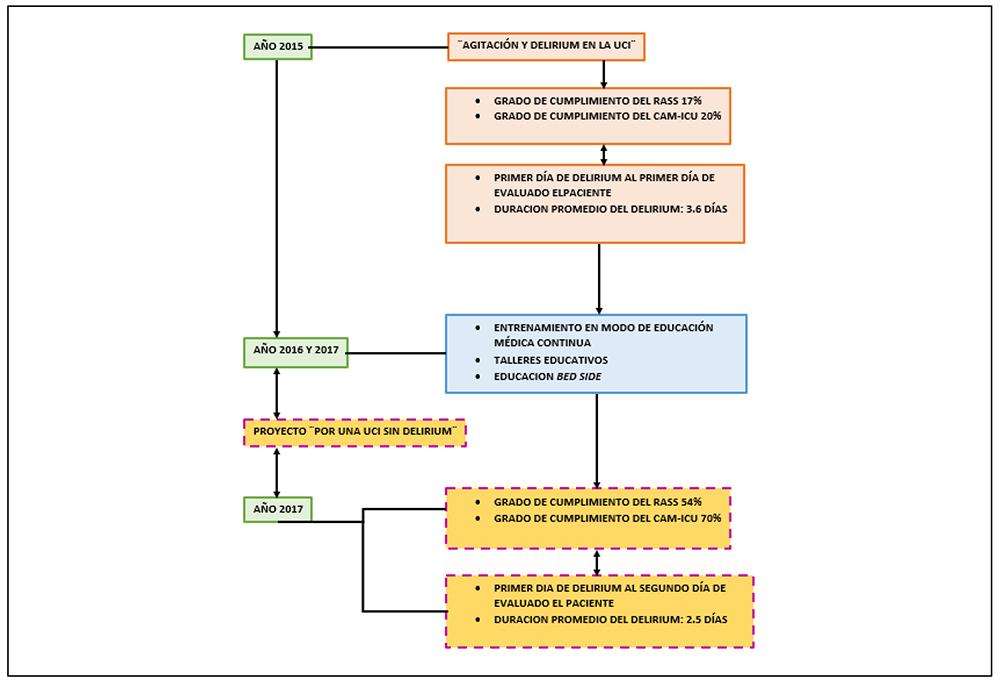
Figura 3. Estructura cronológica del plan de trabajo respecto al grado de cumplimiento de la aplicación del RASS y del CAM ICU antes y después de las intervenciones educativas del 2016 y del proyecto Por una UCI sin delirium.Grado de Cumplimiento: se evaluó a través de la frecuencia de aplicación: definida por la relación entre el número de veces que se aplicaron el RASS y el CAM-ICU y el número de aplicaciones recomendadas por los estándares establecidos en la literatura.RASS: Richmond Agitation Sedation Scale.CAM-ICU: Confusion Assessment Method for the Intensive Care Unit.
Tabla 1. Características basales de la población y resultados clínicos de acuerdo a condición de delirium si/no.
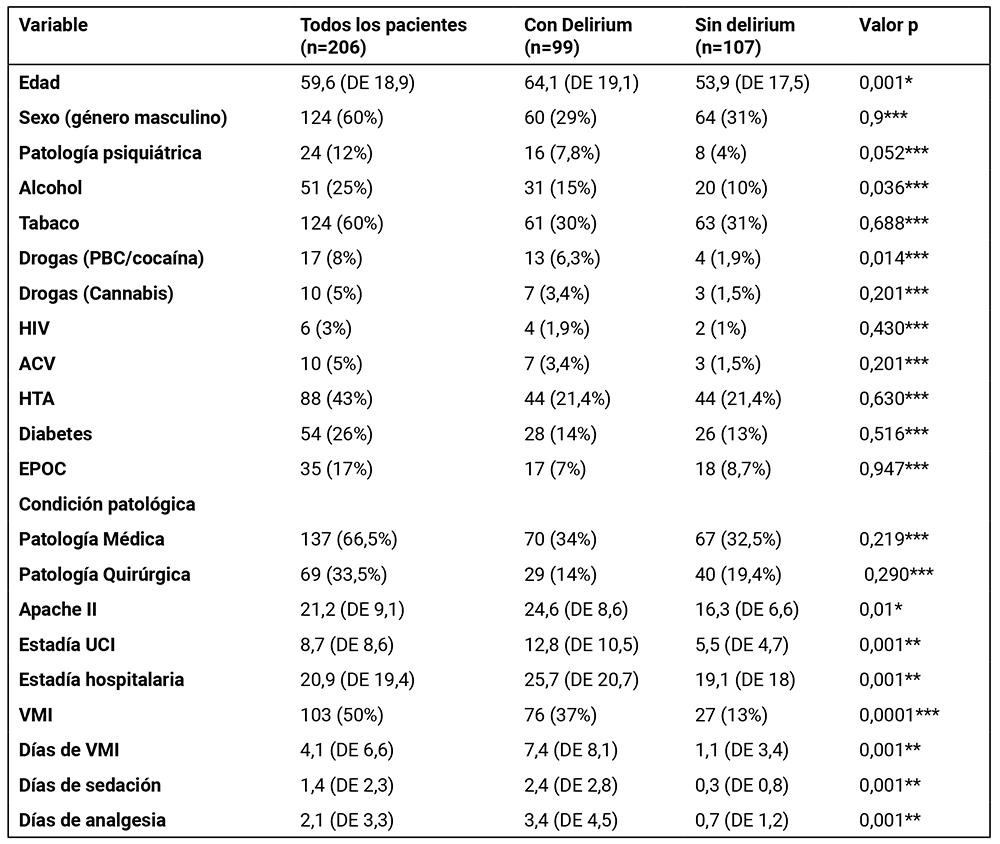
PBC - pasta base de cocaína; HIV - human immunodeficiency virus; ACV - accidente cerebrovascular;
HTA - hipertensión arterial; EPOC -enfermedad pulmonar obstructiva crónica;
APACHE II - Acute Physiology and Chronic Health Evaluation; UCI-unidad de cuidados intensivos;
VMI – ventilación mecánica invasiva.
Valores expresados como n (%), media, DE: desvío estándar.
(*) Test de t para muestras independientes, (**) Prueba de Mann-Whitney para muestras independientes, (***) Test de X2, (****) Test exacto de Fisher.
La incidencia global (pacientes con y sin VMI) de delirium fue del 48% (99/225). Entre los pacientes diagnosticados con delirium, el 77% (76/99) estaban bajo VMI. La duración promedio del delirium fue de 2,5 días (DE 1,7). El primer día de aparición del delirium, fue el segundo día de evolución del paciente, con una media de 1,95 días (DE 1,6).
Con respecto a los subtipos motores de delirium se encontró: 22/99 (22,4%) hipoactivo y 76/99 (77,6%) mixto.
Se encontraron diferencias significativas entre el grupo delirium y el no delirium en cuanto a la edad, consumo de alcohol, consumo de PBC o cocaína, APACHE II, días de estadía en UCI, LEH, VMI, días de VMI, días de sedación y días de analgesia.
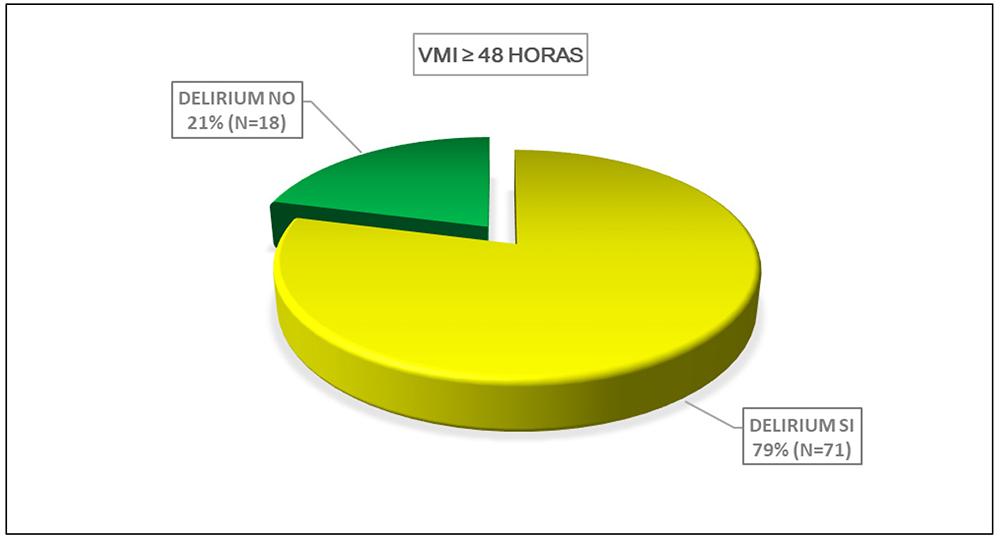
La incidencia de delirium en el subgrupo de pacientes con VMI ≥ 48 horas fue del 79% (Figura 4).
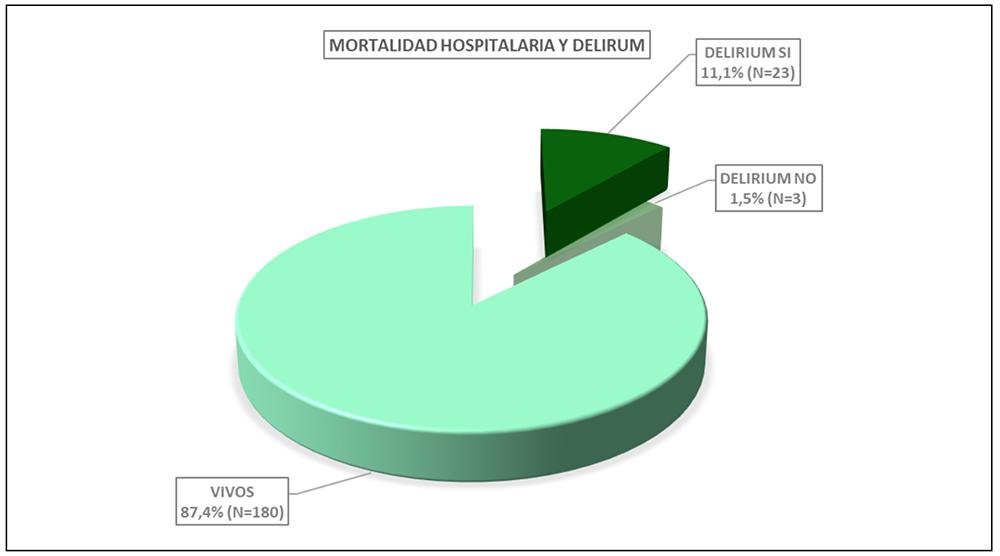
Evaluación de la mortalidad en relación con el delirium: la mortalidad se evaluó únicamente en aquellos pacientes a quienes se les aplicó el CAM-ICU durante su estadía en la UCI. Este enfoque permite una identificación precisa de los pacientes que desarrollaron delirium y su relación con los resultados clínicos. Los hallazgos muestran que tanto la mortalidad en la UCI (Figura 5) como la mortalidad hospitalaria fueron significativamente más altas en los pacientes que presentaron delirium en comparación con aquellos que no desarrollaron esta condición (Tabla 2).
Tabla 2. Mortalidad en UCI y Hospitalaria.

UCI - unidad de cuidados intensivos.
(****) Test exacto de Fisher.
En el análisis multivariado por regresión logística, utilizando el delirium como la variable dependiente, los factores asociados a su desarrollo fueron la edad ≥ a 65 años (OR 7,56 [IC 3,34 – 17,1]), la VMI (OR 3,46 [IC 1,15 – 10,4]), y los días de sedación (OR 1,88 [IC 1,19 – 2,96]), (Tabla 3).
Tabla 3. Análisis multivariado utilizando delirium como variable dependiente.
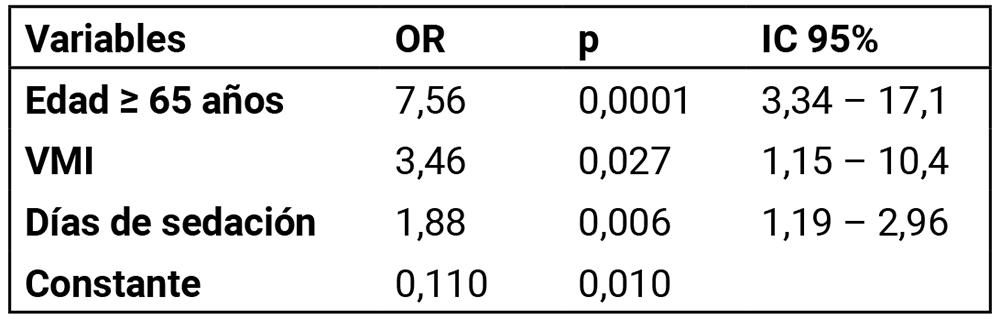
VMI - ventilación mecánica invasiva.
OR: odds ratio, IC 95%: intervalo de confianza 95%. Incluye solo variables con p < 0,20.
El conjunto de datos que apoya los resultados de este estudio no se encuentran disponibles.
Discusión
El análisis de los resultados del CAM-ICU y el RASS, revela varios aspectos positivos y áreas de oportunidad en el manejo del delirium en la UCI. Un hallazgo relevante fue el aumento en el grado de cumplimiento de las herramientas con un promedio del 50% del CAM-ICU y del 37% en el RASS entre los años 2015 y 20179. Este incremento refleja la efectividad del entrenamiento del personal de salud a través de medidas educativas simples.
No obstante, es importante señalar que estas cifras aún se sitúan por debajo de los estándares óptimos recomendados. La detección precoz del delirium es crucial porque permite implementar estrategias preventivas y de tratamiento más oportunas5,8,10,11,20–22.
La incidencia global de delirium fue del 48%, similar a los resultados de Ely et al. y Lin et al1,4. En pacientes con VMI, la incidencia fue del 77%, coincidiendo con estudios que reportan tasas de 60-80% en estos pacientes, como los de McPherson, Ely y Pandharipande1,2,3,4,10.
Con respecto a los subtipos motores de delirium, se encontró que el delirium más frecuente fue el mixto y el hipoactivo, esto es concordante con lo encontrado por mayoría de los autores como Wschebor et al., entre otros13. Por lo tanto, la mayoría del delirium observado en la UCI es hipoactivo o mixto, lo que requiere un seguimiento rutinario para su detección. Dado que el 75% del delirium hipoactivo puede pasar desapercibido, siendo el subtipo más difícil de reconocer y el que presagia resultados más peligrosos14,19.
La duración del delirium fue de 2,5 días (DE 1,7), cuando se compara con el estudio del 201514, cuya duración fue de 4 días (DE 2-6,75), se observa un acortamiento en la duración del mismo. Este es un resultado positivo que puede ser atribuido al reconocimiento temprano del síndrome por parte del equipo de salud. Cada día con delirium se asocia de forma independiente con un mayor riesgo de muerte del 10%9. Esto sugiere que la implementación de tratamientos en una fase más temprana del delirium puede llevar a una reducción en su duración y potencialmente en sus efectos negativos en los pacientes. La duración del delirium es un predictor significativo de una serie de desenlaces adversos, entre ellos: aumento de la LHE, del deterioro cognitivo, y la mortalidad, por lo cual es esencial acortar el tiempo del mismo1,8,10,15,23,24.
En relación con el primer día de aparición del delirium, en el estudio del 2017 el delirium se detectó por primera vez en el segundo día de evolución del paciente (1,95 días). En contraste, en el estudio del 2015 se reportó que el primer día de detección del delirium fue casi en el cuarto día de evolución (3,6 días). Este hallazgo es consistente con la mayoría de los estudios publicados, que indican que el delirium suele aparecer a partir del tercer día de estadía en la UCI. La diferencia entre el cuarto día de aparición reportado en el estudio de 2015 y el segundo día observado en el estudio actual sugiere una posible mejora en la detección temprana y el manejo de esta condición en el entorno de la UCI. Este cambio puede reflejar un aumento en la conciencia y la capacitación del personal de salud en la identificación del delirium, lo cual tiene un impacto positivo en la calidad de atención que se brinda a los pacientes críticos25,26.
Los datos referentes al día de aparición del delirium y su duración en estos pacientes han mostrado una correlación consistente con los hallazgos en diversas series internacionales, como se observa en los trabajos de Shehabi y Girard et al.23,24. Estos estudios resaltan la importancia de las intervenciones no farmacológicas en la reducción de la incidencia y duración del delirium, subrayando la relevancia de un enfoque integral y personalizado en el cuidado de pacientes en unidades críticas5,22–26. Con respecto a la mortalidad en UCI se observó una mortalidad del 9,7%. La mortalidad hospitalaria fue del 12,6%, de los 26 pacientes fallecidos, 23 pacientes presentaron delirium.
Si bien tanto la mortalidad en UCI como la hospitalaria fue mayor en los pacientes con delirium, en nuestro estudio el delirium no fue un factor de riesgo independiente para la mortalidad. No coincidiendo con la mayoría de los reportes como los de Zhongheng E. y otros autores que identifican el delirium como un factor independiente de mortalidad2,3,9,10,27,28.
Por otro lado, el estudio multicéntrico realizado por Hughes et al. analiza la relación entre el delirium durante una enfermedad crítica y la mortalidad. Sus hallazgos revelan que el delirium se asocia con un riesgo casi tres veces mayor de mortalidad hospitalaria. Sin embargo, no está claro si dicha asociación se mantiene una vez que los pacientes han sido dados de alta del hospital29.
Con respecto a los factores de riesgo, cuando se examinaron los factores predisponentes previos al ingreso en la UCI, se identificó la edad avanzada (pacientes mayores de 65 años) como un factor de riesgo independiente para delirium coincidiendo con la mayoría de los trabajos publicados30,31.
La edad, especialmente a partir de los 65 años, es un factor de riesgo independiente para el delirium en la UCI. El delirium puede ser la primera señal de una enfermedad grave. El delirium se relaciona con mayor riesgo de deterioro cognitivo y funcional, influenciado por demencia previa, comorbilidades, medicamentos anticolinérgicos y discapacidades sensoriales27,28.
En los pacientes añosos se debe tener en cuenta el delirium superpuesto a la demencia (DSD) que es una condición en la cual el delirium se presenta al mismo tiempo que una demencia preexistente. Esta condición a menudo no es reconocida adecuadamente por el personal de salud, y ocurre hasta en el 89% de los pacientes hospitalizados.
Programas preventivos como el Hospital Elder Life Program (HELP) diseñado por S.K. Inouye en 1999, han demostrado ser eficaces en la reducción de la incidencia de delirium en pacientes geriátricos hospitalizados30,31.
En nuestro estudio, el delirium fue más frecuente en pacientes con antecedentes de consumo de alcohol, pero este no se identificó como un factor de riesgo independiente. Esto contrasta con otras publicaciones que consideran el alcohol un factor predisponente significativo para el delirium1,4,5. Las discrepancias pueden deberse al tamaño de la muestra, variables de confusión no controladas adecuadamente, y la caracterización del consumo de alcohol, que en nuestro trabajo solo se definió como consumo habitual sin otras especificaciones.
También en nuestro análisis, el delirium fue más frecuente en los pacientes con AP de consumo de PCB o cocaína, pero el antecedente de consumo de estas drogas no resultó ser un factor de riesgo independiente para delirium.
No obstante, es sabido que la intoxicación aguda por sustancias psicoactivas como la abstinencia a las mismas pueden ser desencadenantes de cuadros de delirium generados a través de diferentes mecanismos de acción influyentes sobre el SNC y autónomo32,33.
En nuestra investigación la patología psiquiátrica no se asoció al delirium. Sin embargo, existen varios trabajos como el de Ormseth4 que demuestran que la patología psiquiátrica puede ser un factor precipitante de delirium34,35.
Con respecto a los factores de riesgo en el momento de la admisión a la UCI: el puntaje del APACHE II fue mayor en los pacientes con delirium que en aquellos que no presentaron delirium. Sin embargo, no resultó ser un factor de riesgo independiente para el delirium. El APACHE II es una variable controvertida en relación con su asociación con el delirium, ya que algunas investigaciones lo identifican como un factor predisponente, mientras que otras no4,36.
La estadía promedio en la UCI fue de 8,7 días (DE 8,6), aquellos pacientes con delirium tuvieron una estadía significativamente más larga en la UCI, con una diferencia de 7,7 días adicionales comparado con los que no presentaron delirium. Estos hallazgos son consistentes con otros estudios, como los realizados por Ely entre otros autores3,4.
El delirium, como factor determinante de una mayor LEH3,5, está ampliamente documentado en la mayoría de las investigaciones publicadas. Nuestros hallazgos son consistentes con dicha literatura. la media de LEH para la población total fue de 20,9 días (DE 19,4), mientras que aquellos que presentaron delirium tuvieron una LEH de 6,6 días adicionales en comparación con los pacientes que no experimentaron dicha condición.
La incidencia de delirium entre los pacientes que requirieron VMI fue del 77%. La regresión logística mostró que la VMI es un factor de riesgo independiente para la aparición de delirium, coincidiendo con las investigaciones previas de Ely2, que también identifica la VMI como un factor de riesgo significativo para el delirium2,4.
En el estudio comparativo en el subgrupo de pacientes sometidos a VMI durante ≥ 48 horas, en la incidencia de delirium no se encontraron cambios con respecto al 201514. Si bien es preocupante que la incidencia de delirium no haya disminuido tras la capacitación, se debe seguir insistiendo en la misma. Además, revisar las metodologías y considerar factores como el entorno y la sedación podría ser necesario. Un enfoque multidisciplinario y ajustes en las prácticas clínicas podrían ser clave para mejorar su prevención. Estos resultados encontrados están en concordancia con los datos reportados por la mayoría de las publicaciones1,2,9.
En pacientes sin VMI, se registró una incidencia de delirium del 23%, siendo más bajo que en los pacientes ventilados. La incidencia de delirium en los pacientes sin VMI tiende a fluctuar en un rango que va del 20 al 50%, y se asocia con las diversas características de la población estudiada. Estos resultados coinciden con investigaciones previas, tal como las realizadas por Brummel y Girard37.
Nuestro trabajo coincide con la investigación de Ely y la mayoría de la literatura al mostrar que el delirium es más frecuente en pacientes con más días de VMI2,4,9,15. A mayor duración de la VMI, mayor riesgo de delirium. En nuestro estudio, los pacientes con delirium tuvieron en promedio 7,4 días de VMI, 6,3 días más que los sin delirium y 3,3 días más que la población total examinada.
En nuestro estudio, se encontró que los días de sedación están asociados al delirium, siendo un factor de riesgo independiente para su desarrollo. Esta relación ha sido consistente con la literatura (Pandharipande, Ely, Svenningsen y Shehabi). Los pacientes con delirium tuvieron en promedio 2,4 días de sedación (DE 2,8), más que los pacientes sin delirium. Una sedación prolongada se ha asociado con complicaciones como mayor duración de la VMI y mayor estadía en la UCI. Es crucial un manejo cuidadoso de la sedación en pacientes críticamente enfermos para prevenir el delirium4,5,37–39.
Se ha demostrado que la interrupción diaria de la sedación (IDS) junto con el empleo de protocolos estandarizados, reduce el número total de días de delirium en pacientes en UCI5,10,37–40.
Es imperativo personalizar este enfoque teniendo en cuenta las características y la comorbilidad de cada paciente, especialmente en aquellos con compromiso renal y/o hepático5.
El objetivo para el nivel de sedación se establece, en los pacientes para quienes sea posible, en un nivel de RASS entre 0 y −1. Esto busca lograr una sedación consciente donde el paciente se encuentre confortable, tranquilo y despierto, conocida como “light sedation”5,10.
Las pautas de la CCMS recomiendan evitar las benzodiazepinas por su asociación con una mayor duración de la VMI y de la estadía en la UCI. Cualquier sedante debe seleccionarse según la evaluación clínica, considerando el riesgo y beneficio para el paciente. La sedación continua prolonga la VMI, la estadía en la UCI, y eleva el riesgo de delirium y supresión de ondas cerebrales en el electroencefalograma (EEG), lo cual está relacionado con mayor mortalidad y peor recuperación. Por ello, se recomienda la sedación mínima necesaria, como la sedación intermitente o las interrupciones diarias, para facilitar las evaluaciones neurológicas y la rehabilitación temprana8–10.
Los días de analgesia, también fueron superiores en los pacientes con delirium, aunque la analgesia no se presentó como factor independientemente asociado. Los pacientes con delirium tuvieron 2,7 días más de analgesia que aquellos sin delirium, y 1,3 días más que la población total. El uso prolongado de opioides en pacientes de UCI, seguido de una reducción o interrupción abrupta, puede causar síndrome de abstinencia y delirium. En pacientes críticamente enfermos, el síndrome de abstinencia a opioides es una condición común y clínicamente significativa. El manejo del dolor en UCI puede ser dificultoso, lo que en ocasiones lleva a sedaciones innecesarias4,5,10.
Limitaciones del estudio
Estudio unicéntrico: al tratarse de un estudio realizado en un único centro, los hallazgos pueden no ser generalizables a otras instituciones, especialmente aquellas con diferentes características de pacientes, recursos y protocolos de atención.
Restricciones de inclusión: la exclusión de pacientes con patología neurológica o neuropsiquiátrica severa, y de aquellos en estado de coma, puede limitar la aplicabilidad de los resultados a la población general que podría presentar riesgo de delirium. Esto puede introducir un sesgo en la muestra, ya que los pacientes excluidos pueden tener un perfil de riesgos diferente.
Diseño del estudio: es un estudio descriptivo observacional que puede tener sesgos que no están presentes en los ensayos controlados aleatorios.
Tamaño de la muestra: un número limitado de pacientes puede dar como resultado una baja potencia estadística y puede afectar la generalización de los resultados.
Mediciones subjetivas: aunque se utilizaron herramientas validadas como el CAM-ICU y el RASS, la aplicación y la evaluación de estas escalas pueden estar sujetas a interpretaciones subjetivas por parte del personal de salud, lo que podría comprometer la coherencia y la validez de los diagnósticos.
Factores de confusión y variabilidad de los datos: la diversidad de condiciones médicas de los pacientes, así como la variabilidad en la práctica clínica entre los diferentes profesionales de la salud, puede afectar los resultados y complicar la identificación de los factores de riesgo asociados con el delirium.
Recopilación de datos retrospectiva: a pesar de ser un estudio prospectivo, la recopilación de datos sobre antecedentes personales y características clínicas puede depender de la precisión con que se registraron los datos en la historia clínica, lo que podría introducir sesgos de recuerdo.
Limitaciones en el seguimiento: la evaluación de la mortalidad y la LEH se limitó a la UCI y el alta hospitalaria, lo que podría no considerar los resultados a largo plazo de estos pacientes, sobre todo conociendo el papel que desempeña el delirium como determinante de deterioro cognitivo a largo plazo en el contexto del síndrome post UCI.
Conclusiones
El programa Por una UCI sin delirium de capacitación al personal tuvo un impacto positivo con una mejora en el uso del RASS y del CAM-ICU, pero no produjo cambios significativos sobre la incidencia del delirium, sus factores de riesgo y las variables relacionadas.
La incidencia de delirium sigue siendo alta, con factores de riesgo predominantes como la edad avanzada, la VMI y la sedación. Estos factores contribuyen a estadías hospitalarias prolongadas y a mayores tasas de mortalidad. Aunque la detección del delirium ha mejorado, con un diagnóstico más temprano y una duración más corta que en 2015, se requiere un estudio futuro que analice todas las variables en pacientes con VMI de 48 horas o más. En este estudio solo se ha comparado la incidencia en este subgrupo de pacientes, no constándose cambios con el 2015.
Se recomienda la perpetuación y ampliación de talleres educativos destinados a motivar al equipo de salud para la utilización de herramientas diagnósticas adecuadas. Asimismo, se sugiere la implementación de estrategias multimodales que optimicen la prevención, el diagnóstico y el tratamiento del delirium. La clave para detectar y controlar el delirium comienza con el diagnóstico oportuno un alto cumplimiento de las medidas preventivas, estableciendo una cultura activa de sedación ligera o ninguna sedación y movilidad temprana; en resumen, una UCI despierta y ambulante.