Introducción
Las infecciones fúngicas invasivas (IFI) son una causa importante de morbilidad y mortalidad en los receptores de trasplante alogénico de células progenitoras hematopoyéticas (Alo-TCPH). La mortalidad en pacientes con IFI puede llegar hasta el 50% en algunas series (1-3). Los patógenos que más frecuentemente pueden generar una IFI son Cándida spp. en el período pos-Alo-TCPH inmediato y, más alejados en el tiempo, los hongos filamentosos. Dentro de estos últimos, ocupa el primer lugar Aspergillus spp., con capacidad de generar enfermedad invasiva con alta morbilidad y mortalidad, seguido por los Mucorales y Fusarium spp.1.
Los períodos de mayor riesgo de IFI son el período pre-engraftment, caracterizado por la neutropenia profunda; el período post-engraftment temprano, antes de la reconstitución de células T y con mayor riesgo de enfermedad injerto contra huésped (EICH) aguda; y finalmente el período post-engraftment tardío, asociado a la posibilidad de EICH crónica4.
Durante los períodos pre-engraftment y post-engraftment temprano, el riesgo de infecciones por Cándida spp. es más alto, mientras que el riesgo de infecciones por Aspergillus spp. se extiende desde el período pre-engraftment hasta el período post-engraftment tardío debido a la posibilidad de EICH crónica2. La incidencia de aspergilosis invasiva (AI) varía según distintas latitudes, llegando hasta el 23% en pacientes receptores de Alo-TCPH1–5.
Los factores de riesgo de AI en receptores de Alo-TCPH incluyen la enfermedad subyacente (como síndromes mielodisplásicos o leucemia mieloide aguda), daño de las mucosas, neutropenia prolongada y profunda, EICH, reactivación del Citomegalovirus (CMV) y el uso de fármacos inmunosupresores. La exposición ambiental a esporas es un factor importante a considerar, especialmente en contextos de construcción3,4,6–11.
En nuestro medio, las dos estrategias de profilaxis anti fúngica más frecuentemente utilizadas en pacientes de alto riesgo son la terapia preventiva con fluconazol, un azol sin acción frente a hongos filamentosos, que se asocia a la dosificación semanal o bisemanal de galactomanano sérico para la detección temprana de infecciones, y la profilaxis con azoles que tienen cobertura frente a hongos filamentosos. Dentro de esta última, si bien el posaconazol tiene mayor evidencia como profilaxis primaria en pacientes de alto riesgo, el voriconazol constituye una alternativa válida4–8.
Entre los años 2018 y 2020, en nuestro centro se registró un caso de galactomanano sérico positivo sin que se detectaran casos de aspergilosis pulmonar invasiva (API). No obstante, durante 2021 y principios de 2022, se observaron tres casos de galactomanano positivo y un caso confirmado de API. En respuesta a esta situación, a partir de 2022 se implementó una estrategia de profilaxis primaria con voriconazol.
A dos años de la implementación de la nueva estrategia de prevención para infecciones fúngicas invasoras (IFI), este estudio tiene como objetivo describir la experiencia de nuestro centro con el uso de voriconazol como profilaxis en los primeros 70 días postrasplante alogénico de progenitores hematopoyéticos (Alo-TCPH). El enfoque está en evaluar la prevalencia de IFI, la tolerancia al voriconazol y los efectos adversos asociados a su uso.
Materiales y método
Criterios de inclusión:
Pacientes mayores de 18 años que recibieron Alo-TCPH durante el periodo de estudio.
Criterios de exclusión:
Pacientes mayores de 18 años que recibieran Alo-TCPH durante el periodo y que no hubieran recibido voriconazol como profilaxis.
Se diseñó una base de datos ad hoc utilizando el software estadístico SPSS 21.0.
Variables:
Edad, sexo, enfermedad que determinó el trasplante, plan de acondicionamiento, estrategias de prevención para infección fúngica invasiva, resultados de galactomananos séricos y/o del lavado bronquioalveolar, infecciones fúngicas diagnosticadas durante el ingreso y hasta los 70 días post Alo-TCPH, tratamiento antifúngico administrado (dosis, vías, fármacos), dosificación de voriconazol, tolerancia al voriconazol, efectos adversos a los antifúngicos y sobrevida a los 70 días.
Estrategias de prevención para infección fúngica invasiva según periodo histórico:
Hasta 2021: Terapia preventiva con fluconazol 200 mg VO cada 12 horas asociado a galactomanano (GMN) sérico semanal.
2022-2024: Voriconazol 200 mg VO cada 12 horas con medición de voriconazol en sangre. Mientras el rango terapéutico no fuera alcanzado, se mantenía la realización de galactomanano sérico semanal.
La duración de la profilaxis es hasta el día +70 si el paciente no agrega factores de riesgo que hagan prolongarla (ej. EICH) con necesidad de uso de esteroides.
Para los pacientes con alteración del hepatograma y contraindicación para el uso de azoles, se indica profilaxis con caspofungina, administrando una dosis de carga de 70 mg intravenosos (IV) seguida de 50 mg IV diarios.
En cuanto a los inmunosupresores, se utiliza ciclosporina en la totalidad de los pacientes con inicio de descenso de dosis al día +90 y suspensión al día +180 siempre y cuando no se constataran elementos de EICH o previo a esto en caso de toxicidad o decisión del médico tratante.
Definiciones:
Infección fúngica invasiva (IFI): Aparición de signos y síntomas clínicos sugestivos asociados a hallazgos micológicos o características imagenológicas atribuibles.
Aspergilosis pulmonar invasiva (API) probable: Presencia de signos clínicos e imágenes pulmonares sugestivas de infección por Aspergillus, cultivos microbiológicos y galactomanano positivo según las guías ESCMID-ECMM-ERS5.
Antígeno de galactomanano (AGM): Los puntos de corte para definir positividad de las pruebas fueron índices > 0,5 en suero y > 1,0 en líquido bronquio alveolar (LBA)7.
Niveles de voriconazol en sangre objetivo: en profilaxis rango mayor a 0,5 mg/L8. Mayor a 5 mg/L se considera por encima del rango, con riesgo de toxicidad8. La primera monitorización se realiza a los 5 días desde su inicio.
Resultados
Durante el periodo de estudio, 19 pacientes recibieron un trasplante alogénico de células progenitoras hematopoyéticas (Alo-TCPH). De estos, dos pacientes fueron excluidos del análisis: uno por haber recibido profilaxis para infección fúngica invasiva (IFI) con caspofungina debido a alteración del hepatograma y otro por haber recibido fluconazol. Por lo tanto, la población del estudio consistió en 17 pacientes con una edad mediana de 57 años (rango intercuartílico 38-51 años).
De los 17 pacientes, el 70,6% (12 pacientes) eran de sexo masculino y el 29,4% (5 pacientes) eran mujeres. La mayoría de los trasplantes fueron de HLA idéntico emparentado (70,6%) y se utilizó principalmente un régimen mieloablativo (70,6%). Las patologías de base más comunes fueron la leucemia mieloide aguda (LAM) en el 58,8% de los casos y el síndrome mielodisplásico (SMD) en el 11,7%. El 23,5% de los pacientes tenía diabetes mellitus como comorbilidad. El resto de las características se describen en la Tabla 1.
Tabla 1. Características generales de receptores Alo-TCPH. 2022-2024, Hospital Británico, Montevideo, Uruguay.
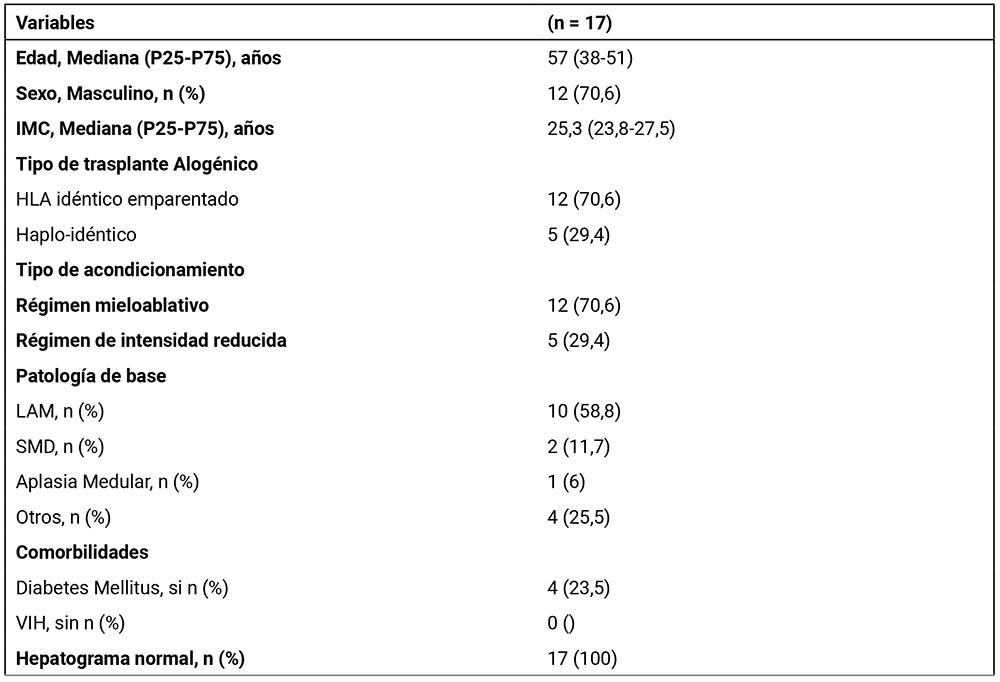
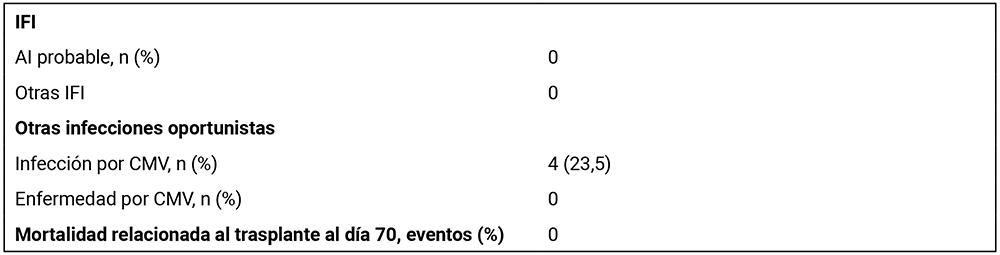
AI: Aspergilosis Invasiva, GMN: Galactomanano, IFI: Infección fúngica invasiva, LAM: Leucemia Mieloide aguda, SMD: Síndrome Mielodisplásico. VIH: Virus inmunodeficiencia humana, CMV Citomegalovirus.
Durante el periodo del estudio, no se registraron casos de aspergilosis invasiva (AI) ni de otras IFI en los pacientes que recibieron profilaxis con voriconazol.
No se presentaron muertes en la población estudiada durante el periodo de seguimiento.
En cuanto a la tolerancia al voriconazol en los receptores de Alo-TCPH, de los 17 pacientes que recibieron este fármaco, todos los pacientes (100%) mostraron una buena tolerancia al voriconazol sin reportes de efectos adversos vinculados al mismo.
En cuanto a la dosificación, el 76,5% (13 pacientes) lograron mantener niveles terapéuticos adecuados de voriconazol, mientras que el 23,5% (4 pacientes) presentaron niveles por debajo del rango terapéutico. No se identificó una relación entre los niveles inadecuados de voriconazol y el índice de masa corporal (IMC) de los pacientes, la edad o el sexo. En todos los casos, se adecuó la dosificación de voriconazol y se alcanzaron niveles dentro del rango objetivo. Ningún paciente presentó dosificación de voriconazol superior al rango objetivo. Datos registrados en la Tabla 2.
Tabla 2. Tolerancia al voriconazol en receptores Alo-TCPH. Primeros 70 días. Periodo 2022-2024, Hospital Británico, Montevideo, Uruguay.

°Se considera buena tolerancia si no hay efectos secundarios adversos que requieran la suspensión o ajuste del fármaco.
En un caso debió suspenderse el voriconazol luego del día +50 por alteración del hepatograma vinculado a otra patología que cursaba el paciente y no por planteo de toxicidad secundaria a este fármaco.
El conjunto de datos que apoya los resultados de este estudio no se encuentran disponibles.
Discusión
El hallazgo más relevante de nuestro estudio fue la ausencia de casos de aspergilosis pulmonar invasiva (API) y otras infecciones fúngicas invasivas (IFI) en los pacientes que recibieron profilaxis con voriconazol. Estos resultados coinciden con lo reportado por Marks et al. y otros autores, quienes indican que la eficacia clínica del voriconazol es comparable a la de otros agentes antifúngicos y, en general, es bien tolerado cuando se dosifican adecuadamente los niveles del mismo12.
La tolerancia al voriconazol en nuestra cohorte fue muy buena, ya que no se reportaron eventos adversos. Esto se debe, en gran medida, a que en todos los casos se mantuvo un control estricto de los niveles de voriconazol en los pacientes, sin observarse dosificaciones por encima del rango deseado. Esto está en concordancia con lo publicado por otros autores, quienes subrayaron la importancia de la monitorización terapéutica para optimizar la dosificación y evitar la toxicidad15.
La monitorización de los niveles de voriconazol resulta crucial dada la variabilidad entre pacientes. En nuestra cohorte, el 23,5% de los pacientes presentaron valores por debajo del rango objetivo. Esto ha sido reportado por varios autores, como Trifilio et al. quienes demostraron que las dosis de voriconazol generaban niveles variables del fármaco en sangre13, y Brüggemann et al. quienes reportaron que el ajuste de la dosificación basado en la monitorización de niveles séricos mejora los resultados clínicos en pacientes tratados con voriconazol14.
La variabilidad en los niveles de voriconazol entre individuos puede ser considerable debido a diferencias en la absorción, metabolismo y eliminación del fármaco13–17,19. En nuestra población de estudio, no se identificaron factores específicos dentro de las variables estudiadas, como el IMC, la edad o el sexo, que pudieran explicar esta variabilidad en los niveles subóptimos de voriconazol. Dado que el voriconazol es un inhibidor potente de las enzimas CYP2C19, CYP2C9 y CYP3A4, es esencial tener en cuenta las posibles interacciones farmacológicas, especialmente con inmunosupresores como la ciclosporina, que se utilizan frecuentemente en receptores de trasplante Alo-TCPH15. Por lo tanto, la monitorización terapéutica de los niveles de voriconazol es fundamental para garantizar que los pacientes alcancen concentraciones séricas efectivas sin superar los límites de toxicidad.
Si bien nuestro estudio cuenta con claras limitaciones, como el tamaño reducido de la muestra y el ser un estudio de un único centro, refleja nuestra realidad. Los hallazgos son especialmente relevantes para el contexto específico de Uruguay. Nuestros resultados sugieren que la transición de fluconazol a voriconazol en nuestro centro fue una conducta adecuada.















