Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.20 no.2 Montevideo 2005
Bases anatómicas de la fibrilación atrial.
Estudio descriptivo de la extensión de músculo cardiaco atrial hacia la vena cava superior.
Sebastián Laza (1), Álvaro Rivara (2,3), Nicolás Casales (4), Marie Poumayrac (4), María Vergara (1), Pablo Pereira (4), Diego Freire (5), Beatriz Villar (6), Angela Cirilo(7), Guillermo Carriquiry (8), Victor Soria (9), Ricardo Lluberas (10).
(1) Asistente del Departamento de Anatomía. Correspondencia: Dr. Sebastián Laza. Departamento de Anatomía, Facultad de Medicina. Avda. Gral Flores 2125 esquina Yatay, Montevideo, Uruguay. Correo electrónico: slaza@fmed.edu.uy
Dirección particular: Rbla Rep de Mexico 5855. Montevideo, Uruguay.
(2) Ex. Asistente del Departamento de Cardiología.
(3) Médico colaborador honorario del Departamento de Cardiología.
(4) Ayudante de Clase del Departamento de Anatomía.
(5) Profesor Adjunto de Elecrofisiología del Departamento de Cardiología.
(6) Asistente del Dapartamento de Histología.
(7) Profesor Agregado del Departamento de Histología.
(8) Profesor Agregado del Departamento de Anatomía.
(9) Profesor Director del Departamento de Anatomía.
(10) Profesor Director del Departamento de Cardiología.
Departamento de Anatomía de la Facultad de Medicina de Montevideo, Uruguay.
Departamento de Histología de la Facultad de Medicina de Montevideo, Uruguay.
Departamento de Cardiología de la Facultad de Medicina de Montevideo, Uruguay.
RESUMENIntroducción: La fibrilación atrial (FA) puede originarse en la vena cava superior (VCS), desde el músculo cardíaco (MC) proveniente de la aurícula derecha (AD).
Objetivo: Descripción anátomo-histológica de dicho MC, sus relaciones e implicancias clínicas.
Material y métodos: Mediante disección de material cadavérico (n=43) y análisis histológico, se estudió la presencia y extensión de MC desde la AD hacia la VCS, dirección, disposición, distribución, altura total y por cuadrantes del MC y la unión venoatrial.
Resultados: Todas las piezas presentaron MC en su pared, con 2 (63%), 3 (15,8%) o 4 (10,5%) vías de entrada provenientes de la cara lateral de la AD y orejuela derecha, ubicadas por frecuencia en los sectores anteroizquierdo, anteroderecho, posteroizquierdo y posteroderecho; las vinculadas al sector anteroderecho están en estrecha relación con el nervio frénico derecho y el nodo sinusal. La dirección fue ascendente en su cara anterior de derecha a izquierda, y descendente por su cara posterior de izquierda a derecha. La altura máxima se alcanzó en el cuadrante anteroizquierdo (15 a 56 mm, promedio 46 mm). Su distribución tuvo 2 patrones: continuo en 9,4% y fenestrado en 90,6%.
Conclusiones: La extensión de MC de AD a VCS constituye un hecho constante, con orientación precisa, vías de entrada a predominio de los cuadrantes anteriores, y un patrón de distribución a modo de envoltura oblicua en la VCS, con máxima altura en los cuadrantes izquierdos. Las relaciones más relevantes se vinculan al nervio frénico y nodo sinusal.
SUMMARY
Introduction: Atrial fibrillation can be triggered from myocardial sleeves present in superior vena cava coming from the right atrium.
Purpose: Anatomic and histologic description of myocardial sleeves, main relationships and clinical implications for catheter ablation.
Methods: Fourty-three human hearts were examined by dissection and histological analysis. Superior cavoatrial junction and presence, extension, disposition, distribution and maximum highness of myocardial sleeves in SVC were studied by quadrants. Results: All studied specimens showed myocardial extensions from right atrium to SVC. Myocardial breakthroughs (MB) were studied in 19 cases. 2 MB were found in 63%, 3 in 15,8% and 4 in 10,5% of the cases, coming from the high lateral right atrium and right atrial appendage, and located by frequency in the left anterior, right anterior, left posterior and right posterior quadrants of the cavoatrial junction. Those located in the right anterior quadrant were in close relationship with the right phrenic nerve and the sinus node. Direction of myocardial sleeves was oblique, ascending from right to left, and descending through the posterior quadrants of the vein. Maximum highness was reached in the left anterior quadrant (15 to 56 mm, average 46 mm). Two patterns of distribution were observed: continuous in 9,4% and fenestrated in 90,6%.
Conclusions: The extension of myocardial sleeves from right atrium to SVC is a constant fact, with homogeneous distribution, wrapping SVC around obliquely and reaching its maximum in the left quadrants of the vein. Myocardial breakthroughs were located mainly in the anterior quadrants of the cavoatrial junction. Their main relationships were established with the right phrenic nerve and sinus node.
PALABRAS CLAVES
FIBRILACIÓN ATRIAL ATRIAL FIBRILLATION
VENA CAVA SUPERIOR VENA CAVA, SUPERIOR
INTRODUCCIÓN
El origen de la FA desde las venas torácicas es un hecho demostrado (1,2). La fuente principal son las venas pulmonares, seguidas en frecuencia por la VCS que da cuenta de un tercio de los focos extrapulmonares (3,4). La ablación por radiofrecuencia ha posibilitado la eliminación de dicha arritmia originada en este grueso vaso mediante desconexión eléctrica a nivel de la unión venoatrial o ablación de los focos gatillo dentro de la VCS (4,5). Los estudios anatómicos que han descrito la presencia de MC en la VCS como sustrato para su arritmogénesis se han limitado a la descripción histológica, no encontrando en la literatura una descripción macroscópica acabada ni la descripción de la unión cavoatrial (6,7). Las relaciones de dicha unión en cuanto a estructuras relevantes del punto de vista electrofisiológico como el nervio frénico y el nodo sinusal han sido insuficientemente estudiadas. Debido a las implicancias del tratamiento curativo de la FA originada en VCS el objetivo de este estudio es la descripción morfológica macro y microscópica de las extensiones del músculo atrial desde la AD hacia la VCS y de la unión cavoatrial superior y sus relaciones.
MATERIAL Y MÉTODO
Se obtuvieron por toracotomía los bloques cardiopulmonares de 43 cadáveres fijados, 9 de sexo femenino y 34 de sexo masculino con edades comprendidas entre los 49 y los 72 años, promedio 60,5 ± 11. La solución fijadora utilizada constó de agua como solvente y formaldehído y nitrato de potasio, como principales solutos, la cual se inyectó por vía femoral sin exanguinación o manipulación previa del cadáver.
La disección se realizó en dos tiempos; uno macroscópico donde se realizó la extracción del bloque cardiopulmonar mediante una toracotomía por esternotomía y sección de los paquetes vasculonerviosos del cuello, sector proximal de la tráquea, aorta descendente, vena cava inferior y ligamentos pericárdicos. Obtenidos los bloques se pasó al tiempo de disección bajo microscopio donde se practicó una pericardiotomía anterior sobre la vena cava superior y aurícula derecha, reperando las tres hojas del pericardio que fueron seccionadas individualmente, reconociendo la reflexión del pericardio seroso y la continuidad adventicial del fibroso.
De esta manera se accedió a la superficie subepicárdica de la VCS y bajo microscopio se observó al músculo atrial y su comportamiento sobre la unión cavoatrial superior.
Se marcó el límite inferior de la VCS, tomando como reper al ángulo formado entre la VCS y la AD que se corresponde endocavitariamente con el espolón formado entre la orejuela derecha y la VCS. A los efectos de recolectar los datos se dividió a la VCS en cuadrantes; dos anteriores y dos posteriores, derechos e izquierdos respectivamente en los cuales se tomaron las medidas correspondientes a las alturas máximas y mínimas adquiridas por el músculo en cada cuadrante. (Figura 1)
Además se registró el patrón de distribución que el MC tuvo en la pared de la VCS y se observó la orientación y la disposición de las fibras.
En 19 casos se estudiaron las vías de entrada hacia la VCS en número y topografía. Se definió como vía(s) de entrada a la(s) banda(s) de MC que se proyectaron desde la AD hacia la VCS cruzando la unión venoatrial para luego distribuirse en la pared de la VCS.
En 32 casos se estudiaron las relaciones de la VCS y la unión venoatrial con el nodo sinusal y el nervio frénico. El nodo sinusal se identificó mediante la visualización de la penetración de la arteria del nodo en dicha estructura, por su color más pálido y por su consistencia más firme que el miocardio circundante.
Se realizaron cortes longitudinales y transversales de 10 micras de espesor, en la unión venoatrial y en la VCS a 1 cm y 2 cm de la unión venoatrial, a los cuales se los tiñó con tres técnicas: tricrómico de Cajal Gallegos (diferencia selectivamente las fibras colágenas del tejido muscular), hematoxilina fosfotúngstica (detalla las características del tejido muscular) y hematoxilina eosina (técnica de rutina).
RESULTADOS
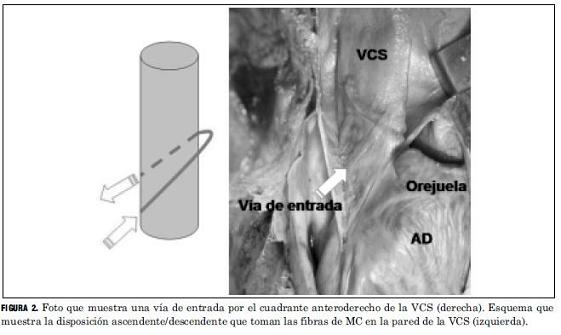
Se encontró MC atrial en la VCS en todas las piezas estudiadas (100%). La dirección de las fibras fue en forma constante ascendente y oblicua de derecha a izquierda en los cuadrantes anteriores, alcanzando su acmé en la unión de los cuadrantes izquierdos, para luego descender oblicuamente de izquierda a derecha por la cara posterior de la VCS, formando un patrón de envoltura circunferencial oblicuo (Figura 2).
La mayor altura por cuadrante correspondió a los cuadrantes izquierdos, con un máximo de 56 mm (Gráfico 1).
AD: anteroderecho, AI: anteroizquierdo, PD: posteroderecho, PI: posteroizquierdo.
En la pared de la VCS, las fibras adoptaron un patrón discontinuo y fenestrado, con interconexiones complejas en 39 de los 43 casos (90,6%) (Figura 3 y 4). En 4 casos (9,4%) el patrón de distribución fue continuo, a modo de banda muscular, correspondiendo a las venas de menor diámetro (Figura 4). Los datos descritos se resumen en la Tabla 1.
A nivel de la unión cavoatrial, las vías de entrada estuvieron presentes en 19 de los 19 casos estudiados (100%), en número de 2 en 12 casos (63,15%), 3 en 5 casos (26,31%) y 4 en 2 casos (10,52%), y mostraron que la zona de mayor densidad de conexiones son los
cuadrantes anteriores (Figuras 1 y 2). En todos los casos (19) hubo una entrada en el cuadrante anteroizquierdo, en 16 de 19 casos (84%) hubo una entrada en el cuadrante anteroderecho, en 10 casos (52,63%) en el posteroizquierdo y 2 (10,5%) en el posteroderecho.
La histología reveló que las fibras que ingresan a la VCS provenientes de la AD están constituidas por MC estriado, y que se ubican en el espacio periadventicial de la VCS, adoptando una disposición compleja, con fibras longitudinales, transversales y oblicuas al eje mayor de la VCS, sobretodo en las piezas que presentaron una patrón fenestrado del MC. Los espacios intermusculares estuvieron constituidos por tejido fibrograso. (Figura 5).
El nervio frénico se ubicó pasando por delante del cuadrante anteroderecho en su porción más lateral en 26 de 32 casos estudiados (81,25%) y por el cuadrante posteroderecho en 6 de los 32 casos (18,75%) (Figura 6).
El nodo sinusal se logró identificar bajo magnificación óptica 10X en 17 de 32 casos estudiados (53,12%) y se ubicó 6 de 17 (35,29%) en la pared de la VCS, 8 de 17 (47,05%) sobre la unión venoatrial y 3 de 17 (17,64%) en la pared de la AD. En todos los casos se encontró en los cuadrantes posteriores, en 13 casos (76,47%) sobre el posteroderecho y en 4 casos (23,53%) sobre el posteroizquierdo (Figura 7).
DISCUSIÓN
La FA puede originarse del MC presente en distintas venas torácicas, principalmente las venas pulmonares y esto ha abierto las puertas a nuevas posibilidades terapéuticas. Desde el siglo XIX se conoce la existencia de MC en dichas venas (8), y en primera instancia, le fueron atribuidas funciones hemodinámicas (9). Los estudios morfológicos han descrito la arquitectura de las venas pulmonares en cuanto a presencia y extensión de MC y su comparación en pacientes con y sin FA, observando gran variabilidad y una disposición compleja que podría favorecer la conducción anisotrópica y aparición de arritmias (10, 11)
Al igual que para las venas pulmonares, estudios anatómicos de la VCS han demostrado la presencia de MC en su pared que se extiende desde la AD y se ha documentado el origen de la FA desde la VCS (3,4) . Asimismo han sido descritas del punto de vista histológico la presencia y características de las fibras miocárdicas en la VCS (6,7); sin embargo la unión venoatrial y el análisis macroscópico no fueron detallados.
COMPARACIÓN CON ESTUDIOS PREVIOS
Las investigaciones morfológicas de la VCS han sido realizadas solamente desde el punto de vista histológico, contando la primera solamente con dos casos y atribuyéndole al MC funciones de tipo hemodinámico (6). El segundo estudio también fue histológico y dejó de lado en forma expresa la descripción de la unión venoatrial y sus relaciones (7).
Nuestro estudio describe del punto de vista morfológico la unión cavoatrial superior y las extensiones de MC de la AD hacia la VCS macro y microscópicamente. En nuestro conocimiento de la literatura indexada no existe un estudio semejante en humanos y de los estudios morfológicos que han descrito la presencia de MC en la VCS el actual estudio posee la mayor serie hasta el momento.
Los resultados de nuestro estudio ponen de manifiesto que la presencia de MC atrial en la VCS es un hecho constante, presente en todos los casos analizados, localizados en el espacio periadventicial de la VCS, con una altura que varió entre 15 y 56 mm. El patrón de distribución fue fenestrado y discontinuo en la gran mayoría de los casos, y su dirección oblicua ascendente / descendente. Las entradas de MC se localizaron mayoritariamente en sus cuadrantes anteriores, en número de 2 a 4, con presencia constante de un contingente de fibras musculares que proviene de la orejuela derecha. Otro contingente importante proviene de la cara lateral de la AD penetrando la VCS en su sector lateral derecho, y se encuentra en relación cercana con el nervio frénico derecho y el nodo sinusal. La identificación del nodo sinusal se puede ver limitada en los cadáveres más jóvenes y en los que no presentan infiltración grasa en el sector epicárdico del mismo (12, 13).
Nuestros hallazgos coinciden con la literatura mundial en cuanto a la existencia de MC en VCS, pero difieren en cuanto a la prevalencia y extensión de dicho MC. Los hallazgos descritos por otros autores marcan la existencia del MC en VCS como un hecho frecuente pero no constante y no hacen referencia a la unión cavoatrial (7).
Estas diferencias pueden obedecer a que los estudios anteriores no contaron con disecciones macroscópicas, y los cortes de 10 micras que fueron practicados en la investigación histológica son muy útiles en la definición de estructuras pero son parcos en su topografía, la cual se reduce al tamaño del corte.
Por otro lado las investigaciones macroscópicas en material cadavérico sin fijar presentan dificultades para reconocer al músculo atrial ya que su color presenta menos diferencias con el entorno respecto al material fijado. Las sales de potasio utilizadas en nuestro estudio son un componente habitual de las soluciones fijadoras y le imprimen un color pardo al músculo para diferenciarlo claramente del resto de los tejidos adyacentes. El material cadavérico fresco presenta retracciones inhomogéneas de sus diferentes tejidos cuando son seccionados. Esto podría distorsionar la arquitectura tisular, lo que sin embargo es preservado en el material fijado previamente a la extracción.
Un hecho original es el estudio y descripción de las vías de entrada del músculo auricular hacia la pared de la VCS, y la disposición que adopta el mismo. Se destaca en la unión cavoatrial la presencia de 2 a 4 vías de entrada, localizadas sobretodo en los cuadrantes anteriores, provenientes de la cara lateral de la AD y de la orejuela derecha. El contingente de fibras que alcanzan la VCS desde la cara lateral de la AD se encuentra en estrecha relación con el nervio frénico y con el nodo sinusal en su entrada a la pared de la VCS.
IMPLICANCIAS PARA LA ABLACIÓN POR RADIOFRECUENCIA
La ablación de la FA se ha convertido en un recurso terapéutico de valor inestimable en los últimos años. Clínicamente ha sido demostrada su curación mediante la desconexión eléctrica de la VCS de la AD y/o la ablación de los focos ectópicos dentro de la VCS (3, 4,5). Varios estudios han demostrado la importancia de la actividad ectópica como desencadenante de FA en sitios fuera de las venas pulmonares, con una incidencia del 20 al 35% de los casos. Dentro de ellos (pared posterior de aurícula izquierda, ligamento de Marshall, crista terminalis, septum interatrial, seno coronario y VCS) la VCS es responsable de 1/3 de los casos oscilando entre un 7 a 12 % del total (4, 14)
Nuestros hallazgos ponen de relevancia la importancia de la unión cavoatrial superior y la demostración de la existencia de MC como un hecho constante.
La descripción de las vías de entrada del MC a la VCS y su relación con el nervio frénico y nodo sinusal puede permitir un mejor mapeo de la unión cavoatrial para lograr una desconexión eléctrica efectiva y elaborar estrategias durante el tratamiento que permitan eludir al nervio frénico y al nodo sinusal, elementos con una cercana relación anatómica, cuya lesión está descrita y por demás indeseable (15, 16).
La extensión en altura del MC registrada en nuestro estudio posee una llamativa correlación eléctrica en cuanto a la altura hasta la cual se han registrado los potenciales eléctricos dentro de la VCS. Nuestro grupo ha documentado la actividad eléctrica y la extensión de la misma dentro de la VCS (4, 17).
La topografía de entrada del MC del punto de vista anatómico posee diferencias con lo referido en la literatura desde el punto de vista eléctrico, ya que los autores dividieron a la VCS en distintos cuadrantes: anterior, lateral, posterior y septal (5).
La disposición de las fibras que adoptan una configuración fenestrada y su compleja interrelación podría explicar las características complejas de la actividad eléctrica en la VCS, la heterogeneidad de los registros y la conducción anisotrópica documentada por otros autores, posibilitando la aparición de circuitos de reentrada (18).
La apreciación macroscópica del nodo sinusal en un porcentaje importante de los casos es un hecho destacable sobretodo teniendo en cuenta las dificultades de su visualización descrita por otros autores y de su análisis histológico debido a la falta de marcadores inmunohistoquímicos específicos que delimiten y definan al sistema cardionector en el hombre (19,). La topografía del mismo en relación directa a la VCS es otro hallazgo a destacar, lo cual puede tener implicancias en la ablación del mismo en pacientes con arritmias originadas en esta encrucijada anátomo-eléctrica.. Este hecho confirma del punto de vista anatómico los hallazgos del punto de vista electrofisiológico que documentan en algunos pacientes el origen del ritmo sinusal en la VCS (20).
LIMITACIONES DEL ESTUDIO
No se dispuso de historia clínica previa del material cadavérico usado, desconociendo la posible existencia de cardiopatía previa y FA. Las medidas realizadas en material cadavérico pueden ser afectadas por dilatación posmortem y alteradas por la solución fijadora, limitaciones propias de todos los estudios de esta naturaleza. No fue posible identificar macroscópicamente el nodo sinusal en todos los casos.
CONCLUSIONES
El presente estudio descriptivo demuestra la presencia constante de las extensiones de MC atrial hacia la VCS, su dirección y patrón de distribución. Otras observaciones originales importantes con implicancias para la ablación son la descripción de la unión cavoatrial superior con las vías de entrada del MC a la VCS localizadas predominantemente en su cara anterior, y las relaciones que guardan con estructuras nobles como el nervio frénico y nodo sinusal. De este último se destaca su observación macroscópica, su relación anatómica con la unión cavoatrial y su ubicación dentro de la VCS en un porcentaje no despreciable de los casos.
BIBLIOGRAFÍA
1. Haissaguerre M, Jais P, Shah DC, Takahashi A, Hocini M, Quimiou G, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659–666.2. Chen SA, Hsieh MH, Tai CT, Tsai CF, Prakash VS, Yu WC, et al. Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation. Circulation 1999; 100: 1879–1886.
3. Lin WS, Tai CT, Hsieh MH, Tsai CF, Lin YK, Tsao HM, et al. Catheter Ablation of Paroxysmal Atrial Fibrillation Initiated by Non–Pulmonary Vein Ectopy. Circulation 2003; 107: 3176-3183.
4. Tsai CF, Tai CT, Hsieh MH, Lin WS, Yu WC, Ueng KC, et al. Initiation of Atrial Fibrillation by Ectopic Beats Originating From the Superior Vena Cava. Electrophysiological Characteristics and Results of Radiofrequency Ablation. Circulation 2000; 102: 67-74.
5. Goya M, Ouyang F, Ernst S, Volkmer M, Antz M, Kuck KH. Electroanatomic Mapping and Catheter Ablation of Breakthroughs From the Right Atrium to the Superior Vena Cava in Patients With Atrial Fibrillation. Circulation 2002; 106: 1317-1320.
6. Kholová I, Kautzner J. Morphology of Atrial Myocardial Extensions Into Human Caval Veins. A Postmortem Study in Patients With and Without Atrial Fibrillation. Circulation 2004; 110: 483-488.
7. Hashizume H, Ushiki T, Abe K. A histological study of the cardiac muscle of the human superior and inferior venae cavae. Arch Histol Cytol 1995; 58: 457–464.
8. Rauschel F. De Arteriarum et Venarum Structura. Breslau, 1836.
9. Nathan H, Eliakim M. The junction between the left atrium and the pulmonary veins. An anantomic study of human hearts. Circulation 1966; 34: 412-422.
10. Ho SY, Cabrera JA, Tran VH, Farré J, Anderson RH, Sánchez-Quintana D. Architecture of the pulmonary veins: relevance to radiofrequency ablation. Heart 2001; 86:265-270.
11. Tagawa M, Higuchi K, Chinushi M, Washizuka T, Ushiki T, Ishihara N et al. Myocardium Extending from the Left Atrium onto the Pulmonary Veins: A Comparison Between Subjects with and Without Atrial Fibrillation. PACE 2001; 24:1459–1463.
12. Chiu IS, Hung CR, How SW, Chen MR. Is the sinus node visible grossly? A histological study of normal hearts. Int J Cardiol 1989; 22: 83-87.
13. He BM, Tan YX, Cheng M, Cui YQ. The surgical anatomy of the sinoatrial node. Surg Radiol Anat 1991;13: 123-128.
14. Chen SA, Tai CT. Catheter ablation of atrial fibrillation originating from the non-pulmonary vein foci. J Cardiovasc Electrophysiol 2005; 16: 229-232.
15. Durante-Mangoni E, Del Vecchio D, Ruggiero G. Right diaphragm paralysis following cardiac radiofrequency catheter ablation for inappropriate sinus tachycardia. PACE 2003; 26:783-784.
16. Sánchez-Quintana D, Cabrera JA, Farré J, Climent V, Anderson R H, Ho SY. Sinus node revisited in the era of electroanatomical mapping and catheter ablation. Heart 2005; 91:189–194.
17. Rivara A, Freire D, Acuña J, Lujambio M, Lluberas R, Escobar N et al. Comparación de las características electrofisiológicas de la vena cava superior en pacientes con y sin fibrilación atrial. Estudio prospectivo. XX Congreso Uruguayo de Cardiología. Montevideo, 2004.
18. Shah DC, Haïssaguerre M, Jaïs P, Clémenty J. High-Resolution Mapping of Tachycardia Originating from Superior Vena Cava: Evidence of Electrical Heterogeneity, Slow Conduction, and Possible Circus Movement Reentry. J Cardiovasc Electrophysiol 2002; 13: 388-392.
19. Sánchez-Quintana D, Ho SY. Anatomía de los nodos cardíacos y del sistema de conducción específico auriculoventricular. Rev Esp Cardiol 2003; 56: 1085-1092.
20. Yuniadi Y, Tai CT, Lin YJ. Chen SA. Superior vena cava rhythm masquerading as normal sinus rhythm. J Cardiovasc Electrophysiol 2004; 15: 950-952.