Introducción
La congestión en pacientes con insuficiencia cardíaca (IC) representa una manifestación de diversos procesos estructurales y funcionales cardiovasculares concomitantes. Su fisiopatología sigue sin comprenderse por completo, en su mayoría se atribuye a retención de agua con la subsecuente acumulación de líquidos que desencadena expansión vascular y edema tisular1,2.
De hecho, la congestión es considerada la principal causa de ingreso a hospitalización y reingreso por IC (riesgo del 30% de rehospitalización por congestión residual), es el fenómeno fisiopatológico clave responsable en las manifestaciones clínicas (90%) y morbimortalidad asociada (10%)3. Su evaluación es tan compleja como crucial. Su tratamiento oportuno y eficaz pueden mejorar el pronóstico4(verfigura 1).
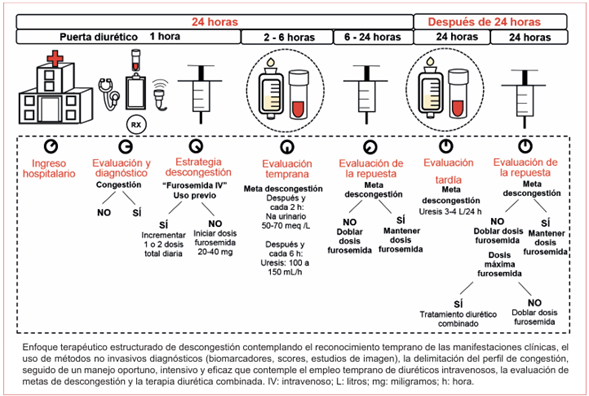
Figura 1 Algoritmo de uso de diuréticos en la insuficiencia cardíaca y evaluación de la respuesta descongestiva.
Durante las últimas décadas, producto de múltiples investigaciones y ensayos clínicos, se ha logrado un mayor entendimiento de los diversos eventos fisiopatológicos desencadenantes, modificando las diferentes estrategias diagnósticas y terapéuticas. Por lo tanto, es necesaria su frecuente revisión4. La presente analiza la evidencia actual desde una perspectiva integral, buscando contribuir en el entendimiento de la congestión, su evaluación y la optimización de su tratamiento a partir de la discusión de los diversos aspectos clínicos, fisiopatológicos y farmacológicos.
Discusión
La congestión en la IC se define como signos y síntomas de acumulación de líquido en el compartimento extracelular, que resultan en el aumento de las presiones de llenado cardíaco5,6. Su detección, evaluación y manejo deben considerarse una prioridad en el tratamiento de la IC aguda (ICA)7.
Clasificación de la congestión en insuficiencia cardíaca
La congestión en IC se puede dividir de formas diferentes, las cuales en su totalidad representan un continuo en el proceso de congestión. Según el inicio (aguda o crónica), distribución regional (sistémica o pulmonar), compartimento de distribución (intravascular o extravascular) y manifestación clínica (clínica o subclínica)2.
La congestión hemodinámica es una etapa silente preclínica sutil y difícil de detectar, condicionada por incremento de las presiones de llenado del ventrículo izquierdo (VI) acompañadas de sobrecarga de volumen, que puede ocurrir en ausencia de signos/síntomas clínicamente evidentes. La congestión clínica se refiere a la presencia de signos/síntomas relacionados con presiones de llenado intracardíacas elevadas o acumulación en el espacio extracelular de tal magnitud que el examen clínico la revela con facilidad2.
Acorde a su distribución, la congestión intravascular consiste en aumento del volumen plasmático total tras una reabsorción excesiva hidrosalina y redistribución compartimental, principalmente por venoconstricción esplácnica, que lleva a un aumento repentino de las presiones de llenado pulmonar y cardíaco. La congestión tisular indica un desbalance entre líquido intersticial y capilar, regido por la ecuación de Starling y otros factores, como la inestabilidad de glicosaminoglicanos en el intersticio, trastornos en el drenaje linfático y aumento de permeabilidad vascular. En conjunto, determinan la expansión de líquido intersticial, lo que genera edema periférico, derrame pleural y congestión de parénquimas (pulmonar, intestinal, hepático y renal)8.
La congestión sistémica reconoce la retención de líquidos como el mecanismo principal, caracterizada por un aumento progresivo del peso corporal, edema periférico, distensión yugular, hepatomegalia, ascitis y estasis venosa renal. La congestión pulmonar se caracteriza por empeoramiento de la disnea, estertores pulmonares y líneas B en la ecografía pulmonar9,10.
Fisiopatología de la congestión en la insuficiencia cardíaca
Los mecanismos subyacentes de la congestión en la IC son heterogéneos y poco conocidos, fisiológicamente las presiones de llenado cardíaco son el resultado integrado de la función cardíaca sistólica y diastólica, las circulaciones intravascular e intersticial-linfática (volumen plasmático, la capacitancia/distensibilidad venosa y drenaje linfático) y el funcionamiento renal (retención hidrosalina)6. La retención de líquido comienza en el compartimento intravascular, con el consiguiente incremento de las presiones hidrostáticas en los vasos capilares que conducen a la congestión del tejido, redistribución del volumen plasmático del compartimiento sistémico al pulmonar y venoso debido a cambios en la capacitancia de las venas esplácnicas principalmente11,12.
Diagnóstico
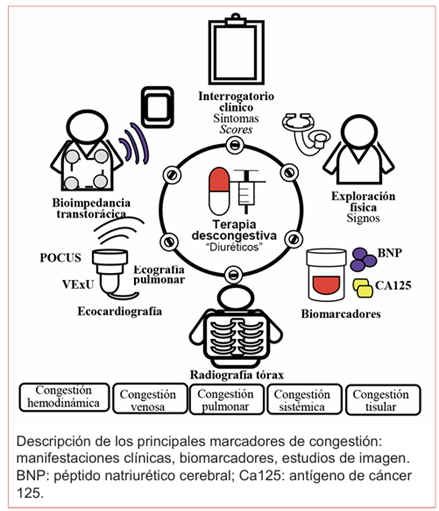
La evaluación de la congestión es uno de los principales desafíos en el tratamiento de la ICA, en la actualidad la monitorización clínica no invasiva es la principal herramienta que debería utilizarse en la práctica clínica (scores, biomarcadores, estudios de imagen)11,13(verfigura 2).
a. Manifestaciones clínicas: los tradicionales síntomas y signos, a pesar de su fácil obtención, suelen ser manifestaciones tardías de la congestión, esto ofrece sensibilidad y especificidad subóptima para el diagnóstico, junto con una rentabilidad limitada para la caracterización y cuantificación de su severidad5,13.
b. Scores clínicos en congestión: los puntajes de congestión clínica reconocen y estiman el grado de congestión. La mayoría son un compuesto de la gravedad de la ortopnea, ingurgitación yugular y estertores. Entre los principales scores se encuentran IC-BERG score y EVEREST score. Desafortunadamente, sufren también de tener sensibilidad y especificidad subóptima para el diagnóstico precoz12.
c. Estudios de imagen: la radiografía de tórax es una estrategia accesible, rápida y económica que evalúa la congestión pulmonar a partir del grado de hipertensión venocapilar. Se debe considerar que en un 15% de casos podría estar normal, a pesar de la presencia de congestión. Sin embargo, en pacientes con predominio de falla cardíaca derecha, la gran mayoría de los pacientes se presentarán sin datos de hipertensión venocapilar pulmonar13,14. La monitorización ecocardiográfica constituye una herramienta no invasiva valiosa en la evaluación de congestión pulmonar y sistémica, mediante el empleo de diferentes protocolos como POCUS (Point-of-Care) y VExUS (sistema de clasificación de la congestión venosa por ultrasonido) permite identificar y cuantificar el grado de congestión, al evaluar la distensión y colapso de la vena cava inferior, los patrones de flujo venoso renal, suprahepático y porta, ecografía pulmonar y estimar las presiones de llenado intracardíacas14.
d. Bioimpedancia transtorácica o cardiografía de impedancia torácica: es una evaluación no invasiva que determina el contenido de fluidos tisulares e indirectamente el grado de congestión intersticial. En ensayos clínicos ha demostrado reducción de la mortalidad y de las tasas de hospitalización por IC aguda (Impedance-HF)2,15.
e. Biomarcadores de congestión:
Péptidos natriuréticos: su liberación en la circulación es inducida por un aumento del estiramiento y de la presión de aurículas y ventrículos. Niveles circulantes elevados sugieren congestión intravascular y, por lo tanto, intracardíaca, sin embargo, el ensayo GUIDE IT no demostró beneficio como marcador para guiar la estrategia terapéutica.
Antígeno de cáncer 125 (CA125): es un marcador de congestión extravascular liberado por el tejido seroso (como el pericardio y la pleura) ante estímulos mecánicos y/o inflamatorios provocados por el edema. En el estudio CHANCE-HF, la terapia de descongestión guiada por CA125 < 35 U/ml redujo las rehospitalizaciones (IRR 0,49, IC 95%, p = 0,008), sin modificaciones en la mortalidad por todas las causas (16,6% vs. 18,1%; p = 0,689). Es interesante cómo el CA125 pudo disminuir las hospitalizaciones y el péptido natriurético no. Esto no significa que un biomarcador es superior al otro, sino que el actuar del médico con la información brindada por estos biomarcadores es lo que determina los resultados clínicos16.
f. Evaluación invasiva de congestión: tradicionalmente, se ha considerado que el estándar de oro para evaluar la congestión intravascular es medir la presión auricular derecha y la presión de la cuña capilar pulmonar (Pulmonary Capillary Wedge Pressure) mediante el cateterismo derecho; sin embargo, en el estudio ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness) su uso en el tratamiento de descongestión no demostró un beneficio sobre la evaluación clínica en días fuera del hospital (RR 1,00, IC 95%, p = 0,99) o mortalidad (10% vs. 9%, OR 1,26, IC 95%, p = 0,35)17. No obstante, el estudio ESCAPE sufrió de muchas debilidades sobre la mejor forma de utilizar la información brindada. Además, la mayoría de los pacientes tuvo el catéter de flotación pocos días, lo cual hace improbable creer que la mayor parte del tratamiento descongestivo estuvo verdaderamente guiado por la medición de presiones. Otro método invasivo disponible es el dispositivo CardioMEMS, el cual permite estimar el estado de volemia mediante la monitorización hemodinámica inalámbrica de la arteria pulmonar. De acuerdo con el ensayo CHAMPION (The CardioMEMS Heart Sensor Allows Monitoring of Pressure to Improve Outcomes in NYHA Class III Heart Failure Patients), este dispositivo reduce en un 28% las tasas de hospitalización en IC sintomática con reciente hospitalización (HR 0,72; IC 95%: 0,59 a 0,88; p = 0,0013). Sin embargo, estudios subsecuentes han mostrado que este dispositivo podría ser mejor en pacientes con IC y FEVI preservada18.
Tratamiento
El tratamiento temprano e intensivo de los pacientes con IC está asociado con tasas más bajas de reingreso temprano y mortalidad, situación reflejada en el concepto de tiempo de “puerta a diurético”. En el estudio REALITY-AHF (Registry Focused on Very Early Presentation and Treatment in Emergency Department of Acute Heart Failure) se observó que el tratamiento temprano con diuréticos de asa intravenosos (< 60 minutos) se asoció con una menor mortalidad hospitalaria (2,3% vs. 6,0%, p = 0,002 y un OR 0,39, IC 95%, p = 0,006). A pesar de ello, vale la pena mencionar que este estudio no prueba causalidad y es posible que la administración temprana de diuréticos más bien refleje un equipo médico con más experiencia en el diagnóstico y tratamiento de pacientes con IC; es decir que la administración temprana de diuréticos sería más bien un marcador de un tratamiento adecuado en lugar de un mediador de mejorías en el pronóstico19,20.
Las estrategias terapéuticas para controlar la congestión incluyen: diuréticos, vasodilatadores, ultrafiltración, antagonistas de la vasopresina, antagonistas de los receptores de mineralocorticoides (ARM) y, potencialmente, también terapias novedosas como secuestrantes intestinales y serelaxina21. Acorde al registro ADHERE (The Acute Decompensated Heart Failure National Registry), el 90% de los pacientes hospitalizados por IC reciben diuréticos intravenosos (IV)22,23(verfigura 3).
Objetivos de la terapia en la insuficiencia cardíaca aguda descompensada
El objetivo de la terapia en pacientes que presentan congestión es lograr un estado de euvolemia mediante una descongestión completa, asegurar presiones adecuadas que garanticen la perfusión de los órganos y mantener las terapias médicas dirigidas por las guías, ya que estos medicamentos también pueden aumentar la respuesta diurética y mejorar la supervivencia a largo plazo6(verfigura 4).
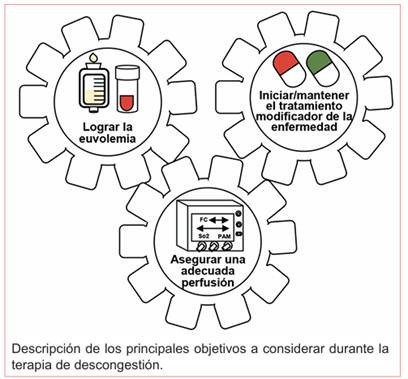
Figura 4 Objetivos durante el diagnóstico y manejo de la congestión en insuficiencia cardíaca aguda.
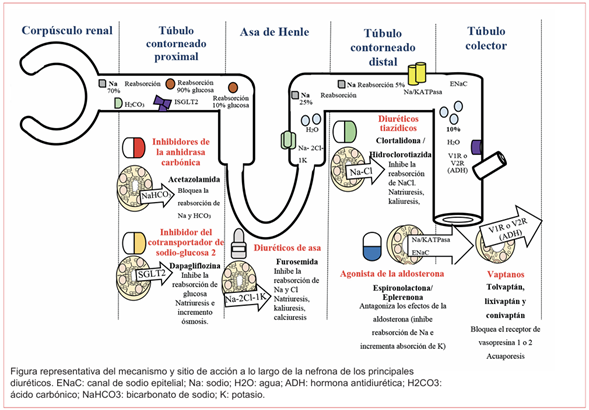
Diuréticos de asa: son el pilar fundamental del tratamiento descongestivo, bloquean la reabsorción de sodio a nivel tubular por inhibición del importador Na+/K+/2Cl a nivel del asa ascendente de Henle, donde aproximadamente 25-30% del sodio filtrado se absorbe, lo que promueve natriuresis sustancial, así como kaliuresis, calciuresis y excreción de magnesio. Otro mecanismo propuesto en el alivio temprano de la disnea es la vasodilatación sistémica. Los diuréticos de asa disponibles son furosemida, torsemida y bumetanida. En el pasado se utilizó el ácido etacrínico, pero ya no se encuentra disponible. Las dosis más altas seguras o efectivas de diuréticos de asa son desconocidas, se reportan en la literatura dosis diarias totales altas de hasta 1.500-2.000 mg. Cuando se usa en infusión, en general es recomendable iniciar con una dosis carga para asegurar un inicio rápido del tratamiento6,24,25(verfigura 5).
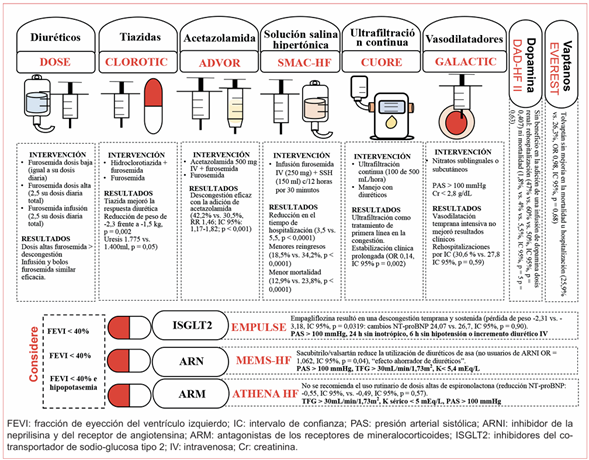
Figura 5 Terapia basada en la evidencia. Manejo de la descongestión en insuficiencia cardíaca aguda.
El estudio DOSE (Diuretic Optimization Strategies Evaluation) fue un estudio factorial que comparó dosis alta vs. dosis baja, así como infusión vs. bolos de furosemida, sin encontrar diferencias entre bolos o infusión. En la comparación de la estrategia de dosis alta con la estrategia de dosis baja, hubo una tendencia no significativa hacia una mejoría en los síntomas de los pacientes en el grupo de dosis alta (AUC media, 4.430 vs. 4.171, p = 0,06) y una mejoría significativa en el volumen urinario; se concluyó que las dosis altas podrían ser superiores en términos de descongestión a costa de un incremento en la creatinina que no se asoció a peor pronóstico26. El DRAIN (Diuretic Response in Advanced Heart Failure: Bolus Intermittent vs. Continuous Infusion) demostró que en pacientes con falla cardíaca avanzada la infusión de furosemida podría ser superior a los bolos (ausencia de congestión 48% vs. 25%, p = 0,04)27. En el ensayo TRANSFORM-HF (Torsemide Comparison with Furosemide for Management of Heart Failure) al comparar torasemida con furosemida para el tratamiento de la IC no hubo diferencias significativas (mortalidad 26,1% vs. 26,2%, OR 1,02, IC 95%)6.
Diuréticos tiazídicos: bloquean el cotransportador de cloruro de sodio (NCC) en el túbulo contorneado distal, exhiben una acción sinérgica con los diuréticos de asa, se usan como agentes de segunda línea en el tratamiento diurético combinado, en caso de congestión “resistente” a altas dosis. Las diferentes moléculas son hidroclorotiazida, clortalidona, clorotiazida y metolazona; de estos, solo la clorotiazida se encuentra en presentación IV24. El reciente ensayo CLOROTIC (Combining Loop with Thiazide Diuretics for Decompensated Heart Failure) demostró que la adición de hidroclorotiazida al tratamiento con diuréticos de asa mejora la respuesta diurética en pacientes con ICA (reducción de peso de -2,3 frente a -1,5 kg, p = 0,002; uresis 1.775 ml frente a 1.400 ml, p = 0,05)28.
Antagonistas de los receptores de mineralocorticoides (ARM): los ARM inhiben los efectos de la aldosterona al modular la expresión/actividad de los canales de sodio y potasio en la nefrona distal, así, aumenta la excreción de sodio y la retención de potasio, lo que demuestra que su inicio temprano reduce mortalidad, hospitalizaciones y riesgo de hipopotasemia e incrementa la posibilidad de egreso con tratamiento modificador de la enfermedad optimizado (espironolactona y eplerenona)6. En el estudio ATHENA HF (Combined with Natriuresis Therapy in Heart Failure) dosis de ≥ 100 mg de espironolactona al día no condujeron a una mejor descongestión en comparación con la atención estándar en pacientes con ICA (reducción NT-proBNP: -0,55 vs. -0,49, IC 95%, p = 0,57)29.
Inhibidores de la anhidrasa carbónica: la acetazolamida bloquea la reabsorción de sodio y bicarbonato en el túbulo contorneado proximal, lo que resulta en natriuresis y acidosis metabólica autolimitante11. El ensayo ADVOR (Acetazolamide in Decompensated Heart Failure with Volume Overload) evidenció una mayor descongestión eficaz con la adición de acetazolamida (42,2% vs. 30,5%, RR 1,46; IC 95%: 1,17-1,82; p < 0,001), se concibe como una interesante opción en los pacientes que no están tomando iSGLT2 y particularmente en pacientes con alcalosis metabólica30.
Inhibidor del cotransportador de sodio-glucosa 2 (iSGLT2): son fármacos con efecto natriurético y diurético osmótico, que inhiben la reabsorción de sodio en el túbulo contorneado proximal renal, al bloquear el cotransportador de sodio-glucosa tipo 26,11. En el estudio EMPULSE (Empagliflozin on Decongestion in Acute Heart Failure) el uso de empagliflozina en paciente con ICA y estabilidad hemodinámica resultó en una descongestión temprana y sostenida (pérdida de peso -2,31 kg vs. -3,18 kg, IC 95%, p = 0,0319)31.
Inhibidor del receptor de angiotensina-neprilisina (ARNI): el aumento de los niveles de péptidos natriuréticos genera natriuresis, diuresis, vasodilatación de los conductos aferentes y disminución del sistema simpático. A nivel renal producen relajación de las células mesangiales, esto reduce las resistencias vasculares preglomerulares, lo cual aumenta la superficie de filtración, estimula la diuresis y natriuresis por mecanismos glomerulares directos (equilibrio glomérulo-tubular), mediados por la activación del guanosín monofosfato cíclico (GMPc). En un estudio post hoc de CardioMEMS (European Monitoring Study for Heart Failure), se observó que sacubitrilo/valsartán se asocia con una menor utilización de diuréticos de asa32,33,34.
Solución salina hipertónica (SHH): se ha descrito como una posible estrategia en la resistencia a los diuréticos y disfunción cardiorrenal progresiva. Anteriormente, se había postulado que su mecanismo de acción consistía en generar una redistribución de líquido desde el intersticio hacia el compartimento intravascular a través de fuerzas osmóticas, de esta manera, el volumen intravascular efectivo se restauró, aumentó el flujo sanguíneo renal y mejoró el suministro de agentes diuréticos al asa de Henle35. La evidencia actual es contradictoria, pues en un estudio con administración de solución salina durante 24 horas se observó un efecto similar, lo que descarta el efecto osmótico36. Recientemente, se ha considerado que el cloro podría ser el mecanismo fundamental, mediante la inhibición del sistema renina-angiotensina-aldosterona en la mácula densa. De hecho, un metaanálisis de 14 estudios (3.398 pacientes) en 2020 de Covic y cols. demostró que el uso concomitante de 150 mL al 1,4-4,6% en 30 minutos genera una mayor reducción en los niveles de creatinina (0,33 mg/dL, IC 95%, p < 0,00001), incremento de volúmenes urinarios (uresis 581,94 mL/24 horas, IC 95%, p < 0,00001) y reducción de días de estancia hospitalaria (diferencia de 3 días, IC 95%, p < 0,00001)37. El estudio SMAC-HF de 2011 sugiere que la administración de SSH con furosemida reduce el tiempo de hospitalización (3,5 vs. 5,5, p < 0,0001), menor tasa de reingresos (18,5% vs. 34,2%, p < 0,0001) y mortalidad (12,9% vs. 23,8%, p < 0,0001)38.
Antagonistas de la vasopresina o vaptanos: bloquean el receptor de vasopresina-2, lo que provoca acuaresis. Existen antagonistas selectivos del receptor V2 (tolvaptán y lixivaptán) y antagonistas de los receptores V2 y V1a (conivaptán)39. En el estudio TACTICS-HF (Targeting Acute Congestion with Tolvaptan in Congestive Heart Failure) la adición de tolvaptán a un régimen estandarizado de furosemida no mejoró a las 24 horas la repuesta a diuréticos, a pesar de una mayor pérdida de peso y pérdida de líquidos (descongestión 39% vs. 27%, p = 0,037; respondedores a diuréticos 16% y del 20%, p = 0,32)40. El estudio EVEREST (Efficacy of Vasopressin Antagonism in Heart Failure: Outcome Study With Tolvaptan) evidenció que la adición de tolvaptán en ICA no reduce mortalidad u hospitalización (25,9% vs. 26,3%, OR 0,98, IC 95%, p = 0,68)41.
Dopamina: en dosis renal (2 a 3 μg/kg/min) el fármaco actúa sobre los receptores dopaminérgicos periféricos (DA1 y DA2) y produce vasodilatación en las circulaciones renal, coronaria, esplácnica y cerebral. En el ensayo DAD-HF II la adición de dopamina infusión en dosis bajas en ICA no redujo las tasas de rehospitalización (47% vs. 60% vs. 50%, IC 95%, p = 0,407) ni mortalidad (1,8% vs. 4% vs. 5,5%, IC 95%, p = 0,63), se detuvo antes de tiempo debido a una alta incidencia de taquicardia (14,4% vs. 12% vs. 6,8%, p = 0,874)42.
Ultrafiltración continua en la insuficiencia cardíaca congestiva: implica la eliminación del agua del plasma a través de una membrana semipermeable en respuesta a un gradiente de presión transmembrana21. El ensayo CUORE (Continuous Ultrafiltration for Congestive Heart Failure) evidenció que la ultrafiltración como tratamiento de primera línea en la congestión se asocia con una estabilización clínica prolongada (OR 0,14, IC 95%, p = 0,002) y menor tasa de rehospitalización43. En el ensayo UNLOAD (Ultrafiltration versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Congestive Heart Failure), la ultrafiltración temprana comparada con diuréticos intravenosos generó de manera segura una mayor descongestión (pérdida de peso 5,0 kg vs. 3,1 kg, p = 0,001) y menos rehospitalizaciones (18% vs. 32%, p = 0,037)44. El ensayo PURE-HF (Peripheral Ultrafiltration for the RElief From Congestion in Heart Failure) comparó la UF periférica combinada con dosis bajas de diuréticos intravenosos vs. la terapia dirigida por las guías en pacientes con IC hospitalizados por congestión. Desafortunadamente, este estudio terminó de forma prematura por la baja tasa de reclutamiento45.
Vasodilatadores: los vasodilatadores intravenosos, como los nitratos o el nitroprusiato dilatan los vasos venosos y arteriales, lo cual lleva a una reducción del retorno venoso al corazón, la congestión y la poscarga y un aumento del volumen latido con el consiguiente alivio de los síntomas. Los nitratos actúan fundamentalmente en venas periféricas, mientras que el nitroprusiato es un dilatador con un efecto arterial y venoso más equilibrado. Pueden considerarse los vasodilatadores intravenosos para aliviar los síntomas de ICA siempre que la PAS sea > 110 mmHg. La vasodilatación temprana intensiva y sostenida por vía oral en el ensayo clínico GALACTIC (Effect of a Strategy of Comprehensive Vasodilation vs. Usual Care on Mortality and Heart Failure Rehospitalization) no redujo mortalidad o rehospitalizaciones (30,6% frente a 27,8%, IC 95%, p = 0,59)46.
Monitorización durante la descongestión: evaluación de la repuesta a diuréticos
Los parámetros más utilizados para evaluar la respuesta diurética son: el peso corporal, la diuresis diaria y el contenido de sodio urinario posdiurético; otros marcadores sustitutos de (des)congestión incluyen la hemoconcentración demostrada en mediciones longitudinales de proteínas totales séricas, albúmina, hemoglobina y hematocrito. La reducción de los péptidos natriuréticos también se considera biomarcador de descongestión4,6.
La determinación del volumen urinario y sodio urinario posdiurético permite interpretar la respuesta diurética y detección del paciente resistente; son indicativos de una adecuada respuesta diurética niveles de sodio urinario de entre 50-70 mEq/L después de 2 horas y/o una diuresis horaria > 100-150 mL durante las primeras 24 horas o > 3-4 L en las siguientes 24 horas24.
Sin embargo, un estudio reciente indicó que valores de 50 mEq/L podrían no ser suficientes para asegurar una descongestión exitosa, pues aproximadamente un 40% de los pacientes tienen valores de sodio urinario mayores a 50 mmol/L, aun antes del uso de diuréticos. Probablemente, la ecuación natriuretic response prediction equation (NRPE), que usa una combinación de la creatinina urinaria, sodio urinario y tasa de filtrado glomerular, sea superior para detectar pacientes con pobre respuesta natriurética47.
Las reducciones en el peso corporal y la pérdida de líquidos pueden estar relacionadas con disminución del volumen intravascular y debe reflejar una disminución de la congestión48,49. Reducciones en nivel de péptidos natriuréticos (BNP y/o NT-proBNP) mayores del 30% de su valor basal durante la hospitalización se considera indicador de descongestión intravascular exitosa, asociada a un mejor pronóstico. Otro marcador complementario asociado a una descongestión efectiva es la reducción de > 50% de líneas B en el ultrasonido cardiopulmonar50.
Consideraciones adicionales con diuréticos de asa
Empeoramiento de la función renal durante terapia descongestiva: durante la descongestión en la ICA, es frecuente observar en más del 50% de los pacientes incremento de los niveles de creatinina sérica, estando su pronóstico y estrategia terapéutica determinada por el contexto clínico y el sustrato fisiopatológico subyacente. De forma general, se puede dividir en dos grupos: pseudoempeoramiento y empeoramiento verdadero. En aquellos que alcanzan las metas de descongestión, un aumento de la creatinina de hasta 0,5 mg/dL o un incremento < 25% se ha considerado aceptable (“pseudoempeoramiento”) asociado a un mejor pronóstico, es reflejo hemodinámico del bloqueo neurohormonal.
Sin embargo, se desconoce si valores superiores a estos pueden tener potenciales connotaciones negativas, no porque impliquen causalidad en cuanto a daño renal real por el tratamiento diurético, sino por ser marcadores de un estado cardiorrenal más severo y peor pronóstico47,50(verfigura 6).
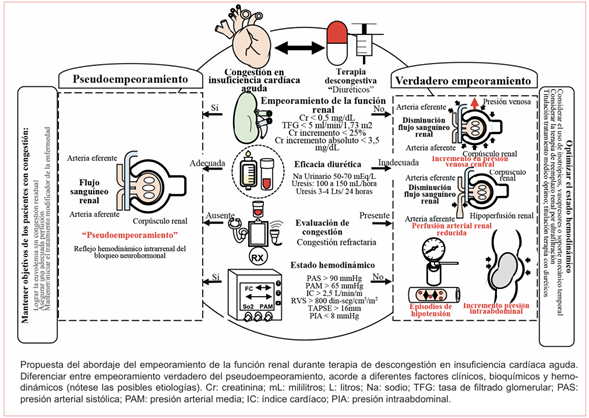
Figura 6 Abordaje del empeoramiento de la función renal durante terapia de descongestión en insuficiencia cardíaca aguda.
Alteraciones hidroelectrolíticas: la diselectrolitemia (hiponatremia, hipopotasemia) y las anomalías del equilibrio de líquidos son los efectos adversos más frecuentes; los mecanismos desencadenantes son múltiples, los de mayor relevancia son los de la actividad del sistema nervioso simpático y del sistema renina-angiotensina-aldosterona, niveles elevados de arginina vasopresina y uso de diuréticos39.
Mecanismo de resistencia a los diuréticos: la respuesta a los diuréticos en la ICA puede alterarse por múltiples factores que incrementan el umbral natriurético (dosis mínima para generar natriuresis) y reducen el techo respuesta (dosis de diurético para generar natriuresis máxima). De forma conceptual, se pueden diferenciar dos grupos: factores prerrenales y renales, se considera adicionalmente la temporalidad de presentación. Dentro de los factores prerrenales, se encuentran: alteraciones en la absorción unión, liberación y secreción de los diuréticos (alteración de la perfusión renal, hipoalbuminemia, incremento de aniones urémicos, proteinuria, interacciones con otros fármacos como AINES, edema y descenso de la perfusión intestinal, agotamiento del volumen intravascular efectivo, incremento de la presión intraabdominal). Los principales factores renales son: afección de la función tubular renal por congestión venosa, estimulación de los ejes neurohormonales, en especial la secreción de renina en la mácula densa (“fenómeno de frenado de la nefrona”), hipertrofia e hiperfunción de los túbulos distales, retención de sodio posdiurética “de rebote”50.
Conclusiones
La causa más frecuente de hospitalización por IC es la congestión. Con frecuencia, se detecta de forma tardía y esto requiere hospitalización. Desafortunadamente, un tratamiento insuficiente resulta en congestión residual al alta, con el consecuente riesgo de rehospitalización y muerte. Durante las últimas décadas el entendimiento de los diversos eventos fisiopatológicos desencadenantes ha permitido desarrollar técnicas de evaluación y estrategias terapéuticas de mayor eficacia y seguridad.
La atención del paciente con IC y episodios de congestión debe ser estructurada, partiendo del reconocimiento temprano de las diversas manifestaciones clínicas, el uso de métodos no invasivos diagnósticos (biomarcadores, scores, estudios de imagen), la delimitación del perfil de congestión presente (sistémico o pulmonar) seguido de un manejo oportuno, intensivo y eficaz que contemple el empleo temprano de diuréticos IV, la evaluación de metas de descongestión y valorar el alta solo cuando la congestión se ha resuelto por completo.
Puntos clave
•Concebir la congestión en la IC como una emergencia que requiere tratamiento rápido y eficaz.
•Cumplir con los objetivos de la terapia de descongestión (lograr euvolemia, mantener adecuada perfusión e instaurar tratamiento médico óptimo).
•Evaluación continua de la eficacia diurética acorde a metas según la temporalidad.
•Buscar un enfoque terapéutico estructurado de descongestión, contemplando el uso temprano de diuréticos IV, terapia diurética combinada, medicamentos vasoactivos y ultrafiltración continua.
•Aprender a interpretar los cambios de la función renal durante la terapia descongestiva.