Introducción y antecedentes
El implante dental es un elemento fundamental en el tratamiento rehabilitador de pacientes desdentados parciales y totales. Desde el momento de su inserción quirúrgica, los tejidos de soporte y de protección inician un proceso de cicatrización que culmina en la integración biológica y funcional del implante al huésped. En el caso del tejido blando periimplantario, este proceso es guiado por la utilización de pilares de cicatrización y prótesis provisionales, los que además cumplen un rol importante en la instalación de la microbiota en el nuevo nicho periimplantario.
Los pilares de cicatrización pueden ser confeccionados mediante diferentes materiales, siendo los más comunes el titanio, el polimetil-metil-metacrilato (PMMA) y la polieter-eter-cetona (PEEK). Este último ha ganado interés en los últimos años, gracias a sus propiedades fisicoquímicas y mecánicas, que se ha observado favorecen la cicatrización y evolución de los tejidos circundantes al implante 1-3. Posee además un mejor rendimiento estético en comparación con las aleaciones metálicas, lo que ha impulsado su utilización en zonas con mayor compromiso estético 4. El titanio, por otra parte, presenta excelentes propiedades mecánicas, físicoquímicas, además de una reconocida compatibilidad biológica, dada entre otros, por su alta estabilidad química y resistencia a la corrosión 5. Sin embargo, algunos autores han observado que posee una menor capacidad antibacteriana y anti-adherente que la zirconia 6 o el PEEK 7.
Entre las características que inciden en la formación de la biopelícula sobre los pilares se encuentra la rugosidad de su superficie, la energía superficial de esta, así como las características intrínsecas de los materiales utilizados para su confección 8-10. Sin embargo, el rol específico de cada una de ellas, en particular el efecto del material sobre la formación y viabilidad de la biopelícula no están claros. Por lo tanto, el objetivo de este estudio descriptivo es explorar el efecto de las características de superficie, así como del material, sobre el volumen total y la viabilidad de la biopelícula bacteriana formada sobre pilares de cicatrización de PEEK y Titanio.
Métodos
Preparación de las muestras
Se prepararon 4 pilares de cicatrización de titanio (Ø 6.5mm; H 6mm; RC; plataforma RC Ø 4.1 mm) y 4 de PEEK (Ø 5mm; H 7 mm NC; plataforma NC Ø 3.3 mm) de la empresa Straumann/ Neodent (Straumann®, Basilea, Suiza). La zona cilíndrica superior de cada pilar fue seccionada de su base mediante una sierra de alta precisión (IsoMet 1000, Buehler, Illinois, USA) bajo irrigación continua, según se muestra en la Figura 1.
Rugosidad de Superficie
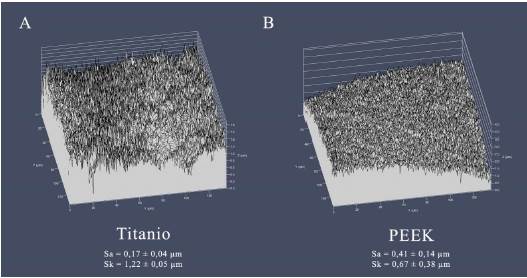
La rugosidad de superficie fue determinada mediante Microscopía Confocal Laser de Barrido, CLSM, (LSM 780, Zeiss, Jena, Alemania), utilizando el modo de reflexión, en zonas al azar de la parte superior de cada pilar. Se analizaron los parámetros de rugosidad de área, en cada superficie (rugosidad media aritmética, S a, y asimetría, skewness, S k).
Energía superficial
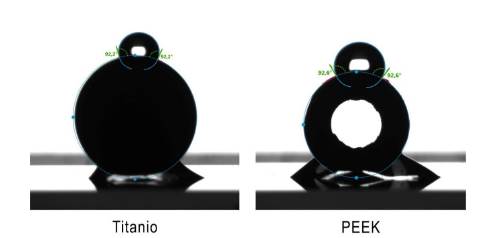
La energía superficial se determinó midiendo el ángulo de contacto de cada material mediante la técnica de gota sésil, utilizando como líquido agua destilada. Se dejó caer una gota de volumen de 0,5 μL sobre la zona convexa externa de los pilares (Figura 2). La hidrofobicidad fue determinada midiendo el ángulo que forma la gota con la superficie del pilar.
Análisis microbiológico: Volumen total de biopelícula y viabilidad bacteriana
Tres muestras en cada grupo fueron esterilizadas bajo rayos ultravioleta (UV) durante 15 minutos por cada lado, y se mantuvieron en una atmósfera húmeda a 37 °C dentro de una incubadora, simulando lo que ocurre dentro de la cavidad bucal.
Para la preparación de la biopelícula multiespecie se utilizaron cepas (American Type Culture Collection, ATCC, Manassas, VA, USA) de Streptococcus sanguinis (ATCC 10556D-5), Prevotella melaninogenica (ATCC 25845TM), Porphyromonas gingivalis (ATCC 33277TM) Streptococcus mutans (ATCC 25175TM) y Enterococcus faecalis (ATCC 29212). El inóculo estándar de cada cepa bacteriana se ajustó a una turbidez equivalente a 0,5 de la escala de McFarland, medida con un turbidímetro Oxoid (Fisher Scientific Company, Ottawa, Canadá) 11.
Los cultivos de las 5 especies de bacterias se mezclaron por igual. Después se tomaron 150 μL de la suspensión mixta que se colocó en cada uno de los pocillos con las muestras en ellos. Además, se agregó 1 μg de hemina/mL, 1 μg de vitamina K/mL, 3 μg de levadura/mL y 10 μg de sacarosa/mL al medio. Posteriormente, se incubaron las muestras durante 30 días, todas ellas a 37 °C en condiciones de anaerobiosis. El medio se renovó dos veces por semana. El último día, todas las muestras se depositaron en pocillos para microscopía de fluorescencia WPI modelo Fluorodish, para minimizar al máximo la exposición de la biopelícula al oxígeno.
Se utilizó el reactivo LIVE/DEAD Kit BacLight (Invitrogen, Carlsbad, EE. UU.) para determinar la viabilidad bacteriana. Primero se preparó en una solución 2X stock de la mezcla de reactivo según las instrucciones del fabricante, se disolvió el contenido del componente de la pipeta A (tinción SYTO 9 que contiene sólidos amarillo-naranja) y el componente de la pipeta B (Yoduro de propidio que contiene sólidos de color rojo) en 5 mL de volumen común de agua esterilizada por filtración. Se agitó hasta obtener una mezcla homogénea. Las muestras fueron teñidas con 500 μL del reactivo LIVE/DEAD Kit BacLight, y luego fueron cubiertas con papel aluminio durante 10 minutos.
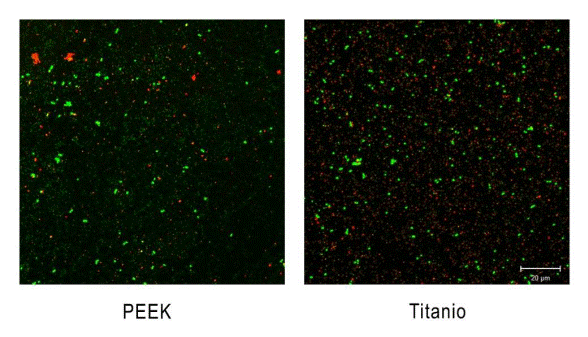
Las muestras fueron llevadas al CLSM y analizadas mediante un láser de argón, con excitación de 488 nm y un espectro de adquisición ajustados a los siguientes parámetros: 490-560 nm para verde y 560-639 nm para rojo (Software ZEN 2011). Se obtuvo imágenes de cada muestra usando un objetivo de 63X de inmersión. Las células que presentaban una pared celular comprometida permitieron el paso del Yoduro de Propidio, por lo que al tener una afinidad mayor por el ADN que el SYTO 9, se tiñeron de rojo, lo que permitió identificarlas como bacterias muertas. Las células vivas, por otra parte, al poseer una pared celular intacta, se tiñeron de verde, gracias a la capacidad que tiene SYTO 9 de traspasar membranas intactas.
Análisis estadísticos
El análisis estadístico se realizó mediante el programa Minitab 17 (Minitab Inc., USA). Debido al limitado tamaño de la muestra, sólo se realizó estadística descriptiva. El tamaño del efecto se estimó mediante d de Cohen, en base a las diferencias de las medias de los grupos y la desviación estándar ponderada, de manera de poder determinar si existe efecto, y si este es pequeño, moderado o grande 12.
Resultados
Características de superficie
Los valores de rugosidad y ángulo de contacto se presentan en la Tabla 1. En la Figura 3 se observan imágenes características obtenidas con el microscopio confocal de cada una de las superficies.
Tabla 1. Valores promedio, con su respectiva desviación estándar entre paréntesis, para la rugosidad y el ángulo de contacto
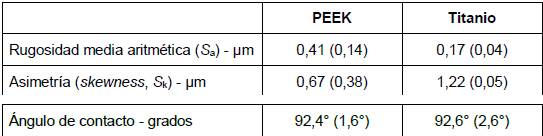
Según el criterio de Cohen, el material utilizado tuvo un efecto grande (d = 2,3) sobre la rugosidad observada. Por otra parte, se observó un efecto pequeño (d < 0,2) del tipo de material sobre el ángulo de contacto (Figura 2).
Volumen total de biopelícula y viabilidad bacteriana.
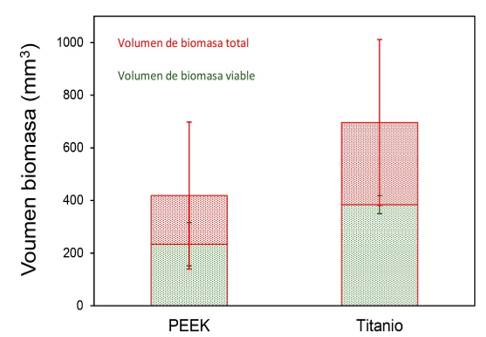
Las imágenes de microscopía confocal evidenciaron un mayor volumen de biopelícula bacteriana sobre las superficies de titanio (696 µm3 ± 315 µm3) en comparación con las de PEEK (419 µm3 ± 279 µm3), según se aprecia en la Figura 4. Estos valores permiten estimar un efecto mediano a grande según Cohen (d = -0,67). A su vez, los pilares de cicatrización de titanio también mostraron un mayor volumen de bacterias vivas (384 µm3 ± 97 µm3) que los de PEEK (234 µm3 ± 82,2 µm3). Pese a ello, la proporción de bacterias vivas con respecto al total observado fue similar (55% vs. 56% para titanio y PEEK, respectivamente), como se puede apreciar en las imágenes de CLSM presentadas en la Figura 5.
Discusión
El presente estudio descriptivo abordó, de manera exploratoria, el efecto del material y las características de su superficie sobre el desarrollo y viabilidad de una biopelícula bacteriana. Si bien la extrapolación de los resultados encontrados se ve limitada por el reducido número de muestras evaluadas, la tendencia observada con respecto al menor volumen total de bacterias en las superficies de pilares de cicatrización de PEEK, resulta de interés para la indicación y utilización de estos pilares como alternativa a aquellos de titanio.
El desarrollo y crecimiento de una biopelícula bacteriana sobre una superficie se ve influenciado por una serie de factores, entre los que se encuentran tanto las características topográficas de la superficie, así como su hidrofobicidad, energía superficial y carga 13. Se ha observado que tanto un aumento de la rugosidad (S a) por sobre 0,2 µm 14, así como de la energía superficial, facilitan la formación de biopelículas en materiales restauradores, aunque el efecto de la rugosidad resulta más determinante 15. Esta relación ha sido demostrada en la superficie de diferentes materiales, como resina compuesta 16, cerámicas vítreas 17 y titanio 18. La presencia de depresiones más profundas y amplias aumenta el área de contacto, al tiempo que protege mejor a las bacterias ante fuerzas externas de remoción, creando así una superficie más favorable para la colonización y el crecimiento de la biopelícula 19. En el presente estudio, pese a que se observó una mayor rugosidad en los pilares de PEEK con respecto a los de titanio (Tabla 1), fueron estos últimos los que mostraron un volumen total mayor de biopelícula sobre sus superficies (Figura 4). Sin embargo, ambos materiales mostraron biopelículas con la misma viabilidad bacteriana (Figura 5). Los resultados de estudios in vitro donde se estudiaron estos mismos materiales son disímiles. Mientras Barkamo y cols. también midieron una mayor rugosidad (S a) en PEEK que en titanio, observaron una mayor formación de biopelícula en PEEK, especialmente para cepas como S. sanguis y S. oralis9. Resulta interesante destacar que en este mismo estudio, mediciones luego de 120 h de cultivo no arrojaron diferencias significativas en las biopelículas de los distintos materiales 9. En la misma línea, Hahnel y cols. tampoco encontraron diferencias significativas en la biomasa viable de superficies de PEEK, titanio o zirconia, pese a que PEEK presentó los valores más bajos de rugosidad entre los materiales estudiados 20. Por otra parte, D’Ercole y cols. observaron una nanorugosidad significativamente mayor en PEEK que en Titanio, tanto maquinado como grabado, aunque el volumen total de bacterias y de bacterias viables (S. oralis) resultó significativamente menor en superficies de PEEK 7. Por último, pese a no observar diferencias en la rugosidad de superficies de titanio y PEEK, Peng y cols. encontraron una biomasa total significativamente mayor (S. mutans, A. actinomycetemcomitans) en titanio que en PEEK, aunque, y similar a los resultados de este estudio, ambos materiales presentaron la misma viabilidad celular en sus biopelículas 21.
En cuanto a la energía superficial, los pilares de ambos materiales estudiados aquí resultaron esencialmente hidrófobos (ángulos de contacto por sobre los 90°), aunque con valores muy similares entre ellos (Figura 2). Resultados para esta propiedad varían bastante en la literatura, con algunos autores describiendo una mayor hidrofobicidad para titanio 7, y otros para PEEK (9, 20, 21). Sin embargo, no hay concordancia entre ellos en cuanto a su efecto sobre la cantidad y viabilidad de la biomasa formada. Al parecer la capacidad de fomentar o inhibir la formación de biopelículas no se relaciona exclusiva o preponderantemente con una característica de la superficie, sino más bien con una combinación de estas, siendo además altamente dependientes de la composición bacteriana de la biopelícula que la colonizará 19.
Si bien los resultados del presente estudio no son extrapolables a situaciones clínicas, sí entregan una visión del efecto que tienen tanto la naturaleza del material como sus características superficiales sobre la formación y desarrollo de biopelículas bacterianas. En el caso de pilares de cicatrización, pensados para un uso relativamente breve, el impacto sobre la longevidad de las restauraciones finales no parece relevante a primera vista. Sin embargo, la instalación de una microbiota potencialmente patógena en el nicho periimplantario, favorecida por las características del pilar de cicatrización utilizado, puede repercutir en el desarrollo posterior de patologías periimplantarias y en el éxito del tratamiento. Son necesarios, por lo tanto, estudios de mayor complejidad y alcance para poder clarificar el rol de esta microbiota temprana en el desarrollo de dichas patologías.











 texto en
texto en