Principales aportes
El uso de anticoagulación precoz sistemática en pacientes tras el implante de bioprótesis aórtica es muy discutido. Este estudio aporta a este debate, dado que no encontró que la anticoagulación mejorara los perfiles hemodinámicos de las bioprótesis a mediano plazo. A pesar de ello, en nuestro estudio la anticoagulación precoz no aumentó el riesgo de sangrados; es, por lo tanto, segura durante los primeros 3 meses del posoperatorio.
Introducción
La cirugía de sustitución valvular aórtica (SVA) fue introducida en la década del cincuenta, como tratamiento indicado más frecuentemente para la estenosis aórtica severa. Al inicio se utilizaron válvulas mecánicas y más adelante, en la década del sesenta, prótesis biológicas1. Recientemente ha aumentado el uso de bioprótesis, tanto en cirugía cardíaca como por el advenimiento de las prótesis transcatéter para tratamiento percutáneo de la estenosis aórtica. El incremento en el uso de las válvulas biológicas para la SVA quirúrgica puede ser atribuido a los avances en la tecnología de las bioprótesis y a un mayor intervencionismo quirúrgico en la población anciana, donde los dispositivos bioprotésicos son preferidos.
Aunque las prótesis biológicas son menos trombogénicas que las mecánicas, la trombosis de la válvula protésica biológica (TVPB) es una entidad cada vez más reconocida a nivel mundial como causa de disfunción protésica potencialmente reversible. Está presente en el 11% de las bioprótesis explantadas por disfunción valvular2.
A pesar de que se ha visto que la TVPB es menos frecuente en pacientes que se anticoagulan3,4, no se ha podido demostrar un efecto clínico beneficioso neto en la anticoagulación de rutina en la SVA transcatéter o quirúrgica5-7.
Debido a ello, en la guía de valvulopatías de la American College of Cardiology y la American Heart Association (ACC/AHA) 2020, la indicación de anticoagulación con antagonistas de la vitamina K (AVK) para las bioprótesis durante un período de 3 a 6 meses (en pacientes con bajo riesgo de hemorragia) es indicación clase IIa nivel de evidencia B8. En la guía de la European Society of Cardiology (ESC) 2021, el tratamiento anticoagulante con AVK (o alternativa e indistintamente con dosis bajas de aspirina) debe considerarse en los primeros 3 meses luego de la SVA por bioprótesis, indicación clase IIa nivel de evidencia B9.
Las complicaciones trombóticas y embólicas, así como los sangrados vinculados a la anticoagulación, son los factores más importantes de morbimortalidad posoperatoria en estos pacientes. En numerosos estudios prospectivos observacionales el tratamiento con anticoagulantes reduce la incidencia de complicaciones tromboembólicas sistémicas, ataque cerebrovascular (ACV) y la morbimortalidad sin un aumento significativo del sangrado10, incluyendo pacientes mayores de 80 años11.
Nuestra institución ha publicado un estudio retrospectivo con control prospectivo12 que incluyó 103 pacientes sometidos a SVA por bioprótesis, divididos en dos grupos según el uso o no de anticoagulantes orales (ACO) en el posoperatorio precoz. En el control ecocardiográfico realizado en promedio a los 2 años de la SVA, los pacientes anticoagulados presentaron gradientes transvalvulares e insuficiencia protésica significativamente menores. En cuanto a los resultados clínicos, un porcentaje significativamente mayor de los pacientes del grupo con ACO presentó mejoría en la clase funcional (CF) de la New York Heart Association (NYHA), mientras que un mayor número de pacientes sin ACO presentó peoría en su CF de la NYHA. Ningún paciente presentó episodios de sangrado o ACV. Se concluyó que el uso de ACO durante los primeros tres meses del posoperatorio de SVA con bioprótesis se asocia a menores gradientes transvalvulares y menor incidencia de insuficiencia protésica en el seguimiento a mediano plazo. Se planteó que ambos factores podrían explicar la mejoría significativa de la NYHA en pacientes con anticoagulación precoz.
De acuerdo con estos resultados, se decidió realizar un ensayo clínico aleatorizado con la hipótesis de que la anticoagulación precoz en la SVA se asocia a menor incremento del gradiente transprotésico a mediano plazo con similar riesgo de complicaciones en la evolución.
Objetivos
El objetivo primario del ensayo es determinar si existe una diferencia significativa en la variación del gradiente transprotésico medio (Δ Gm) al año de la SVA entre las dos estrategias de tratamiento antitrombótico. Los objetivos secundarios son la comparación de la variación del gradiente máximo y del área valvular aórtica (AVA), y parámetros clínicos que incluyen la CF de la NYHA, las tasas de sangrado mayor y menor y la incidencia de eventos embólicos. Este trabajo se representa el análisis interino a 3 meses de un proyecto a más largo plazo, y se propone mostrar los resultados preliminares de los puntos finales previamente definidos.
Definiciones operativas
El sangrado mayor se definió como aquel sangrado evidente asociado a una caída en la hemoglobina de al menos 3,0 g/dl o que requirió transfusión de dos unidades de glóbulos rojos, o que requirió hospitalización o cirugía o que causó injuria permanente (y que no entra en la categoría de sangrado fatal o discapacitante) según la Valve Academic Research Consortium-2 (VARC-2)15. El sangrado menor se definió como cualquier sangrado que no califica como mayor ni fatal ni discapacitante.
La mortalidad operatoria se definió como la mortalidad por todas las causas dentro de los primeros 30 días de la cirugía o durante la hospitalización de la cirugía si la estadía posoperatoria era mayor de 30 días, también de acuerdo con el documento de la VARC-215.
La mejoría en la CF de la NYHA se definió como un descenso en la CF de la NYHA de al menos un grado.
Los eventos embólicos se refirieron a ACV, accidente isquémico transitorio (AIT) y embolia fuera del sistema nervioso central.
Métodos
Se trata de un estudio prospectivo randomizado abierto multicéntrico, realizado en dos centros de cirugía cardíaca en Montevideo (Instituto Nacional de Cirugía Cardíaca y Centro Cardiovascular Universitario del Hospital de Clínicas). El período de reclutamiento comenzó el primero de enero de 2019 y finalizó el 13 de marzo de 2020. Se presenta en este trabajo el análisis interino de los resultados obtenidos hasta el primero de setiembre de 2019.
Criterio de inclusión: Todos los pacientes consecutivos que se sometieron a SVA con bioprótesis porcinas con o sin revascularización miocárdica concomitante fueron sucesivamente reclutados en ambas instituciones.
Criterios de exclusión: cirugía concomitante de la válvula mitral, contraindicaciones para el uso de anticoagulación, indicación de anticoagulación por otras causas, indicación de doble terapia antiplaquetaria, plaquetopenia (menor de 90.000/mm3), endocarditis activa, disección de aorta y testigos de Jehová. Se realizó randomización simple en cada centro.
El grupo de anticoagulación (AC) recibió warfarina, iniciada a las 48 horas poscirugía, en dosis ajustada para un INR objetivo de 2,5 durante un período de 3 meses. Ambos grupos recibieron tratamiento antiplaquetario con aspirina 100 mg por día. En aquellos pacientes sometidos a cirugía de revascularización miocárdica concomitante, el grupo control recibió 325 mg de aspirina en lugar de 100 mg, y el grupo AC recibió 100 mg.
Para evaluar la calidad de la anticoagulación con warfarina, se calculó el tiempo en rango terapéutico (TTR) para cada paciente usando el método de interpolación lineal de Rosendaal13. Asimismo, se calculó la proporción de INR que estaba dentro del rango terapéutico.
Cirugía
El reemplazo valvular aórtico se realizó mediante esternotomía mediana completa con circulación extracorpórea, hipotermia general leve y paro cardiopléjico. Se abordó la aorta mediante aortotomía transversal, se resecó la válvula y se descalcificó el anillo. El anillo aórtico se midió utilizando los medidores de los fabricantes y el tamaño de la prótesis se seleccionó según la superficie corporal de los pacientes. La marca de la prótesis fue decidida por el cirujano entre las marcas St. Jude, Mosaic y Hancock II Ultra. En todos los casos se realizó implantación supraanular de la prótesis.
Ecocardiograma
El ecocardiograma transtorácico (ETT) fue realizado en todos los pacientes antes de la cirugía. Se realizaron instancias de seguimiento que consistieron en evaluación clínica y ecocardiográfica antes del alta, a los 3 meses y al año del procedimiento. Los siguientes parámetros ecocardiográficos fueron analizados: fracción de eyección del ventrículo izquierdo (FEVI), diámetro diastólico del ventrículo izquierdo, diámetro de la aurícula izquierda, área efectiva valvular aórtica (AVA) absoluta e indexada, coeficiente de obstrucción (CO), gradiente medio, gradiente máximo e insuficiencia aórtica (ausente, mínima, leve, moderada, severa). Los valores de los ETT pre-alta fueron considerados como los datos basales para las comparaciones. Los ETT fueron realizados de acuerdo con la guía de la Sociedad Americana de Ecocardiografía14, con los gradientes de presión derivados de la fórmula de Bernoulli modificada y el AVA calculada por ecuación de continuidad. Los ecocardiografistas fueron ciegos respecto al tratamiento asignado.
Se compararon los parámetros ecocardiográficos del ETT basal con los de los 3 meses en cada grupo. Esta diferencia (expresada como Δx), fue a su vez comparada entre los dos grupos, y se analizó su posible significación estadística.
Análisis estadístico
El análisis estadístico se realizó en la población por intención de tratar. Para el análisis por protocolo, los pacientes que recibieron al menos una dosis de warfarina y tenían al menos un INR >2 fueron considerados dentro del grupo AC.
El cálculo de tamaño muestral se realizó con base en los hallazgos previos de este grupo de trabajo con un poder de 90% y un error de tipo 1 de 0,05 con la intención de encontrar una diferencia en el gradiente medio de 3 mmHg con una varianza de 49 mmHg. Se estimó una muestra de 114 pacientes, considerando una pérdida de seguimiento de aproximadamente 20%; el tamaño de la muestra final fue de 143 pacientes.
Las variables cualitativas se presentan como números absolutos y porcentajes. Su comparación se realizó mediante chi cuadrado y el Fisher exact test. Las variables cuantitativas se expresan como media ± DE y se compararon mediante test de t. En caso de no cumplir supuestos de normalidad, se realizó el test no paramétrico Mann-Whitney U. Se llevó a cabo un análisis de regresión lineal múltiple para evaluar la interacción de la anticoagulación con el objetivo primario.
Aspectos éticos
El estudio fue aprobado por un Comité de Ética institucional. Todos los pacientes participantes firmaron un consentimiento informado.
Resultados
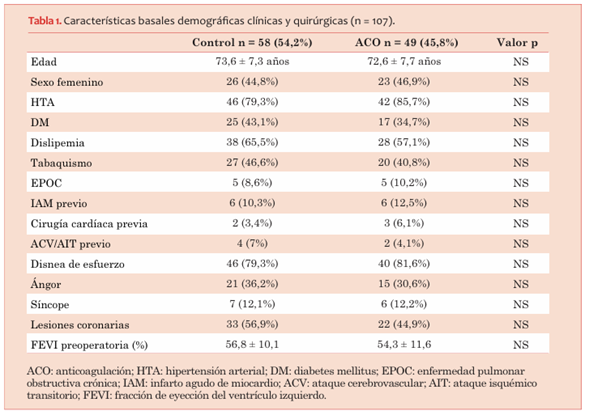
Entre el primero de enero de 2019 y el primero de setiembre de 2019, se reclutaron 107 pacientes, 49 (45,8%) de ellos fueron randomizados al grupo AC y 58 (54,2%) al grupo control.
Características basales
No existieron diferencias significativas en las características basales entre ambas poblaciones (tabla 1). El TTR promedio fue de 60% y el 61% de los INR se encontraban en rango.
De los pacientes, 55 llegaron al control de los 3 meses; 26 (47,3%) del grupo AC y 29 (52,7%) del grupo control. Hubo un cruzamiento de 3 pacientes desde grupo control a grupo AC por fibrilación auricular posoperatoria y 4 pacientes de grupo AC a grupo control por decisión del médico tratante. En el análisis por protocolo, 25 (45,5%) correspondieron al grupo AC y 30 (54,5%) al grupo control.
Resultados hemodinámicos
El gradiente transprotésico medio al alta fue de 15,2 mmHg para el grupo control y de 18,1 mmHg para el grupo AC, y a los 3 meses fue de 15,6 mmHg en el grupo control y 15,8 mmHg en el grupo AC. No hubo diferencias significativas en el gradiente medio entre ambos grupos en cada instancia temporal.
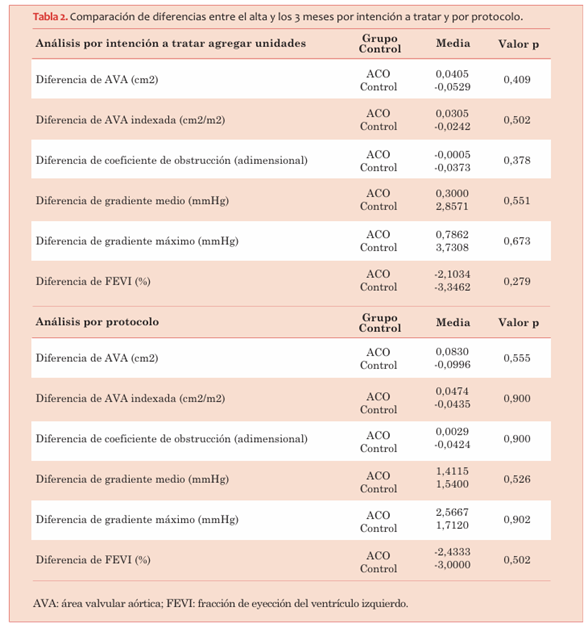
En cuanto a la variación (Δ) en el AVA, el AVA indexada, el CO, el gradiente medio y el gradiente máximo entre el alta y los 3 meses, no existieron diferencias significativas entre ambos grupos en ninguno de los parámetros. Esto fue similar en el análisis por intención a tratar y por protocolo (tabla 2).
Tabla 2 Comparación de diferencias entre el alta y los 3 meses por intención a tratar y por protocolo.
Resultados clínicos
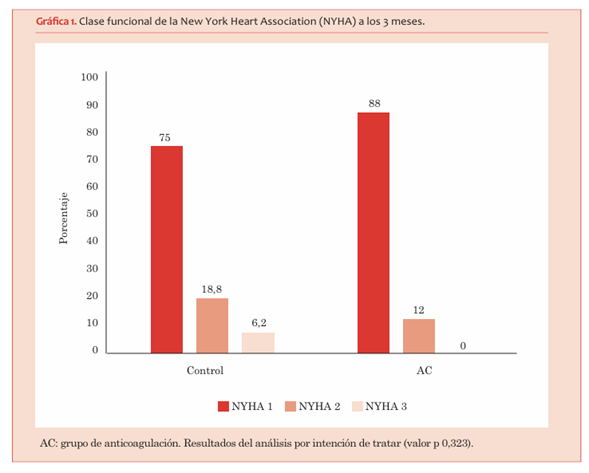
En cuanto a la CF a los 3 meses, del grupo control, 24 pacientes (75%) estaban en CF I, 6 pacientes (18,8%) en CF II y 2 pacientes (6,2%) en CF III. En el grupo AC, 22 pacientes (88%) estaban en CF I, 3 (12%) en CF II y ninguno en CF III. Las diferencias no fueron significativas en el análisis por intención a tratar (valor p 0,323) (gráfica 1). Esto fue similar en el análisis por protocolo, en el cual del grupo control, 25 pacientes (80,6%) estaban en CF I, 5 pacientes (16,1%) en CF II y 1 paciente (3,2%) en CF III. Del grupo AC en el análisis por protocolo, 21 pacientes (80,6%) se encontraban en CF I, 4 pacientes (15,4%) en CF II y 1 (3,8%) en CF III (valor p 0,990).
En cuanto a las complicaciones, no existieron eventos embólicos, hubo 3 sangrados mayores en el grupo control y 1 sangrado mayor en el grupo AC. Estas diferencias no fueron significativas ni en el análisis por intención a tratar ni según protocolo.
Discusión
El principal resultado de este análisis interino es que no se evidenció una diferencia en la variación del gradiente medio a corto plazo según la estrategia antitrombótica empleada. Anteriormente, algunos trabajos han demostrado una asociación entre la falta de anticoagulación con el aumento de los gradientes transvalvulares aórticos y el deterioro hemodinámico de las prótesis biológicas (5,16,17). Sin embargo, en estos trabajos la diferencia se observaba luego de los 12 meses de implantada la bioprótesis. Es por ello que nuestro objetivo primario es el gradiente medio al año (a largo plazo), donde creemos se podrían observar diferencias significativas.
Respecto a los demás parámetros ecocardiográficos, no existieron diferencias en la variación a los 3 meses de las áreas valvulares aórticas, el CO ni el gradiente máximo.
Concomitantemente, se evidenció que la anticoagulación precoz de la bioprótesis aórtica no afecta de forma significativa los riesgos de sangrado y de eventos tromboembólicos. Los resultados adversos de la anticoagulación, es decir, los sangrados, tanto menores como mayores, no difirieron entre ambos grupos a los 3 meses. Por lo tanto, en nuestro estudio la anticoagulación precoz durante los primeros 3 meses del posoperatorio fue segura.
Tampoco existieron diferencias en cuanto a los resultados clínicos, dado que la CF no difirió entre ambos grupos a los 3 meses. Trabajos internacionales no pudieron demostrar un efecto clínico beneficioso neto en la anticoagulación de rutina en la SVA transcatéter o quirúrgica5-7.
Limitaciones
Una dificultad del trabajo fue el control de la anticoagulación con warfarina para mantener un INR en rango; se obtuvo TTR promedio de 60%. Otra limitación es que se trata de un análisis interino de un ensayo clínico, por lo cual no se cuenta con los resultados completos al año.
Creemos que la principal fortaleza del trabajo es que se trata de uno de los pocos estudios prospectivos randomizados que evalúan el beneficio de la anticoagulación en pacientes que reciben bioprótesis valvular aórtica.
Conclusiones
El estudio demuestra que la anticoagulación no mejora de forma significativa los parámetros hemodinámicos bioprotésicos a los 3 meses. Asimismo, los resultados no indican que la anticoagulación produzca una mayor incidencia de efectos adversos en el mismo plazo.
Todavía no está dilucidado si la anticoagulación precoz con warfarina luego del implante de una bioprótesis tiene impacto en los resultados clínicos y/o hemodinámicos a largo plazo.