Introducción
La gastroenteritis aguda (GEA) continúa siendo un problema de salud en países subdesarrollados 1,2,3. En Uruguay la mortalidad por GEA ha disminuido en los últimos años debido a mejoras higiénico- ambientales y al uso adecuado de sales de rehidratación oral. A su vez, la tasa de egresos hospitalarios por GEA en niños menores de tres años ha mostrado un descenso sostenido en el Hospital Pediátrico, Centro Hospitalario Pereira Rossell (HP-CHPR), hospital de referencia nacional del subsector público de salud. 1
Entre los motivos de hospitalización por GEA predominan la deshidratación y diarrea con sangre. La diarrea con sangre y disentería representa el 20 a 30% de los motivos de ingreso; en la mayoría de los casos se trata de infecciones intestinales leves y autolimitadas, pero en algunas situaciones pueden producirse complicaciones graves como sepsis, colitis hemorrágica y síndrome urémico hemolítico (SUH) 4,5,6,7,8,9,10,11.
Los patógenos bacterianos asociados con diarrea con sangre son especies de Shigella, Campylobacter, Salmonella, Escherichia coli patógeno entérico especialmente E. coli productora de toxina Shiga (STEC) y E. coli enteroinvasiva (EIEC), así como Yersinia enterocolitica. La prevalencia de estos agentes y sus patrones de susceptibilidad a los antimicrobianos varían entre las diferentes regiones 6,8,12,13.
Con motivos de gestionar la hospitalización por cohortes, en Uruguay se recomienda la solicitud de coprovirológico y coprocultivo a todo niño que requiera ser hospitalizado por diarrea con sangre, sospecha de sepsis enteral o ante un síndrome urémico hemolítico 14. Además desde el año 2017 en el HP- CHPR está disponible para casos seleccionados la detección de agentes de gastroenteritis por reacción en cadena de polimerasa en tiempo real (RT- PCR por su sigla en inglés) en heces utilizando el panel gastrointestinal de Biofire® FilmArray® que incluye la detección de ácidos nucleicos de bacterias, virus y parásitos 15.
La diarrea con sangre y disentería son motivos frecuentes de prescripción de antimicrobianos. Las recomendaciones nacionales e internacionales sugieren indicar antibióticos en todos los casos de disentería y en aquellos de diarrea con sangre leve según la situación clínico- epidemiológica particular. Teniendo en cuenta el agente involucrado, el tratamiento con antibióticos está indicado en casos de infecciones por Shigella y en situaciones especiales de infecciones por Campylobacter, Yersinia y Salmonella, principalmente en niños con riesgo de enfermedad invasiva 14,16,17,18.
A pesar de que las recomendaciones de abordaje y tratamiento se encuentran difundidas entre el equipo de salud, es necesario realizar periódicamente seguimiento y vigilancia epidemiológica de los principales agentes enteropatógenos, así como analizar su patrón de susceptibilidad a los antibióticos para evaluar la adecuación de estas.
Objetivo
Describir la etiología y las características clínico- evolutivas de los niños menores de 15 años hospitalizados por diarrea con sangre en el Hospital Pediátrico, Centro Hospitalario Pereira Rossell entre los años 2012- 2023.
Metodología
Se realizó un estudio observacional, descriptivo, retrospectivo. Se incluyeron todos los niños menores de 15 años hospitalizados por diarrea con sangre entre 1 de enero de 2012 al 31 de diciembre de 2023 en el HP-CHPR. Se excluyeron los casos de diarrea intrahospitalaria y diarrea crónica.
Fuente de información
Revisión de historias clínicas formato papel, electrónico y bases de datos del laboratorio de microbiología. Para la recolección de datos se utilizó una ficha precodificada diseñada para el estudio. Se registraron las siguientes variables: edad, sexo, estado nutricional, estado de hidratación, motivo de hospitalización, agente enteropatógeno identificado, estudios complementarios solicitados, tratamientos (prescripción de antimicrobianos, tipo, vía, duración), días de hospitalización, ingreso a Unidad de Cuidados Intensivos (UCI), días de estadía en UCI, complicaciones, fallecimientos.
A efectos de este estudio se consideró:
Diarrea: presencia de 3 o más deposiciones líquidas o semilíquidas en 12 horas o una sola con sangre o mucopus en 12 horas (menores de 2 años), presencia de 2 o más deposiciones líquidas o semilíquidas en menos de 12 horas o una sola con sangre o mucopus en 12 horas (en mayores de 2 años) según definición de la O.M.S 14.
Gastroenteritis: infección enteral, de causa viral, bacteriana o parasitaria que se manifiesta por diarrea, vómitos y fiebre, cuya duración es habitualmente entre 7 y 10 días 14. Disentería: deposiciones frecuentes con sangre o mocopus acompañadas de síntomas sistémicos (dolor abdominal, tenesmo rectal, fiebre y muchas veces aspecto tóxico), cuando no se acompaña de síntomas sistémicos (formas leves) se considerará como diarrea con sangre 14.
Estudio etiológico.
Se realizó mediante coprovirológico, coprocultivo y RT- PCR en heces. El coprovirológico consistió en la detección de los agentes virales rotavirus, adenovirus y norovirus por pruebas inmunocromatográficas (CerTest® Rotavirus Adenovirus y RIDA®QUICK Norovirus). El coprocultivo incluyó la búsqueda de leucocitos fecales con coloración de azul de metileno y el cultivo en agar Salmonella-Shigella y Mac Conkey lactosa para el aislamiento de Shigella, Salmonella y Yersinia. En casos seleccionados en los que fue solicitado por el médico tratante, fundamentalmente pacientes internados en UCI, se realizó la detección de agentes de gastroenteritis por RT- PCR utilizando el panel gastrointestinal Biofire® FilmArray® que incluye la detección de ácidos nucleicos de 22 enteropatógenos, incluyendo bacterias: Campylobacter (C. jejuni/C. coli/C. upsaliensis), Clostridioides difficile (C. difficile) toxina A/B, Plesiomonas shigelloides, Salmonella, Vibrio (V. parahaemolyticus/V. vulnificus/V. cholerae), incluida la identificación específica de Vibrio cholerae, Yersinia enterocolitica, Escherichia coli enteroagregativa (EAEC), Escherichia coli enteropatógena (EPEC), Escherichia coli enterotoxigénica (ETEC), Escherichia coli productora de toxina tipo Shiga (STEC) stx1/stx2 (incluida la identificación específica del serogrupo O157), Shigella/Escherichia coli enteroinvasiva (EIEC); parásitos: Cryptosporidium, Cyclospora cayetanensis, Entamoeba histolytica, Giardia lamblia (también conocida como G. intestinalis y G. duodenalis); virus: Adenovirus F 40/41, Astrovirus, Norovirus GI/GII, Rotavirus A, Sapovirus (Genogrupos I, II, IV y V) 15.
En todos los casos en los que se detectaron agentes bacterianos recuperados por cultivo se realizó estudio de susceptibilidad. En esta serie no se incluyó el estudio de la susceptibilidad a la azitromicina dado que hasta el año 2021 no había puntos de corte clínicos para este antibiótico y Shigella en las guías internacionales.
Análisis de datos: las variables cualitativas se expresaron en frecuencias absolutas y relativas porcentuales, las variables cuantitativas en medidas de tendencia central y su rango. El análisis estadístico se realizó con el programa IBM SPSS 20.0 para Windows.
Consideraciones éticas: el protocolo de investigación contó con la aprobación de la Dirección del HP-CHPR y Comité de Ética en Investigación del centro.
Resultados
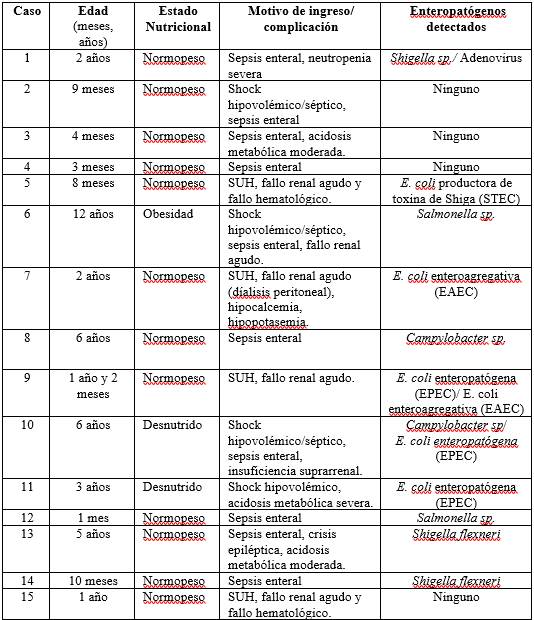
Durante el período de estudio, se hospitalizaron 229 niños menores de 15 años por diarrea con sangre/disentería, registrándose una mediana de 20 ingresos/ año (rango 7-27 ingresos).
La mediana de edad fue 8 meses (rango 16 días - 13 años), sexo masculino 61% (139/229), normopeso al ingreso 88% (201/229), bien hidratados 55% (125/229), presentaban alguna comorbilidad 11% (25/229). En la tabla 1 se expresan las características de los niños hospitalizados por diarrea con sangre.
Tabla 1: Características de los niños hospitalizados por diarrea con sangre/disentería en el Hospital Pediátrico, Centro Hospitalario Pereira Rossell, años 2012-2023. (N=229)
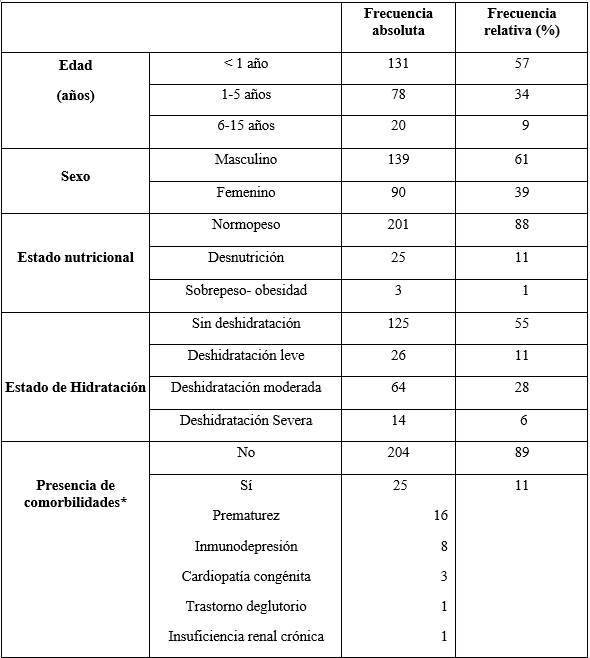
HP-CHPR: Hospital Pediátrico, Centro Hospitalario Pereira Rossell. * Se registraron niños con más de una comorbilidad.
El motivo de hospitalización más frecuente fue la diarrea con sangre/disentería sin otro síntoma acompañante 45% (104/229), seguido por diarrea con sangre/disentería con deshidratación 21% (48/229). En la tabla 2 se expresan todos los motivos de hospitalización.
Tabla 2: Motivos de hospitalización identificados en niños con diarrea con sangre/ disentería en el Hospital Pediátrico, Centro Hospitalario Pereira Rossell, años 2012-2023. (N=229)
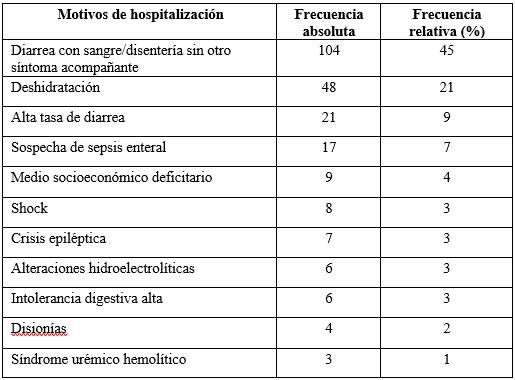
*En algunos casos se detectaron más de un motivo de hospitalización.
Se solicitó coprovirológico y/o coprocultivo en 98% (224/229) de los ingresos; a 5,2% (12) de estos niños se les solicitó también RT- PCR en materias fecales. En 2,2% (5/229) no se solicitó ningún estudio etiológico.
Se identificó al menos un agente enteropatógeno en 34,3% (77/224) de los niños, siendo el más frecuente Shigella spp. 38% (29/77), seguida por Salmonella entérica subespecie entérica 19,5% (15/77) y rotavirus 18,2% (14/77); en 12% (9/77) se detectaron coinfecciones.
Presentaron leucocitos fecales positivos (LF+) 81 de 224 (36% de las muestras recolectadas, de estas en 40 muestras se identificaron bacterias, en 8 virus y en 33 no se identificaron agentes. Las bacterias identificadas en los casos con presencia de LF+ (40) fueron: Shigella sp en 22, Salmonella en 9, Yersinia enterocolitica en 4, E. coli diarreogénica en 3 y Campylobacter sp en 2.
De los 12 casos en los que se solicitó RT-PCR, en 10 se identificó al menos un enteropatógeno: E. coli diarreogénicas en 7, Campylobacter 2, Shigella 2 y Salmonella 1; en 2 casos se detectó más de una agente. De las muestras con detección de ácidos nucleicos de Salmonella y Shigella también se recuperaron los agentes en el coprocultivo. En los dos casos en que se detectó Shigella/E. coli EIEC por PCR-RT hubo desarrollo de Shigella spp. en el coprocultivo.
En una muestra en la que la prueba inmunocromatográfica había detectado adenovirus en otra, por RT-PCR se detectó solo E. coli productora de toxina shiga (STEC), por lo que este agente viral fué considerado un falsos positivos de las pruebas antigénicas, y por tanto no fue tenido en cuenta para el cálculo de la frecuencia.
En la tabla 3 se muestran todos los resultados de los agentes identificados por coprocultivo, coprovirológico y RT-PCR.
Tabla 3: Enteropatógenos detectados mediante coprocultivo, coprovirológico y reacción en cadena de la polimerasa en niños con diarrea con sangre/ disentería. Hospital Pediátrico, Centro Hospitalario Pereira Rossell, años 2012-2023. (n=77).
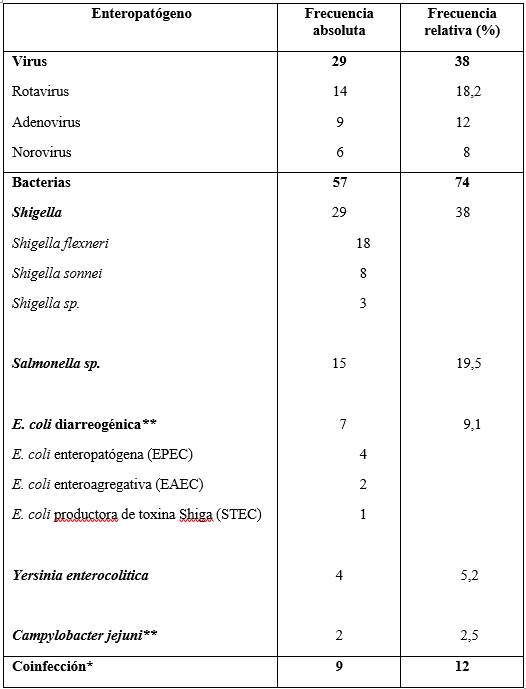
*Se registraron 9 casos de coinfecciones: Rotavirus/ Salmonella spp 2 casos, Rotavirus/ Adenovirus 2, Rotavirus/ Shigella spp 1, Adenovirus/ Shigella flexneri 1, Rotavirus/ Norovirus 1, E coli enteroagregativa (EAEC)/ E. coli enteropatógena (EPEC) 1 y Campylobacter jejuni /E. coli enteropatógena (EPEC) 1. **Los 7 casos en que se identificó Escherichia coli y los 2 con Campylobacter jejuni fueron detectados exclusivamente mediante reacción en cadena de la polimerasa en tiempo real. También se identificaron mediante esta técnica 2 casos de infección por Shigella y 1 por Salmonella.
Se realizó estudio de sensibilidad antibiótica en los 48 casos de diarrea con sangre/disentería en los que un agente bacteriano fue recuperado en el cultivo. De las 29 muestras con recuperación de Shigella spp, 18 fueron resistentes a ampicilina y 3 a trimetoprim-sulfametoxazol; no se detectó resistencia a ciprofloxacina. En el caso de Salmonella (n=15), 3 fueron resistentes a ampicilina, 1 a trimetoprim-sulfametoxazol y 6 a ciprofloxacina.
Los 4 aislamientos de Yersinia enterocolitica presentaron resistencia a ampicilina, y cefalotina pero ninguno fue resistente a ciprofloxacina ni trimetoprim sulfametoxazol. En ningún caso se observó resistencia a cefalosporinas de tercera generación.
Se prescribieron antimicrobianos en 86% (196/229) de los niños hospitalizados, en 62% (121/196) ceftriaxona, 35% (69/196) azitromicina y en 6 se indicaron inicialmente planes combinados: ceftazidima/amikacina, meropenem/metronidazol, ceftriaxona/metronidazol, cefepime/clindamicina y ceftriaxona/ampicilina/gentamicina. Los 6 niños a los que se prescribieron planes combinados no presentaban inmunodepresión conocida, pero en todos se sospechó la presencia de sepsis enteral siendo admitidos en UCI. Los antimicrobianos se adecuaron con el resultado de los cultivos y/o RT-PCR. La mediana de duración de antibioticoterapia fue 3 días (rango 1 a 14).
Requirieron ingreso a UCI 6,5% (15/229), mediana de edad 12,06 meses (rango 1 mes - 12 años), mediana de días de hospitalización en UCI fue 4 (rango 1 - 25 días). Todos presentaron complicaciones, la principal fue la sepsis enteral en 10/15, el fallo renal agudo en 5/15, en contexto de síndrome urémico hemolítico (SUH) en cuatro casos y el shock hipovolémico/séptico en 4 casos.
En los 5 casos de diarrea con sangre/disentería que presentaron fallo renal agudo, en 4/5 ocurrió en el contexto de SHU, en 1 caso acompañando el shock hipovolémico/séptico. En todos la complicación se presentó al momento de la hospitalización, la mediana de edad fue 12 meses (8 meses- 12 años). Un caso de SHU requirió sustitución de la función renal mediante diálisis peritoneal durante 4 días. Se trataba de un niño de 2 años, previamente sano, normopeso. Todos presentaron buena evolución con recuperación de la función renal. En 3/4 de los casos con SHU se identificaron agentes patógenos: E. coli productora de toxina shiga (STEC) no O157 1, E. coli enteroagregativa (EAEC) 1, E. coli entero patógena (EPEC)/ EAEC 1. El caso en que el fallo renal agudo se presentó en el contexto de shock hipovolémico/séptico se identificó Salmonella sp. en los estudios microbiológicos.
No se registraron fallecimientos. En la tabla 4 se expresan las características de los niños que ingresaron a UCI.
Discusión
La gastroenteritis aguda (GEA) es un problema de salud frecuente en la infancia. En 2015 ocasionó aproximadamente 1.3 millones de muertes en todo el mundo, ubicándose como la 4ª causa de muerte en niños menores de 5 años en países en vías de desarrollo 3. En países desarrollados la GEA es percibida como una enfermedad menor que causa importante morbilidad pero baja mortalidad, sin embargo la prevención y tratamiento acarrea altos costos sanitarios 19,20,21,22.
En Europa la GEA constituye una enfermedad frecuente con una incidencia anual de 0,5-2 episodios/año en niños menores de 3 años, correspondiendo a la segunda causa de asistencia en servicios de urgencias pediátricos 22,23.
Dentro de la GEA, la diarrea con sangre continúa siendo uno de los principales motivos de consulta y hospitalización. En América Latina la diarrea con sangre representa el 10% de los casos de diarrea aguda en niños, siendo en su mayoría menores de 5 años al igual que lo encontrado en esta serie 24.
Los agentes patógenos causantes de GEA incluyen virus, bacterias y parásitos 19-21,25. Los microorganismos asociados a diarrea con sangre/disentería son especies de Shigella, Campylobacter, Salmonella, Escherichia coli productora de toxina Shiga (STEC), E. coli enteroinvasiva (EIEC), Yersinia, así como algunos parásitos 14,25.
En esta serie las bacterias fueron los principales agentes patógenos identificados en los casos de diarrea con sangre/disentería, siendo las más frecuentes especies de Shigella y Salmonella.
Shigella flexneri y S. sonnei fueron los agentes predominantes en esta serie. Se trata del principal agente etiológico de diarrea con sangre/disentería en el mundo especialmente en países en vías de desarrollo 3,6,8,9,10,11,12,17,18,19,20,21,26,27,28. El reservorio es exclusivamente humano, ocurriendo frecuentemente transmisión intrafamiliar, en guarderías y salas de hospitalización entre otros. La transmisión ocurre por vía fecal-oral principalmente a través del contacto directo persona -persona o del consumo de agua o alimentos contaminados, así como a través del ambiente u objetos contaminados. La enfermedad puede ocurrir a cualquier edad, y manifestarse con severidad variable 8,12,13. La dosis infectante es baja y el periodo de incubación dura entre 24 a 48 horas. Existen 4 serogrupos o especies de las cuales S. flexneri es la que predomina en países en vías de desarrollo mientras que S. sonnei predominan en países desarrollados. Si bien las formas leves de enfermedad son autolimitadas, en los casos más severos el tratamiento antibiótico está recomendado 25.
Salmonella fue el segundo agente bacteriano en frecuencia detectado en este trabajo. La mayoría de los episodios de salmonelosis están asociados al consumo de alimentos contaminados principalmente aquellos que contienen huevo o derivados del mismo y por ello frecuentemente se presenta en forma de brotes epidémicos. No se encontraron nexos epidemiológicos entre los casos, desconocemos si ellos formaban parte de algún brote 26,27,28,29.
E. coli diarreogénica fue el tercer agente bacteriano en frecuencia detectado en esta serie, siendo todos los casos detectados por RT-PCR. Se describen 6 patotipos diferentes en base a la identificación de factores de virulencia específicos ya que bioquímicamente son indistinguibles entre sí y con E. coli no patogénica comensal de la microbiota intestinal.
E. coli enteropatogénica (EPEC) y E. coli enteroagregativa (EAEC) son agentes de diarrea en niños de países en desarrollo que se presentan fundamentalmente como diarrea aguda o persistente.
E. coli enteroinvasiva (EIEC) causa diarrea acuosa o disenteriforme sobre todo en pacientes adultos. EIEC está muy estrechamente relacionada con Shigella, ambas comparten la mayoría de las propiedades bioquímicas y antigénicas así como los principales factores de virulencia con lo cual se hace difícil su diferenciación. De hecho, la plataforma de RT-PCR utilizada en este trabajo no distingue entre Shigella y EIEC. En todos los casos en que se detectó Shigella/E. coli EIEC por PCR-RT hubo desarrollo de Shigella en el coprocultivo.
E. coli productora de toxina de Shiga (STEC) es un patógeno de transmisión alimentaria 6,29,30. Su importancia radica en las potenciales complicaciones, entre las que se destacan la colitis hemorrágica y el SUH. En Uruguay ocurren entre 10 a 15 casos de SUH/ año en niños menores de 5 años. La incidencia estimada es de 5 casos cada 100.000 menores de 5 años 31,32. Cabe destacar que, en otros países de la región, como Argentina, la Organización Panamericana de Salud (OPS) considera el SUH endémico con 400 casos nuevos por año, teniendo la incidencia más alta a nivel mundial. En el período 2005-2015 en el país vecino la incidencia anual de SUH en niños menores de 5 años fue de 8,5 casos cada 100.000 33. La producción de toxina Shiga constituye el factor de virulencia característico del grupo STEC 6,8. En esta serie Escherichia coli productora de toxina Shiga se detectó solo en un caso de SUH, en cambio en los otros dos casos de SUH se detectó E. coli EAEC y E. coli EAEC junto a E. coli EPEC en otro. Cabe destacar que este patógeno se buscó solo en 12 niños en los que se solicitó estudio de RT-PCR en materias fecales.
En el año 2011 ocurrió en Alemania un brote sin precedentes con más de 4000 personas afectadas, incluidos 900 casos de SUH y 54 muertes. El agente responsable era una cepa inusual de E. coli enteroagregativa O104:H4 productora de Stx2a denominada Stx-EAEC. Además, la cepa portaba genes plasmídicos de beta-lactamasas de espectro extendido (BLEE). Desde este brote se identificaron múltiples cepas con perfiles de patogenicidad similares como es el caso de Argentina que en el 2015 detectó el primer caso de SUH asociado a una cepa O59:NM H19, similar a la aislada en Alemania y con similares características de virulencia 33. En esta serie se detectó STEC no O157 en un caso de SUH. Esto es acorde a lo encontrado en estudios previos en nuestro país que demuestran que otros serogrupos distintos de O157 son más prevalentes en infecciones humanas en nuestro medio 6.
Yersinia enterocolitica es un patógeno asociado a diarrea acuosa y diarrea con sangre con baja frecuencia, pero se reportan brotes asociados al consumo de leche contaminada y vísceras de cerdo (25. En esta serie se registró en el año 2012 un brote en niños pequeños institucionalizados en un hogar de cuidados que eran alimentados con preparado para lactantes. En niños grandes la infección puede presentarse con dolor abdominal asociado a adenitis mesentérica 34.
Campylobacter spp. es otra causa importante de diarrea acuosa y de diarrea con sangre/disentería en todo el mundo. C jejuni y C. coli son las especies predominantes. C. jejuni ha sido asociado además con complicaciones tales como artritis reactiva y síndrome de Guillain-Barré.
Se trata de un bacilo Gram negativo curvo, microaerófilo y fastidioso desde el punto de vista nutricional que habita en el intestino de animales salvajes y domésticos particularmente aves. De allí que la principal fuente de infección sean los alimentos de origen animal contaminados y también el agua 3,10,11.
La mayoría de los laboratorios clínicos no son capaces de cultivar Campylobacter dado su requerimiento especial de ciertos factores de crecimiento, atmósfera microaerófila y su crecimiento más lento con respecto a las bacterias de la microbiota intestinal. Hoy en día existen técnicas inmunocromatográficas que detectan antígenos en materia fecal, así como técnicas de detección de ácidos nucleicos, pero ninguna se usa de forma rutinaria en nuestro medio si no que se aplican a un número limitado de los casos lo cual lleva a un importante subregistro de esta etiología. En esta serie Campylobacter jejuni fue detectado en 2 de 12 casos en los que se aplicó RT-PCR, lo cual es una proporción no despreciable. En un trabajo realizado en nuestro país por Bentancor y colaboradores sobre la diversidad genética de Campylobacter sp. los autores detectaron este agente en 13% de las muestras de diarrea aguda infantil estudiadas, así como en 4% de pollos parrilleros en frigorífico 35.
En esta serie en un porcentaje no despreciable se detectaron agentes virales (rotavirus, adenovirus y norovirus) en casos de diarrea con sangre/disentería. La diarrea con sangre/disentería es una presentación infrecuente de la enfermedad por rotavirus 36,37. En cambio, el adenovirus 40/41 ha sido asociado a diarrea con sangre siendo responsable de alrededor del 10% de los casos de esta entidad 38. Un factor importante al momento de establecer la etiología viral en los casos de diarrea con sangre/disentería es el método diagnóstico utilizado. En este trabajo el diagnóstico virológico se realizó en la mayoría de los casos mediante pruebas inmunocromatográficas para las cuales la presencia de sangre en la materia fecal está asociada a resultados falsos positivos, sobreestimando la frecuencia de los agentes virales. En este sentido se destaca que en este trabajo en ningún caso hubo detección de agentes virales por RT- PCR , aunque esta técnica se aplicó solo en 5,2% de los casos.
Es importante destacar que en más de la mitad de las muestras fecales estudiadas no fue posible identificar un agente patógeno causal de diarrea con sangre/disentería. Esto puede deberse a múltiples causas: el motivo principal es el número limitado de enteropatógenos que se buscan en los estudios de laboratorio utilizados en forma rutinaria (coprocultivo y coprovirológico), ya que la RT- PCR por su alto costo se utilizó en una proporción pequeña de casos. Especialmente la no inclusión de Campylobacter spp. en la búsqueda etiológica de rutina podría ser responsable de la baja recuperación de agentes bacterianos, ya que, de acuerdo con un estudio previo realizado en este centro, Campylobacter spp. ocupaba el mismo lugar en frecuencia que Shigella spp 8,10. Además, otros factores de tipo preanalítico como la prescripción de antibióticos previo a la toma de la muestra, la no utilización de medios de transporte específicos para la adecuada conservación y la demora en el procesamiento de las muestras, disminuyen el rendimiento de las técnicas microbiológicas. De todas maneras, el porcentaje de muestras fecales en las que no se logró identificar agentes patógenos fue similar al encontrado en otros estudios nacionales e internacionales, el cual ronda entre un 45 a 60% 3,19,20,22,24.
Los objetivos terapéuticos en la diarrea con sangre/disentería son la mejoría de los síntomas, prevenir complicaciones y lograr la erradicación del enteropatógeno, reduciendo el riesgo de transmisión a otras personas. Para decidir el uso empírico de antibióticos, el pediatra debe considerar aspectos epidemiológicos, clínicos y paraclínicos 24,39,40. La Organización Mundial de la Salud (OMS) recomienda la antibioticoterapia empírica para todos los niños de países en vías de desarrollo con disentería, asumiendo que la mayoría de los casos se deben a Shigella41,42.
El uso de antibióticos no está recomendado de manera rutinaria en GEA por Salmonella ya que puede favorecer la aparición de estados de portador asintomático, aumentar los efectos adversos y prolongar su excreción en heces. La terapia antimicrobiana sólo está indicada en pacientes con riesgo de bacteriemia o infección extraintestinal, pacientes con inmunodeficiencia subyacente, asplenia anatómica o funcional, terapia inmunosupresora o esteroidea, enfermedad inflamatoria intestinal y en neonatos o lactantes menores de tres meses 26,43.
Se reserva el uso de antibióticos en la infección por Campylobacter spp. para casos con formas disenteriformes y aquellos en los cuales es necesario reducir el riesgo de transmisión a contactos. Los macrólidos son la primera línea terapéutica 26,44,45,46.
Es controversial el uso de antibióticos en GEA asociada a STEC ya que la mayoría de los estudios han demostrado que el tratamiento no tiene un efecto beneficioso significativo sobre la evolución del cuadro clínico, la excreción fecal del patógeno o el riesgo de desarrollo del SUH 39,40,41,42,43,44.
Con respecto a la susceptibilidad antibiótica particularmente de Shigella sp. la frecuencia elevada de resistencia a ampicilina se ha mantenido con respecto a estudios previos mientras que la de trimetoprim-sulfametoxazol ha mostrado una disminución (8. Teniendo en cuenta la pauta nacional de tratamiento de la diarrea con sangre con azitromicina o ceftriaxona importa resaltar que en este trabajo no se detectó resistencia a cefalosporinas de tercera generación. Por otra parte, un estudio reciente realizado en este mismo centro asistencial sobre 116 aislamientos de Shigella spp. recuperados entre 2012 y 2021 encontró una frecuencia muy baja de resistencia a azitromicina, menor al 1%, lo cual avala su uso como tratamiento empírico de la shigelosis 47.
Las complicaciones más graves de niños con diarrea con sangre/disentería son la sepsis, el síndrome de Guillain Barre, colitis hemorrágica y el SUH 24. El SUH secundario a STEC representa el 80% de todos los casos de SUH en la infancia. Es una de las causas más frecuentes de insuficiencia renal aguda adquirida extrahospitalaria y la forma más frecuente de microangiopatía trombótica en niños pequeños. Se produce en el 5-10% de los pacientes infectados por STEC. Suele diagnosticarse entre los 2-14 días después del episodio diarreico. Entre los factores de riesgo se incluyen la edad menor a 4 años, sobre todo menores de 6 meses, diarrea con sangre, fiebre, leucocitosis y el tratamiento con antibióticos y/o fármacos antipropulsivos 26,48,49,50,51. El 66% de los niños ya no excretan el microorganismo cuando desarrollan el SUH, lo que refleja la utilidad de contar con técnicas moleculares con mayor sensibilidad que el cultivo. En esta serie cuatro niños presentaron SUH como complicación al momento de la consulta; se trataba de niños menores de 2 años, previamente sanos, siendo todos ingresados a UCI, presentando buena evolución. Los agentes detectados en estos casos fueron E. coli productora de toxina de Shiga no-O157, E. coli EAEC y una coinfección por E. coli EPEC y E. coli EAEC, en un caso no se detectaron agentes patógenos. Para interpretar estos resultados debemos tener en cuenta que el panel GI de FilmArray no detecta el subtipo de toxina de Shiga stx2f por lo cual en estos dos casos de SUH la presencia de STEC no puede ser descartada. Por esta misma razón ciertos patotipos de E. coli diarreogénicas pueden ser identificados erróneamente, particularmente ciertas cepas de STEC portadores de stx2f que serían identificadas como EPEC 51. Sería importante en un futuro poder recuperar las cepas de E. coli diarreogénica en cultivo para poder determinar su perfil completo de genes de virulencia en un laboratorio de referencia y así poder clasificarlas correctamente.
Conclusiones
La diarrea con sangre/disentería continúa siendo una causa importante de hospitalización en este centro asistencial, afectando en su mayoría a niños previamente sanos menores de 5 años.
Los patógenos detectados con mayor frecuencia fueron los agentes bacterianos principalmente Shigella, Salmonella y E coli diarreogénicas.
Se reportó alta prescripción de antibióticos, su selección cumplió en la mayoría de los casos con las recomendaciones y pautas nacionales e internacionales.