Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.20 no.2 Montevideo ago. 2004
Seguridad de los inhibidores selectivos de la ciclooxigenasa 2
Dres. Patricia Banchero*, Gustavo Giachetto†, Bres. Héctor Telechea‡, Noelia Speranza‡, Dra. Carolina Seade§
Departamento de Farmacología y Terapéutica. Hospital de Clínicas. Facultad de Medicina
Resumen
Los antiinflamatorios no esteroideos (AINES) constituyen uno de los grupos farmacológicos más prescritos. La toxicidad gastrointestinal limita su uso a largo plazo. En los últimos años, los inhibidores selectivos de la ciclooxigenasa (COX) 2 han sido promocionados como alternativas más seguras.
Con el objetivo de evaluar la evidencia disponible acerca de la seguridad de los inhibidores selectivos de la COX 2, se analizaron todos los ensayos clínicos que valoran la toxicidad gastrointestinal, cardiovascular y renal de este grupo de fármacos publicados en los últimos cinco años.
Hasta el momento no existen datos que permitan afirmar que la seguridad de los inhibidores selectivos de la COX 2 es claramente superior a la de los AINES clásicos. El ensayo VIGOR es el único que ha mostrado un beneficio en la reducción de las complicaciones de la úlcera gastroduodenal, pero ha suscitado el problema, aún no resuelto, de sus efectos protrombóticos. Es probable que los efectos adversos renales sean similares a los de los AINES clásicos.
Sólo el análisis crítico de la información biomédica permite aplicar en forma racional los datos aportados por los ensayos clínicos al tratamiento de los pacientes.
Palabras clave: INHIBIDORES DE LA CICLOOXIGENASA -toxicidad.
* Asistente del Departamento de Farmacología y Terapéutica.
† Prof. Adjunto del Departamento de Farmacología y Terapéutica, Prof. Adjunto de Clínica Pediátrica.
‡ Ayudante de clase del Departamento de Farmacología y Terapéutica.
§ Profesora Directora del Departamento de Farmacología y Terapéutica.
Correspondencia: Dra. Patricia Banchero. Departamento de Farmacología y Terapéutica, Facultad de Medicina, Universidad de la República. Hospital de Clínicas, Avda. Italia s/n 1er piso.
CP 11600.
E-mail: ggiachet@hc.edu.uy
Recibido: 3/1/03.
Reenviado para modificaciones: 16/3/04.
Aceptado: 7/5/04.
Introducción
Los antiinflamatorios no esteroideos (AINES) son uno de los grupos farmacológicos más ampliamente prescritos. La principal limitante para su uso a largo plazo es el riesgo de efectos adversos, especialmente a nivel gastrointestinal(1). En los últimos años se han desarrollado y promocionado los inhibidores selectivos de la ciclooxigenasa (COX) 2 con el objetivo de mejorar el perfil de seguridad de los AINES.
La hipótesis que se ha propuesto para justificar el desarrollo de este nuevo grupo de fármacos es la presencia de dos isoenzimas de la COX con funciones diferentes. La COX 1, expresada de manera constitutiva en células normales, es responsable de distintas funciones homeostáticas del organismo, entre ellas la protección de la mucosa digestiva. La COX 2 es una enzima inducible en respuesta a citoquinas predominantemente durante la inflamación. Esto ha llevado a plantear que la inhibición selectiva de la COX 2 es capaz de reducir el riesgo de eventos adversos gastrointestinales sin afectar la eficacia terapéutica(2,3). Sin embargo, recientemente se ha detectado en estudios in vitro la expresión constitutiva de COX 2 a nivel renal, pulmonar, uterino, intestinal y encefálico, lo que sugeriría que dicha isoenzima podría tener también un cierto papel homeostático(2-5).
Desde su lanzamiento al mercado farmacéutico a partir de 1998, múltiples ensayos clínicos han sido publicados evaluando la eficacia de los inhibidores selectivos de la COX 2. En éstos no se ha demostrado que su eficacia analgésica y antiinflamatoria sea superior a la de los AINES no selectivos(2,5). El objetivo de esta revisión es analizar la evidencia disponible acerca de su seguridad.
Seguridad gastrointestinal
El riesgo de hospitalización por complicaciones de la úlcera gastroduodenal (sangrado, perforación, obstrucción) en individuos que no consumen AINES es de 0,2% por año. El uso de AINES incrementa este riesgo cuatro veces(6). El riesgo de complicaciones por AINES aumenta con la edad, el antecedente personal de úlcera gastroduodenal, y la asociación con glucocorticoides(1). Varía según el tipo de AINE empleado (figura 1) y la dosis prescrita.
Se han diseñado múltiples estrategias para minimizar el riesgo de complicaciones gastrointestinales(6,7):
– Cuando la inflamación no juega un rol fundamental, como, por ejemplo, en la artrosis, se recomienda prescribir fármacos analgésicos con mínimo riesgo de efectos gastrointestinales, como el paracetamol o la dipirona.
– Seleccionar aquellos AINES con menor incidencia de efectos adversos gastrointestinales.
– Prescribir la mínima dosis efectiva durante el mínimo tiempo necesario.
– Utilizar fármacos con cubierta entérica, supositorios o formas de liberación sostenida. No se ha demostrado que el uso de estas formulaciones disminuya la incidencia de ulceración gastrointestinal, dado que su capacidad para inhibir la síntesis de prostaglandinas se mantiene.
– Uso de inhibidores de la secreción ácida gástrica. El misoprostol, análogo de prostaglandina E1, ha mostrado prevenir la úlcera gastroduodenal en pacientes de alto riesgo tratados con AINES, pero su elevado costo y el perfil de efectos adversos impiden generalizar su uso. Ni los inhibidores de la bomba de protones ni los antagonistas del receptor histaminérgico H2 han mostrado un claro beneficio en la prevención de las complicaciones de la úlcera gastroduodenal(8).
– Inhibición selectiva de la COX 2. Sin embargo, como se muestra en la figura 1, no se ha observado una relación directa entre la selectividad de los AINES por esta isoenzima y menor toxicidad digestiva.
Los inhibidores selectivos de la COX 2 han sido comercializados y promocionados como analgésicos, antipiréticos y antiinflamatorios eficaces con menor riesgo de efectos adversos sobre la mucosa digestiva(9). La seguridad gastrointestinal de los inhibidores selectivos de la COX 2 ha sido evaluada en cuatro grandes ensayos clínicos.
Dos ensayos a corto plazo evaluaron la seguridad y eficacia de meloxicam. El estudio MELISSA(10) comparó la administración de meloxicam 7,5 mg/día con diclofenac 100 mg/día durante 28 días en 9.323 pacientes portadores de artrosis sintomática. El objetivo principal del estudio fue la valoración de las reacciones adversas, en especial gastrointestinales. Las variables evaluadas fueron: incidencia de complicaciones de úlcera gastroduodenal, abandono del tratamiento por eventos adversos, reacciones adversas graves y notificación por parte del paciente. No se observaron diferencias en el número de reacciones adversas graves ni en la incidencia de complicaciones de la úlcera entre ambos grupos de tratamiento. La notificación espontánea de reacciones adversas fue menor en el grupo tratado con meloxicam que en el grupo que recibió diclofenac: 27,4% versus 31,9%, p<0,001 para todas las reacciones y 13,3% versus 18,7%, p<0,001 para las digestivas. El porcentaje de pacientes que abandonaron el tratamiento fue menor en el grupo tratado con meloxicam (5,48% versus 7,96%, p<0,001).
Un segundo estudio, el SELECT(11), de diseño similar, comparó la administración de meloxicam 7,5 mg/día con piroxicam 20 mg/día durante 28 días en 8.656 pacientes portadores de artrosis sintomática. El objetivo fue similar al del estudio MELISSA. Si bien el número de complicaciones de la úlcera fue menor en el grupo tratado con meloxicam, esta diferencia no alcanzó significación estadística. Los autores atribuyen esta falta de significación estadística a la duración breve de ambos ensayos y plantean que estudios de mayor duración podrían encontrar diferencias mayores con respecto a las reacciones adversas graves. Se observaron diferencias significativas en las siguientes variables: menor notificación espontánea de reacciones adversas para el grupo meloxicam (22,5% versus 27,9%, p<0,001) a expensas de una menor incidencia de reacciones adversas gastrointestinales (10,3% versus 15,4%, p<0,001). Sin embargo, el porcentaje de abandono del estudio por reacciones adversas fue similar en ambos grupos (6% versus 7,2%, p=0,06).
Ambos estudios tienen limitaciones metodológicas. Su breve duración dificulta la evaluación del riesgo de complicaciones graves en los pacientes sometidos a tratamientos prolongados(6). Las variables más importantes en la valoración de la seguridad de los AINES (complicaciones, reacciones adversas graves) no mostraron diferencias. Se observaron diferencias en variables como la notificación espontánea de reacciones adversas y el abandono de tratamiento por reacciones adversas, que no siempre guardan relación con la presencia endoscópica de ulceración gastroduodenal ni con el riesgo de complicaciones de la úlcera(7). Ambos ensayos fueron patrocinados por Boehringer Ingelheim(10,11).
Dos ensayos clínicos controlados (CLASS y VIGOR), publicados en prestigiosas revistas, sugirieron inicialmente una ventaja de dos inhibidores de la COX 2, celecoxib y rofecoxib, en términos de tolerabilidad gastrointestinal sobre los AINES no selectivos(12). Sin embargo, posteriores análisis de los resultados de estos ensayos han cuestionado este beneficio(13).
El ensayo CLASS(14) fue realizado con el objetivo de comparar la toxicidad gastrointestinal de celecoxib 800 mg/día versus dos AINES no selectivos (diclofenac 150 mg/día e ibuprofeno 2.400 mg/día) en 8.059 pacientes portadores de artrosis o poliartritis reumatoidea (PAR) incluidos en el estudio durante 19 meses. La variable principal del estudio fue la incidencia de complicaciones de la úlcera gastroduodenal. Los resultados publicados mostraron que la incidencia de úlceras gastroduodenales sintomáticas más complicaciones de la úlcera fue menor durante los primeros seis meses de tratamiento en los pacientes tratados con celecoxib en comparación con los AINES no selectivos (2,08% versus 3,54%, p=0,02). Llama la atención que la incidencia de complicaciones de la úlcera fue menor en los pacientes tratados con celecoxib sin alcanzar significación estadística (0,76% versus 1,45%, p=0,09)(13-15).
Posteriormente, datos presentados por Pharmacia –la compañía que manufactura el celecoxib y financió el estudio CLASS– a la Food and Drug Administration (FDA) mostraron que:
– La publicación, que aparece como un ensayo clínico con tres ramas de tratamiento, presenta los resultados combinados de los primeros seis meses de tratamiento de dos ensayos clínicos: uno comparando celecoxib versus ibuprofeno (15 meses) y otro, celecoxib versus diclofenac (12 meses)(13,15-19).
– La tendencia favorable al celecoxib observada a los seis meses no se mantuvo en el análisis luego de 12 meses de tratamiento. No se observaron diferencias en la incidencia de complicaciones de la úlcera entre los tres grupos de tratamiento a los 12 meses, observándose incluso una tendencia no significativa a favor del diclofenac(13,17,18).
– Los autores conocían los resultados definitivos al momento de la publicación, pero no lo comentaron en el artículo ni lo comunicaron a la revista(13,15).
– La variable principal del estudio con la que se planteó el objetivo y calculó el tamaño muestral fue la incidencia de complicaciones de la úlcera. Dado que esta variable ya no mostraba diferencias significativas a los seis meses, se agregaron las úlceras sintomáticas para alcanzar la significación estadística(13,17,18). En los ensayos clínicos que valoran la seguridad de los AINES se recomienda reportar las variables úlcera complicada y sintomática por separado(6).
– El riesgo relativo (RR) de complicaciones de la úlcera así como de eventos adversos serios aumentan a 12 meses de tratamiento con respecto a seis meses. Es preocupante el riesgo de tratamiento a largo plazo con celecoxib(16,19).
Varias críticas han sido publicadas después de conocidos los verdaderos resultados(16,17,20,21). Las correspondientes explicaciones de los autores, también publicadas, han sido poco convincentes(15,22,23). Sin embargo, la difusión del estudio CLASS ha sido muy amplia: la revista vendió 30.000 copias de este artículo, que fue citado por otros 169 artículos, más de diez veces que cualquier otro artículo publicado en el mismo número de la revista JAMA(15). Esto coincidió con un aumento espectacular de las ventas de celecoxib(15).
Las implicancias éticas de no cumplir el protocolo propuesto, así como de publicar resultados optimistas a corto plazo, omitiendo los resultados definitivos poco alentadores, son obvias(13,15). La FDA concluye que no hay ninguna ventaja significativa del celecoxib en relación a su seguridad(16).
Por el contrario, un segundo ensayo a gran escala, el VIGOR(24), que comparó el uso de rofecoxib 50 mg/día con naproxeno 1.000 mg/día en 8.076 pacientes con PAR, mostró un beneficio indiscutible de rofecoxib en relación a la incidencia de complicaciones de la úlcera gastroduodenal (2,1% versus 4,5%, p=0,001).
Se han propuesto cuatro explicaciones para esta discrepancia(15):
– A diferencia del estudio VIGOR, en el ensayo CLASS se permitió el uso de aspirina a dosis de antiagregación (22% de los pacientes). En los pacientes que recibieron aspirina el riesgo fue cuatro veces mayor.
– El diclofenac tiene mayor selectividad por la COX 2 que naproxeno.
– La dosis de celecoxib empleada en el estudio CLASS fue superior a la recomendada.
– El rofecoxib tiene una mayor selectividad por la COX 2 que celecoxib (35 versus 7,5 veces más selectivo para COX 2 que COX 1).
Se destaca, además, que la duración de la inclusión de pacientes en el estudio VIGOR fue breve (seis meses).
En la tabla 1 se resumen los resultados de los ensayos clínicos que valoran la seguridad gastrointestinal de los inhibidores selectivos de la COX 2. Al momento actual, el único fármaco que ha mostrado reducir la incidencia de complicaciones de la úlcera gastroduodenal es el rofecoxib, no existiendo una clara ventaja de meloxicam ni celecoxib en este sentido(9).
Es de destacar que el prospecto de los coxibs incluye, por exigencia de la FDA, las mismas precauciones y contraindicaciones relativas a su toxicidad digestiva que los AINES no selectivos(9,19).
Seguridad cardiovascular
El principal evento adverso cardiovascular producido por los AINES clásicos es la retención hidrosalina e hiperpotasemia secundarias a la disminución de la síntesis de prostaglandinas a nivel renal. Puede manifestarse clínicamente por la presencia de edemas, hipertensión arterial, exacerbación de insuficiencia cardíaca o reducción de la eficacia de un tratamiento antihipertensivo(2).
Dos metaanálisis mostraron que los AINES producen una elevación media de la presión arterial de 5 mmHg, siendo piroxicam el AINE con mayor capacidad para elevarla(25).
El consumo de AINES en pacientes añosos se asocia con un mayor riesgo de hospitalización por insuficiencia cardíaca, por lo que su empleo debe ser cauteloso en este tipo de pacientes(26,27).
El ensayo VIGOR generó una nueva preocupación al mostrar un aumento del riesgo de eventos trombóticos cardiovasculares en los pacientes tratados con rofecoxib. El riesgo de infarto agudo de miocardio fue cuatro veces superior en los pacientes tratados con rofecoxib en comparación con naproxeno (0,4% versus 0,1%). Si bien la diferencia fue menor, también se observó una mayor incidencia de eventos vasculares periféricos y accidentes cerebrovasculares(19,24). Un análisis posterior presentado a la FDA mostró que el riesgo relativo de presentar un evento cardiovascular (infarto de miocardio, angina inestable, paro cardíaco, muerte súbita, accidente vascular encefálico isquémico o accidente isquémico transitorio) fue de 2,38 para el grupo tratado con rofecoxib (IC 95% 1,39 - 4,00, p<0,001). El riesgo también fue mayor en los pacientes que tenían indicación de recibir aspirina y no la recibieron por ser este un criterio de exclusión (3,9%). Es difícil establecer si este hallazgo se debe a un efecto protrombótico del rofecoxib o a un efecto cardioprotector del naproxeno, ya que este AINE a la dosis empleada tiene acción antiagregante plaquetaria similar a la aspirina(28).
El ensayo CLASS no encontró ninguna diferencia en los eventos cardiovasculares entre celecoxib y diclofenac o ibuprofeno. Se destaca que, a diferencia del estudio VIGOR, se permitió el uso de aspirina a los pacientes de riesgo para eventos trombóticos(14,18,29).
Dos publicaciones han aportado evidencia contradictoria respecto a la seguridad cardiovascular de rofecoxib:
Un análisis retrospectivo de los estudios de rofecoxib. en artrosis (fase IIB-III) no encontró diferencias en la incidencia de eventos trombóticos cardiovasculares con respecto a los AINES no selectivos(30).
Un estudio analizó todos los eventos trombóticos cardiovasculares combinados (infarto agudo de miocardio, accidente cerebrovascular, muerte de causa cardiovascular, hemorrágica o muerte súbita) ocurridos en los ensayos de rofecoxib realizados hasta setiembre de 2000. Este análisis combinado utilizó datos de pacientes individuales e incluyó información proveniente de 23 ensayos clínicos, incluyendo más de 28.000 pacientes con PAR, artrosis, lumbalgia crónica y enfermedad de Alzheimer. Se analizó el comportamiento de rofecoxib con respecto a placebo, AINES distintos del naproxeno (ibuprofeno, diclofenac, nabumetona) y naproxeno. No se encontraron diferencias en relación al placebo (RR de eventos trombóticos cardiovasculares 0,84, IC 95% 0,51-1,38) ni AINES distintos del naproxeno (RR 0,79, IC 95% 0,40-1,55). El RR fue de 1,69, IC 95% 1,07-2,69 para rofecoxib en relación a naproxeno. Es de destacar que la mayor parte de los pacientes de este subgrupo provienen del ensayo VIGOR, si bien los datos de estudios llevados a cabo en pacientes con artrosis muestran una tendencia análoga Los resultados fueron similares en el subgrupo de pacientes de alto riesgo para eventos cardiovasculares(30).
Sin embargo, este estudio presenta algunas limitaciones desde el punto de vista metodológico(30,31):
– se trata de un análisis retrospectivo de ensayos clínicos llevados a cabo con otros objetivos (valoración de la seguridad gastrointestinal, valoración de la eficacia en el tratamiento de distintas afecciones: PAR, artrosis, lumbalgia y enfermedad de Alzheimer).
– existe importante heterogeneidad en las poblaciones estudiadas; todos los ensayos llevados a cabo en enfermedad de Alzheimer (pacientes añosos, predominantemente de sexo masculino) fueron comparaciones con placebo. La comparación de rofecoxib con AINES distintos del naproxeno fue realizada exclusivamente en pacientes portadores de artrosis.
– el número bajo de eventos no permitió hacer comparaciones entre los tres AINES estudiados en el segundo grupo ni entre dosis diferentes de rofecoxib.
– en seis de los ensayos tomados en cuenta se permitió el uso de aspirina en los pacientes de riesgo, tres de ellos fueron comparaciones con naproxeno. No se analizó por separado este subgrupo de pacientes.
A partir de los resultados de este análisis, los autores sugieren que naproxeno podría tener un efecto cardioprotector y que rofecoxib no tendría un riesgo aumentado de eventos trombóticos(9,30).
Por otra parte, Mukherjee y colaboradores compararon la incidencia de eventos cardiovasculares en los ensayos CLASS y VIGOR con la del grupo placebo de un metaanálisis que valoraba el uso de aspirina en prevención primaria. La incidencia de infarto agudo de miocardio parece superior en el grupo de los coxibs, y los autores plantean que este análisis apoya la hipótesis de que los COX 2 tendrían un efecto protrombótico propio(28). Hasta octubre de 2000, se notificaron al sistema de farmacovigilancia de Estados Unidos, 99 casos de fenómenos tromboembólicos atribuidos a rofecoxib y 102 a celecoxib(28). Este estudio tiene importantes limitaciones, que los autores reconocen en la publicación, dado que no es metodológicamente válido comparar grupos provenientes de ensayos diferentes, con características basales claramente distintas(5,9,30,31). Según estos autores los inhibidores selectivos de la COX 2 afectarían en forma adversa el balance hemostático, favoreciendo la trombosis, dado que inhiben selectivamente la producción de prostaciclina-PGI2 (vasodilatadora y antiagregante) mediada por la COX 2 a nivel endotelial sin afectar la síntesis de tromboxano A2 (pro agregante), mediada por la COX 1(28,30,32,33).
Por el momento se recomienda prescribir rofecoxib con precaución a pacientes con cardiopatía isquémica, en especial a la dosis empleada en el estudio VIGOR (el doble de la recomendada por la FDA para el tratamiento de la artrosis)(2,9). Algunos autores recomiendan asociar AAS a dosis de antiagregación en los pacientes de riesgo de eventos tromboembólicos. Sin embargo, la seguridad gastrointestinal de esta asociación no ha sido estudiada y es razonable pensar que el agregado de aspirina contrarreste los efectos beneficiosos de rofecoxib sobre el tubo digestivo, de modo similar a lo ocurrido en el ensayo CLASS(9,28,30).
Este punto sólo podrá ser aclarado en forma definitiva llevando a cabo ensayos prospectivos que tengan como variable principal la evaluación de la toxicidad cardiovascular de los coxibs(9,30).
Seguridad renal
Los AINES no selectivos pueden tener una amplia gama de efectos adversos renales: insuficiencia renal aguda, retención hidrosalina (edemas, hipertensión), hiperpotasemia, hiponatremia, efectos vinculados a la reducción de la síntesis renal de prostaglandinas vasodilatadoras(2,3,7). Estos efectos son más evidentes en pacientes con insuficiencia cardíaca, hipovolemia o insuficiencia renal previa, cuya perfusión renal es más dependiente de las prostaglandinas que la de sujetos normales. Con el uso a largo plazo puede observarse nefritis intersticial crónica y necrosis papilar, cuyo mecanismo patogénico es diferente y poco conocido(2,3).
Clásicamente se ha atribuido a la COX 1 la síntesis de prostaglandinas vasodilatadoras que mantienen el flujo plasmático renal y el índice de filtración glomerular, en especial en situaciones de depleción de volumen intracelular y estimulación del sistema renina-angiotensina-aldosterona. Si bien se ha definido a la COX 2 como una enzima inducible en respuesta a los mediadores de la inflamación, recientemente se ha demostrado su expresión como enzima constitutiva en algunos tejidos, incluido el riñón. Estudios en modelos experimentales han mostrado sobreexpresión de la COX 2 en animales sometidos a depleción de volumen y en aquellos con insuficiencia cardíaca experimental, donde participaría en el mantenimiento del balance de sodio. Esto llevaría a pensar que la inhibición de la COX 2 a nivel renal puede comprometer la función renal en forma similar a los AINES no selectivos(3-5,34).
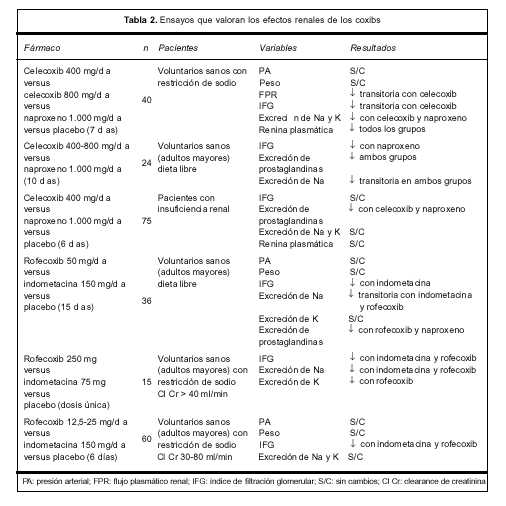
Los estudios clínicos que han evaluado este punto son contradictorios. En la tabla 2 se resumen los principales resultados de los ensayos que evalúan los efectos renales de los COX 2(3).
Estos resultados pueden explicarse por la diversidad de las poblaciones estudiadas, tanto en funcionalidad renal como en la dieta utilizada (restricción de sodio). Las variables en estudio difirieron entre los diferentes ensayos. Se estudiaron fármacos, dosis y períodos de tratamiento diferentes, y el número total de pacientes es relativamente bajo. Sin embargo, todos los estudios llevados a cabo en voluntarios sanos sugieren que los coxibs pueden afectar la fisiología renal. Por otra parte, se han reportado 14 casos de falla renal aguda e hiperpotasemia en pacientes añosos (mayores de 60 años) tratados con inhibidores selectivos de la COX 2. Si bien la falla renal revirtió con la suspensión del tratamiento, cuatro pacientes requirieron hemodiálisis. Se trataba de pacientes con factores de riesgo para nefrotoxicidad por AINES: alteración previa de la función renal, depleción de volumen o comedicación con fármacos potencialmente nefrotóxicos (diuréticos, inhibidores de la enzima conversora de angiotensina). Esto sugiere que los inhibidores selectivos de la COX 2 son capaces de producir insuficiencia renal aguda en pacientes susceptibles cuya función renal es dependiente de las prostaglandinas(3,34).
Según datos del Uppsala Monitoring Center el riesgo de reacciones adversas renales y cardiovasculares (insuficiencia cardíaca, hipertensión arterial) para rofecoxib es superior a celecoxib(33,35).
Se puede concluir que las prostaglandinas y la COX 2 juegan un papel en el mantenimiento de la homeostasis renal, en particular en pacientes con renina elevada o insuficiencia renal crónica. Con la información actualmente disponible es probable que los inhibidores de la COX 2 sean capaces de producir efectos adversos renales similares que los AINES clásicos(3,5,25).
Conclusiones
Los resultados de los ensayos clínicos publicados no demuestran claramente que los inhibidores selectivos de la COX 2 tengan perfil de seguridad superior con respecto a los AINES clásicos.
Hasta el momento, un único ensayo ha mostrado un beneficio en la reducción de las complicaciones de la úlcera gastroduodenal (ensayo VIGOR), pero ha suscitado el problema, aún no resuelto, de los efectos protrombóticos de este grupo farmacológico. Tampoco se ha demostrado una ventaja de los inhibidores selectivos de la COX 2 en relación al riesgo de efectos adversos renales.
La investigación acerca de la seguridad de los inhibidores selectivos de la COX 2 debe continuar con ensayos clínicos que tomen como variables principales las relacionadas con los eventos adversos. Es necesario llevar a cabo un metaanálisis independiente acerca de los ensayos conocidos incluyendo tanto resultados publicados como no publicados.
Los inhibidores selectivos de la COX 2 son medicamentos relativamente nuevos, cuya introducción en el mercado no tiene más de cuatro años. Actualmente, el plazo para la aprobación de un nuevo medicamento es generalmente breve. Un fármaco nuevo al momento de su lanzamiento ha sido probado en un número relativamente pequeño de pacientes en ensayos clínicos. Por lo tanto, se conoce un poco de la eficacia y seguridad de los inhibidores selectivos de la COX 2, pero nada de su efectividad. En la mayor parte de los ensayos clínicos que valoran la seguridad gastrointestinal de los AINES se excluyen los pacientes con antecedentes de enfermedad ulcerosa gastrointestinal, mientras que en la práctica clínica es frecuente la necesidad de prescribir AINES a dichos pacientes, desconociéndose el verdadero riesgo. Por lo tanto, hasta no disponer de una mejor comprensión de los efectos adversos a largo plazo de los coxibs, se recomienda prescribir estos medicamentos con precaución, informando adecuadamente al paciente de los riesgos y beneficios del tratamiento.
La "avalancha" de promoción e información a la que tiene acceso el profesional de la salud puede llevar a interpretaciones sesgadas de los resultados de ensayos clínicos, desconociéndose, como sucedió con el ensayo CLASS, los resultados definitivos. Muchos estudios son presentados exclusivamente como forma de resumen y nunca se publican. Resulta, pues, fundamental promover la lectura crítica de la información científica así como la necesidad de exigir siempre la publicación de los resultados completos antes de trasladar los hallazgos de ensayos clínicos a la práctica clínica.
Summary
Non steroid antitiflammatory drugs (AINES) are among the most frequently prescribed drugs. Gastrointestinal toxicity is determinant for its long-term use. During last years, selective cyclooxigenase 2 (COX-2) inhibitors have been promoted as safer alternative.
Clinical trials that evaluate the gastrointestinal, cardiac and renal toxocoty of these drugs published in the last five years were analyzed in order to evaluate the available evidence about the selective COX-2 inhibitors’ safety.
So far, there is no clear evidence that selective COX-2 inhibitors have a better safety profile than classic AINES. The VIGOR trial was the only one to show a reduction of gastroduodenal complications, but arose the problem –still unsolved- of cardiac toxicity. It is likely that selective COX-2 inhibitors have similar adverse events than classic AINES.
It is only through critical analysis of medical literature that information from clinical trials can be rationally used for the treatment of patients.
Résumé
Les anti-inflammatoires pas stéroïdes (AINS) constituent l’ un des groupes pharmacologiques des plus prescrits. La toxicité gastrointestinale limite son emploi à long terme. Pendant les dernières années, les inhibiteurs sélectifs de la cyclooxygenase (COX) 2 ont été promus comme une alternative plus sûre. Afin d’ évaluer ce procédé, on a analysé tous les essai cliniques qui évaluent la toxicité gastrointestinale, cardiovasculaire et rénale de ces médicaments. Il n’existe pas encore des données qui permettent d’assurer que la sécurité des inhibirteurs sélectifs de la COX 2 est clairement supérieure à celle des AINS classiques. L’essai VIGOR est le seul à montrer un bénéfice dans la réduction des troubles de l’ulcère gastroduodénale, tout en ayant le problème de ses effets prothrombiques. Il est probable que les effets adverses rénaux soient semblables à ceux des AINS classiques. Seule une analyse critique de l’information biomédicale permet d’appliquer de manière rationnelle les données des essais cliniques pour le traitement des patients.
Bibliografía
1. Begaud B, Chaslerie A, Carne X, Bannwarth B, Laporte JR, Sorbette F, et al. Upper gastrointestinal bleeding associated with analgesics and NSAID use: a case-control study. J Rheumatol 1993; 20(8): 1443-4.
2. Roberts LJ, Morrow J. Analgésicos-antipiréticos y antiinflamatorios, y fármacos antigotosos. In: Hardman J, Limbird L, Gilman R, eds. Goodman y Gilman. Las bases farmacológicas de la terapéutica. 10 ed. México: Mc Graw- Hill, 2001: 697-742.
3. Eras J, Perazella MA. NSAIDs and the kidney revisited: are selective cyclooxigenase-2 inhibitors safe? Am J Med Sci 2001; 321(3): 181-90.
4. Lipsky PE, Brooks P, Crofford LJ, DuBois R, Graham D, Simon LS, et al. Unresolved issues in the role of cyclooxigenase-2 in normal physiologic processes and disease. Arch Intern Med 2000; 160(7): 913-20.
5. McMurray RW, Hardy KJ. Cox-2 inhibitors: today and tomorrow. Am J Med Sci 2002; 323(4): 181-9.
6. Anónimo. Selective COX-2 inhibitors: are they safer NSAIDs? Therapeutics Letter, 2001, January/February; 39. http://www.ti.ubc.ca/pages/letter39.htm (consulta: nov. 2002).
7. Huang SH. Rheumatology: 7. Basics of therapy. CMAJ 2000; 163(4): 417-23.
8. Gatro-intestinal Drugs. In: Parfitt K, Sweetman SC, Blake PS, Parsons AV, eds. Martindale: the complete drug reference. 33rd ed. NewTown: Taunton, 2002: 1208.
9. Wooltorton E. What’s all the fuss? Safety concerns about COX-2 inhibitors rofecoxib (Vioxx) and celecoxib (Celebrex). CMAJ 2002; 166(13): 1692-3.
10. Hawkey C, Kahan A, Steinbruck K, Alegre C, Baumelou E, Begaud B, et al. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment. Br J Rheumatol 1998; 37(9): 937-45.
11. Dequeker J, Hawkey C, Kahan A, Steinbruck K, Alegre C, Baumelou E, et al. Improvement in gastrointestinal tolerability of the selective cyclooxigenase (COX)-2 inhibitor, meloxicam compared with piroxicam: results of the safety and efficacy large-scale evaluation of COX- inhibiting therapies (SELECT) trial in osteoarthritis. Br J Rheumatol 1998; 37(9): 946-51.
12. Lichtenstein DR, Wolfe MM. Cox-2 selective NSAIDS: new and improved? JAMA 2000; 284(10): 1297-9.
13. Laporte JM. Las supuestas ventajas de celecoxib y rofecoxib: fraude científico. Butlletí Groc 2002; 15(4): 13-5.
14. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA 2000; 284(10): 1247-55.
15. Juni P, Rutjes AW, Dieppe PA. Are selective COX 2 inhibitors superior to traditional non steroidal anti-inflammatory drugs? BMJ 2002; 324(7349): 1287-8.
16. Wright JM, Perry TL, Bassett KL, Chambers GK. Reporting of 6-month vs 12-month data in a clinical trial of celecoxib. JAMA 2001; 286(19): 2398-400.
17. Hrachovec JB, Mora M. Reporting of 6-month vs 12-month data in a clinical trial of celecoxib. JAMA 2001; 286(19): 2398-400.
18. US Food and Drug Administration. Celebrex capsules (celecoxib) NDA 20-998/S-009- Medical Officer Review. 2000. www.fda.gov/ohrms/dockets/ac/01/briefing/3677b.htm [consulta: 28/11/02].
19. Anónimo. COX-2 inhibitors update: do journal publications tell the full story? Therapeutics Letter. 2001-2002; November/December/January, 43. http://www.ti.ubc.ca/pages/letter43.htm [consulta: nov.2002].
20. Lefkowith JB, Geis GS, Silverstein F. Safety of celecoxib vs other nonsteroidal anti-inflammatory drugs. JAMA 2000; 284(24): 3123-4.
21. Kohler L, Zeidler H, Merkesdal S, Kuipers JG. Safety of celecoxib vs other nonsteroidal anti-inflammatory drugs. JAMA 2000; 284(24): 3123-4.
22. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: a randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA 2000; 284(10): 1247-55.
23. Gottlieb S. Researchers deny any attempt to mislead the public over JAMA article on arthritis drug. BMJ 2001; 323(7308): 301.
24. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343(21): 1520-8.
25. Analgesics Antiinflamatory Drugs and Antipyretics. In: Parfitt K, Sweetman SC, Blake PS, Parsons AV, eds. Martindale: the complete drug reference. 33rd ed. NewTown: Taunton, 2002: 63-6.
26. Heerdink ER, Leufkens HG, Herings RM, Ottervanger JP, Stricker BH, Bakker A. NSAIDs associated with increased risk of congestive heart failure in elderly patients taking diuretics. Arch Intern Med 1998; 158(10): 1108-12.
27. Page J, Henry D. Consumption of NSAIDs and the development of congestive heart failure in elderly patients: and underrecognized public health problem. Arch Intern Med 2000; 160(6): 777-84.
28. Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286(8): 954-9.
29. Pitt B, Pepine C, Willerson JT. Cyclooxygenase-2 inhibition and cardiovascular events. Circulation 2002; 106(2): 167-9.
30. Konstam MA, Weir MR, Reicin A, Shapiro D, Sperling RS, Barr E, et al. Cardiovascular thrombotic events in controlled, clinical trials of rofecoxib. Circulation 2001; 104(19): 2280-8.
31. Jaeschke R, Gajewski P, Brozek J. Cardiovascular thrombotic events in controlled, clinical trials of rofecoxib. Circulation 2002; 106(5): e18.
32. Frankish H. Why do COX-2 inhibitors increase risk of cardiovascular events? Lancet 2002; 359(9315): 1410.
33. Vu D, Murty M, McMorran M. Selective COX-2 inhibitors: suspected cardiovascular/cerebrovascular adverse reactions. Can Adverse React Newsl 2002; 12 (2): 1-2. http://www.hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/publicat.html [consulta: nov. 2002].
34. Perazella MA, Tray K. Selective cyclooxygenase-2 inhibitors: a pattern of nephrotoxicity similar to traditional nonsteroidal anti-inflammatory drugs. Am J Med 2001; 111(1): 64-7.
35. Zhao SZ, Reynolds MW, Lejkowith J, Whelton A, Arellano FM. A comparison of renal-related adverse drug reactions between rofecoxib and celecoxib, based on the World Health Organization/Uppsala Monitoring Centre safety database. Clin Ther 2001; 23(9):1478-91.