Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Médica del Uruguay
versión On-line ISSN 1688-0390
Rev. Méd. Urug. vol.21 no.3 Montevideo oct. 2005
Evaluación del medio cromógeno CHROMagar CandidaTM para la identificación de levaduras de interés médico
Dres. Raquel Ballesté*, Zaida Arteta†, Nora Fernández‡,
Cristina Mier§, Nélida Mousqués¶, Beatriz Xavier††,
Br. María José Cabrera‡‡, Guillermo Acosta‡‡,
Lic. Ana Combol§§, Dr. Elbio Gezuele¶¶
Departamento de Parasitología y Micología. Instituto de Higiene. Facultad de Medicina. Universidad de la República
Resumen
La incidencia de las micosis ha aumentado en los últimos años, destacándose entre ellas las candidiasis sistémicas. La especie más frecuente es Candida albicans; ésta ha sido reemplazada en 35% por otras especies de Candida "no albicans".
La criptococosis es la micosis sistémica que se encuentra en segundo lugar en frecuencia, seguida más raramente por otras.
La identificación específica de estas levaduras es un paso crucial para establecer un diagnóstico y tratamiento correcto. Los medios cromógenos resultan atractivos por la sencillez y rapidez con que establecen el diagnóstico de especie mediante el desarrollo diferencial de colonias pigmentadas; CHROMagar Candida es uno los más difundidos en nuestro país.
Los objetivos de este trabajo son determinar el desempeño diagnóstico (sensibilidad, especificidad y valor predictivo) de dicho medio con respecto a la metodología convencional y evaluar la concordancia entre ambas metodologías.
Se estudiaron 127 cepas de Candida spp., 23 Cryptococcus neoformans, 8 Rhodotorula spp. y 6 Trichosporon spp. El análisis estadístico se realizó mediante el programa EPIDAT.
Los resultados obtenidos muestran un buen desempeño diagnóstico para la identificación de C. albicans. Para la identificación de especies "no albicans" el medio pierde francamente especificidad diagnóstica, destacándose en particular los falsos positivos con C. krusei.
Se concluye que este medio es confiable para la identificación de C. albicans, pero no es posible prescindir del estudio morfológico y eventualmente de otras pruebas complementarias para el diagnóstico específico, sobre todo para cepas de Candida "no albicans" y para otros géneros, dadas sus implicancias terapéuticas.
Palabras clave: LEVADURAS - aislamiento y purificación.
CANDIDA - aislamiento y purificación.
* Médico Parasitólogo. Especialista en Laboratorio de Patología Clínica. Prof. Adj. Departamento de Parasitología y Micología. Prof. Adj. Departamento de Laboratorio Clínico del Hospital de Clínicas.
† Especialista en Medicina Interna. Asistente del Departamento de Parasitología y Micología.
‡ Médico Parasitólogo. Asistente del Departamento de Laboratorio Clínico del Hospital de Clínicas.
§ Especialista en Laboratorio Clínico.
¶ Ex Ayudante del Departamento de Parasitología y Micología.
†† Médico Parasitólogo.
‡‡ Ayudante del Departamento de Parasitología y Micología.
§§ Licenciada en Laboratorio Clínico. Departamento de Parasitología y Micología.
¶¶ Médico Parasitólogo. Prof. Agregado del Departamento de Parasitología y Micología.
Correspondencia: Dra. Raquel Ballesté
Alfredo Navarro 3051, Montevideo, Uruguay
E-mail: micol@higiene.edu.uy, ballraq@adinet.com.uy
Recibido: 24/8/04.
Aceptado: 21/1/05.
Introducción
La incidencia global de las infecciones fúngicas, tanto adquiridas en la comunidad como las nosocomiales, ha aumentado en los últimos años, existiendo en la actualidad un mayor número de personas con riesgo de adquirir micosis que en décadas previas. Si nos centramos en las infecciones causadas por levaduras del género Candida (Candida spp.) las cifras reportadas son proporcionalmente muy superiores con respecto a otras infecciones fúngicas. Las infecciones por Candida spp. afectan fundamentalmente a pacientes inmunocomprometidos, destacándose por frecuencia las candidiasis superficiales y por gravedad las candidiasis profundas en pacientes con neutropenia, recién nacidos de pretérmino, pacientes portadores de neoplasias malignas, pacientes posquirúrgicos y pacientes internados en unidades de cuidados intensivos; la mayoría de ellos sometidos a múltiples maniobras médico-quirúrgicas, terapias antibacterianas de amplio espectro, actos invasivos con catéteres intravasculares, entre otros(1-3).
Teniendo en cuenta las infecciones nosocomiales, las levaduras del género Candida ocupan el cuarto lugar entre los agentes de infecciones sistémicas y cerca de 80% de las infecciones fúngicas(4,5). La especie más frecuentemente involucrada en estas infecciones es Candida albicans, sin embargo, en aproximadamente 35% de las candidiasis sistémicas ha sido reemplazada por especies "no albicans"; estas últimas generan para el clínico dificultades terapéuticas, emergiendo con ellas nuevos patrones de sensibilidad a los antifúngicos. A modo de ejemplo mencionamos: C. krusei, que presenta resistencia intrínseca al fluconazol; C. glabrata, con un perfil de sensibilidad variable, existiendo cepas con resistencia intrínseca, y cepas que desarrollan resistencia secundaria al fluconazol, y C. guilliermondi, C. lusitaniae, C. parasilopsis, con resistencia secundaria al fluconazol. Algunos reportes a la fecha muestran cepas de C. glabrata, C. tropicalis y C. guilliermondii resistentes a la anfotericina B(5-7).
También merece especial atención Cryptococcus neoformans, agente de criptococosis, micosis profunda sistémica que afecta sobre todo a pacientes inmunodeprimidos, con una prevalencia de 10% en pacientes con sida y una letalidad entre 15% y 40%(8-10). Cabe destacar que si bien esta micosis produce frecuentemente sintomatología neurológica, lo que motiva el estudio del líquido cefalorraquídeo, con el cual se establece el diagnóstico en la mayoría de los casos, también en un porcentaje considerable de pacientes el diagnóstico se realiza a partir de muestras de hemocultivos. Además, esporádicamente otras levaduras pueden ser agentes de infecciones sistémicas (en grupos específicos de pacientes), destacándose, entre ellas, Trichosporon spp, Rhodotorula spp y Sacharomyces spp. Si bien estas últimas tienen una incidencia menor, es de relevancia conocerlas para realizar el diagnóstico en forma oportuna(11).
La identificación correcta y presencia del agente causal es la base para la caracterización epidemiológica de las infecciones así como para la elección del tratamiento etiológico correcto(12).
Varios métodos comerciales se encuentran en el mercado para la identificación de levaduras patógenas, utilizando diferentes características de las mismas, como la morfología macro y microscópica y la asimilación de carbohidratos. Estos métodos facilitan la identificación de levaduras y se basan en la metodología convencional(13). En los últimos años se ha promovido el uso de medios cromógenos como: Yeast Médium Aniline Blue(14), Fluoro-plate(15,16), Candichrom(17), Albicans ID, Candiselect(18), CDA(19) y más recientemente CHROMagar Candida(20-24); estos métodos resultan muy atractivos por la sencillez y rapidez con que se obtiene el diagnóstico de especie, al objetivarse el desarrollo de colonias pigmentadas.
El CHROMagar Candida es uno de los medios cromógenos más difundidos en nuestro medio, siendo utilizado en algunos laboratorios de nuestro país para la identificación de levaduras del género Candida como lo especifica el fabricante. Con el CHROMagar Candida se han reportado datos variados de sensibilidad y especificidad en la identificación de las diferentes especies dentro del género(25,26). También es utilizado como un medio de aislamiento e identificación primaria de levaduras, en general a partir de diferentes especímenes biológicos, lo que es aún muy discutido(21,27,28), dado que puede conducir a errores en el diagnóstico micológico si la levadura que se encuentra en la muestra no corresponde al género Candida. Por este motivo, algunos autores recomiendan considerar, además de la coloración que toma la colonia, el morfotipo de las mismas (rugosa, lisa, halo alrededor, naviculadas, umbilicación central, etcétera)(29).
Dado el uso cada vez más frecuente en los laboratorios de nuestro país de este medio cromógeno, consideramos de interés evaluar el CHROMagar Candida para la identificación de levaduras de interés médico, planteándonos los siguientes objetivos:
a) Determinar la sensibilidad y especificidad diagnóstica del CHROMagar Candida con respecto a la metodología convencional para la identificación de levaduras del género Candida.
b) Evaluar el comportamiento del método CHROMagar Candida cuando se incluyen levaduras de otros géneros como Cryptococcus, Trichosporon y Rhodotorula en dicho medio.
c) Evaluar la concordancia para cada especie de Candida y para el total de las especies entre ambas metodologías.
Material y método
Cepas estudiadas: se estudiaron un total de 127 cepas de Candida spp. De ellas, 100 se aislaron de pacientes a partir de diferentes especímenes biológicos (hemocultivo, lavado bronquioloalveolar, líquido peritoneal, punta de catéter, entre otras); las 27 restantes correspondieron a cepas de referencia: 17 procedentes de la Micoteca del Departamento de Parasitología y Micología del Instituto de Higiene (IHM) y 10 del American Type Culture Collection (ATCC) del National Committee for Clinical Laboratory Standards (NCCLS). Estas 27 últimas estaban tipificadas como: C. albicans 14, C. parapsilopsis 4, C. tropicalis 2, C. krusei 2, C. guilliermondii 2, C. glabrata 1, C. robusta 1 y C. intermedia 1.
Para evaluar el comportamiento de levaduras de otros géneros en el medio cromógeno en estudio se utilizaron cepas de la Micoteca del IHM: Cryptococcus neoformans 23, Rhodotorula spp. 8 y Trichosporon spp. 6.
El número y la proporción numérica entre los géneros incluidos en el estudio se seleccionaron considerando la prevalencia de las micosis sistémicas por levaduras en nuestro medio. En este contexto destacamos que en la práctica diaria las levaduras del género Candida son las más frecuentemente aisladas a partir de líquidos biológicos, seguidas por el género Cryptococcus y excepcionalmente por otros.
Metodología de tipificación: las cepas aisladas de las diferentes muestras de pacientes fueron procesadas mediante examen micológico directo y cultivos; las mismas se reaislaron e identificaron a partir de cultivos puros en agar peptonado y glucosado de Sabouraud, por medio de metodología convencional incluyendo: morfología macro y microscópica de las colonias (presencia o ausencia de cápsula, producción de pigmento, tamaño, forma, entre otros), sensibilidad a la cicloheximida, crecimiento a temperaturas diferenciales, producción de tubos germinales, asimilación de hidratos de carbono en aerobiosis (auxanograma) y anaerobiosis (zimograma). Esta metodología es considerada como técnica de referencia o "gold standard" para la identificación de levaduras(30-33).
Todas las cepas se sembraron en CHROMagar Candida siguiendo las indicaciones del fabricante (CHROMagarTM, marca registrada Dr. A Rambach, París, Francia), incubándose a 37ºC con lectura final a las 48 horas, tipificándose la cepa según el color de la colonia: C. albicans (color verde), C. tropicalis (color azul), C. krusei (color rosado-fucsia) y "otras especies" (color blanco-amarillo).
Análisis estadístico: se realizaron los cálculos correspondientes al desempeño diagnóstico (sensibilidad, especificidad y valor predictivo) del medio CHROMagar Candida con respecto a la metodología convencional en forma diferencial para las levaduras de los distintos géneros. Para evaluar la concordancia entre los métodos se empleó el estadístico k (kappa).
Se utilizó para todos los cálculos el programa EPIDAT (análisis epidemiológico para datos tabulados, versión 2.0 para Windows, Xunta de Galicia).
Resultados
Tipificación de cepas
Las cepas de Candida spp. aisladas de muestras biológicas fueron identificadas por metodología convencional; la frecuencia relativa de especies incluyendo las cepas de referencia antes mencionadas fue la siguiente: 77 C. albicans, 23 C. parasilopsis, 8 C. guilliermondii, 6 C. tropicalis, 4 C. krusei, 3 C. glabrata, 2 C. lipolytica, 1 C. famata, 1 C. lusitaniae, 1 C. robusta, 1 C. intermedia. (tabla 1, figura 1).
Las mismas cepas fueron identificadas por CHROM agar como: 70 C. albicans, 22 C. krusei, 6 C. tropicalis y 29 "otras especies" (tabla 1, figura 1).
Desempeño diagnóstico del medio cromógeno
El análisis estadístico para valorar el desempeño diagnóstico del medio cromógeno CHROMagar Candida para el diagnóstico de C. albicans mostró los siguientes resultados:
Para las cepas de Candida spp. en su totalidad (cepas de referencia y cepas aisladas de muestras clínicas) el método presentó una sensibilidad y especificidad diagnóstica de 88% y 96%, respectivamente, con un valor predictivo de la prueba positiva (VPPP) de 97% y un valor predictivo de la prueba negativa (VPPN) de 84% calculados para un intervalo de confianza (IC) de 95% (tabla 2).
Al analizar por separado las cepas de referencia y las de muestras biológicas encontramos diferencias en el de-sempeño diagnóstico del medio cromógeno; el mismo presentó una sensibilidad de 92% y especificidad de 94% al tipificar cepas de muestras biológicas (VPPP = 96%, VPPN = 87%), mientras que para las cepas de referencia la sensibilidad fue de 71% y la especificidad de 100% (VPPP = 100%, VPPN = 76%) calculados para un IC de 95% (tabla 2).
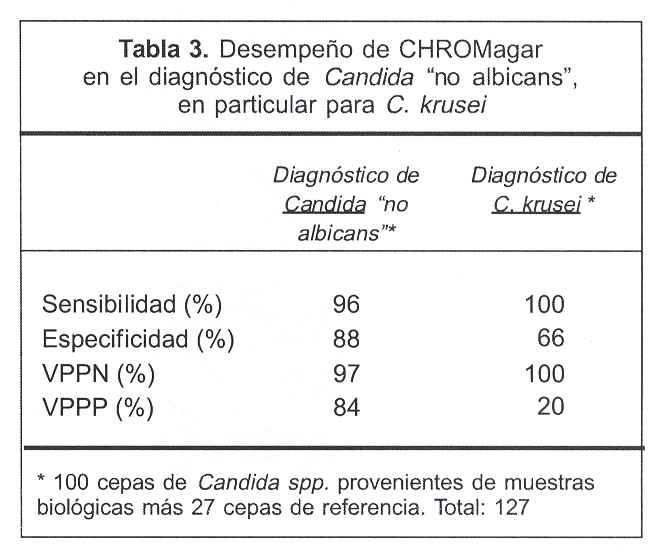
Con respecto al desempeño diagnóstico de CHROM agar Candida para el diagnóstico de cepas de Candida "no albicans", el método presentó una sensibilidad y especificidad diagnóstica de 96% y 88%, respectivamente, con VPPP de 84% y VPPN de 97%; el desempeño diagnóstico específicamente para C. krusei mostró una sensibilidad de 100% y especificidad de 66%, con un VPPP de 20% y VPPN de 100%. Todos los cálculos se realizaron para un IC de 95% (tabla 3).
Al incluir en el estudio otros géneros de levaduras, Cryptococcus, Trichosporon y Rhodotorula, el desempeño diagnóstico del CHROMagar Candida para el diagnóstico de C. albicans mostró una sensibilidad de 88% y una especificidad de 96%, con un VPPP de 96% y un VPPN de 90%, calculados para un IC de 95% (tablas 2 y 4). Para Candida "no albicans" en general y para Candida krusei en particular presentó una sensibilidad de 93% y 100%, y especificidad de 66% y 63%, respectivamente, con un VPPP de 52% para Candida "no albicans" en general y de 12% para C. krusei calculados para un IC de 95% (tabla 4).
Concordancia
Cuando se mide la concordancia tomando las cepas diagnosticadas como C. albicans y las cepas diagnosticadas como C. tropicalis el valor de k fue de 0,71 (IC 95%; 0,39-1).
Tomando las cepas diagnosticadas como C. albicans y las diagnosticadas como C. krusei, k = 0,79 (IC 95%; 0,5-1), en tanto que tomando C. albicans y el resto de las especies de Candida "no albicans" en su conjunto, k fue de 0,86 (IC 95%; 0,75-0,97).
Discusión y conclusiones
En primer lugar destacamos la variación en la distribución de especies de Candida spp. según sean tipificadas por metodología convencional o CHROMagar Candida. Por ambas metodologías C. albicans es la especie más frecuente; sin embargo, si tenemos en cuenta la identificación por metodología convencional la segunda en frecuencia corresponde a C. parasilopsis, mientras que por CHROMagar Candida corresponde a C. krusei. Resaltamos que el conocimiento de la frecuencia de estas especies es la base para la caracterización epidemiológica de las candidiasis en cada región, aspecto fundamental en la indicación del tratamiento etiológico.
Al analizar los resultados obtenidos, concluimos que el medio cromógeno CHROMagar Candida tiene un buen desempeño diagnóstico para la identificación de C. albicans entre levaduras del género Candida, lo que se refleja en la elevada sensibilidad y especificidad halladas; si consideramos además el VPPP para C. albicans (97%) concluimos que el método es altamente confiable para la identificación de esta especie. Sin embargo, al analizar el desempeño diagnóstico del medio para la identificación de cepas de Candida no albicans, éste mantiene una elevada sensibilidad perdiendo especificidad diagnóstica; si consideramos el VPPP (84%) podemos inferir que para el diagnóstico de cepas de Candida "no albicans" el método se equivoca 16 veces en 100. En este sentido, al realizar el análisis por separado entre las especies que nos permite identificar el medio cromógeno, encontramos la mayor cantidad de falsos positivos para C. krusei, ello se desprende claramente al observar el VPPP (20%), lo que significa que sólo 20% de las identificadas como C. krusei corresponden a esa especie. Este sobrediagnóstico de C. krusei tiene implicancias en la indicación terapéutica, ya que esta especie es resistente intrínsecamente al fluconazol (antifúngico de primera línea terapéutica en la mayoría de estas micosis).
Al evaluar el comportamiento del medio cuando se incluyen levaduras de otros géneros, los valores de sensibilidad y especificidad no se modifican para el diagnóstico de C. albicans. En cambio varían notoriamente para el diagnóstico de cepas de Candida "no albicans" en general y más aun para C. krusei con valores muy bajos de especificidad y con VPPP de 52% y de 12%, respectivamente. Sin embargo, es de destacar que el medio tiene un VPPN muy bueno tanto para cepas de Candida "no albicans" como para C. krusei.
En relación con la concordancia entre los métodos, si bien fue bastante alta en general, destacamos que para C. krusei y C. tropicalis es menor, y si a ello agregamos que el límite inferior del intervalo de confianza llega a 0,39 (C. tropicalis) y 0,50 (C. krusei), concluimos que para estas dos especies la concordancia no es buena. Estas conclusiones requieren de otro estudio con un número mayor de estas especies para completar correctamente la evaluación de la concordancia.
Finalmente, enfatizamos en algunos aspectos a tener presentes cuando se utiliza este medio en el algoritmo de identificación de levaduras.
– El medio es confiable sobre todo para la identificación de C. albicans.
– Recomendamos utilizar dicho medio para identificar especies de Candida luego de tener certeza de que la cepa pertenece a este género (como lo especifica el fabricante).
– Es necesario utilizar otra metodología para la identificación precisa de las especies de Candida "no albicans" identificadas por este medio.
– No es conveniente utilizar el medio para el aislamiento primario a partir de especímenes biológicos porque induce a resultados falsos positivos, fundamentalmente cuando identifica a las especies como "no albicans".
– Es de destacar, no obstante, que el medio facilita el reconocimiento de distintas especies que pueden coexistir en la misma muestra clínica.
En suma: si bien este medio puede tener utilidad en el reconocimiento rápido de C. albicans, la especie más frecuentemente aislada, debe utilizarse con reserva para el reconocimiento de las otras especies de Candida, así como también para el aislamiento primario. Ello tiene implicancias en el tratamiento del paciente, dado que la identificación correcta del agente causal puede modificar la conducta terapéutica. Por lo tanto, no es posible prescindir del estudio morfológico y eventualmente de otras pruebas complementarias para el diagnóstico específico.
Summary
The incidence of micosis especially systemic candidiasis has increased in the last years. The most frequent species is Candida albicans; that has been replaced (35%) by other "no albicans" species.
Cryptococcosis is the second most frequent systemic micosis.
The specific identification of these yeasts is a crucial step to determine an appropriate treatment. Chromogenic medium allows easily and rapidly selective identification of yeasts by differential localization of colony pigmentation; CHROMagar Candida is one of the most widespread in our country.
The objectives of the study were to determine the diagnostic value of CHROMagar Candida (sensitivity, specificity and predictive value) compared to conventional culture methods and their reliability.
We studied 127 strains of Candida spp., 23 Cryptococcus neoformans, 8 Rhodotorula spp. and 6 Trichosporon spp. EPIDAT program was used for statistical analysis.
Results showed good rates in identificating C. albicans. For "no albicans" species, this medium definitively lost diagnostic specificity, particularly in C. krusei false positive testing.
Chromogenic medium is reliable to identificate C. albicans, but complementary tests and morphologic studies are needed to selective identification of "non albicans" Candida and other strains considering their therapeutic implications.
Résumé
L’incidence des mycoses a augmenté pendant les dernières années, et parmi elles, les candidiases systémiques. L’espèce la plus fréquente est Candida albicans, qui a été remplacée en 35% par d’autres espèces de Candida "non albicans".
La cryptococcose est la mycose systémique qui occupe la deuxième place par sa fréquence.
L’identification spécifique de ces levures est une condition primordiale pour établir un diagnostic et un traitement corrects. Les méthodes chromogènes sont bonnes par la simplesse et la rapidité avec lesquelles elles établissent le diagnostic d’espèce au moyen du dévelop-pement différentiel de colonies pigmentées; CHROMagar Candida est une des plus connus chez nous.
Le but de ce travail est de déterminer la performance diagnostique (sensibilité, spécificité et valeur prédictive) de ce moyen par rapport à la méthodologie conventionnelle et d’évaluer la concordance entre les deux.
On a étudié 127 cèpes de Candida spp., 23 Cryptococcus neoformans, 8 Rhodotorula spp. et 6 Trichosporon spp. L’analyse statistique est faite avec le programme EPIDAT. Les résultats obtenus signalent une bon rendement diagnostique pour l’identification de C.albicans. Pour l’identifi-cation d’espèces "non albicans" le moyen perd franche-ment efficacité diagnostique, les faux positifs avec C.krusei étant particulièrement présents.
On tire comme conclusion que ce moyen est confiable pour l’identification de C.albicans mais qu’il n’est pas possible de se passer de l’étude morphologique et éven-tuellement d’autres épreuves complémentaires pour le diagnostic spécifique, surtout pour des cèpes de Candida "non albicans" et pour d’autres genres, tenant compte de son importance thérapeutique.
Bibliografía
1. Anaissie E, Bodey GP. Nosocomial fungal infections. Old problems and new challenges. Infect Dis Clin North Am 1989; 3(4): 867-82.
2. Anaissie EJ, Bodey GP, Rinaldi MG. Emerging fungal pathogens. Eur J Clin Microbiol Infect Dis 1989; 8(4): 323-30.
3. Diekema DJ, Messer SA, Brueggemann AB, Coffman SL, Doern GV, Herwaldt LA, et al. Epidemiology of candidemia: 3-year results from the emerging Infections and epidemiology of Iowa organisms study. J Clin Microbiol 2002; 40(4): 1298-302.
4. Trik W, Harvis W. Epidemiology of nosocomial fungal infections in the 1990s. Rev Iberoam Micol 1998; 15: 2-6.
5. Beck-Sague C, Jarwis WR. Secuelar trends in the epidemiology of nosocomial infections in the United States, 1980-1990. National Nosocomial Infections Surveillance System. J Infect Dis 1993; 167(5): 1247-51.
6. Espinel-Ingroff A, Shadomy S. In vitro and in vivo evaluation of antifungal agents. Eur J Clin Microbiol Infect Dis 1989; 8(4): 352-61.
7. Perea S, Patterson T. Antifungal resistance in pathogenic fungi. Clin Infect Dis 2002; 35(9): 1073-80.
8. Mitchell TG, Perfect JR. Cryptococcosis in the era of AIDS-100 years after the discovery of Cryptococcus neoformans. Clin Microbiol Rev 1995; 8(4): 515-48.
9. Perfect JR, Casadevall A. Cryptococcosis. Infect Dis Clin North Am 2002; 16(4): 837-74.
10. Pappalardo MC, Melhem MS. Cryptococcosis: a review of the Brazilian experience for the disease. Rev Inst Med Trop Sao Paulo 2003; 45(6): 299-305.
11. Hazen KC. New and emerging yeast pathogens. Clin Microbiol Rev 1995; 8(4): 462-78.
12. Pappas PG, Rex JH, Sobel JD, Filler SG, Dismukes WE, Walsh TJ, et al. Guidelines for treatment of candidiasis. Clin Infect Dis 2004; 38(2): 161-89.
13. Freydiere A, Guinet R. Rapid method for identification of the most frequent clinical yeast. Rev Iberoam Micol 1997; 14: 85-9.
14. Goldschmidt MC, Fung DY, Grant R, White J, Brown T. New aniline blue dye medium for rapid identification and isolation of Candida albicans. J Clin Microbiol 1991; 29(6): 1095-9.
15. Hoppe JE, Frey P. Evaluation of six commercial tests and the germ-tube test for presumptive identification of Candida albicans. Eur J Clin Microbiol Infect Dis 1999; 18(3): 188-91.
16. Bauters TG, Moerman M, Vermeersch H, Nelis HJ. Colonization of voice prostheses by albicans and non-albicans Candida species. Laryngoscope 2002; 112(4): 708-12.
17. Waller J, Koenig H, Debruyne M, Contant G. Evaluation d’un nouveau milieu d’isolement des levures et de diagnostique rapide de Candida albicans. Rev Fr Lab 1993; 252: 89-92.
18. Freydiere AM, Buchaille L, Gille Y. Comparison of three commercial media for direct identification and discrimination of Candida species in clinical specimens. Eur J Clin Microbiol Infect Dis 1997; 16(6): 464-7.
19. Cooke VM, Miles RJ, Price RG, Midgley G, Khamri W, Richardson AC. New chromogenic agar medium for the identification of Candida spp. Appl Environ Microbiol 2002; 68(7): 3622-7.
20. Bernal S, Martin Mazuelos E, Garcia M, Aller AI, Martinez MA, Gutierrez MJ. Evaluation of CHROMagar Candida medium for the isolation and presumptive identification of species of Candida of clinical importance. Diagn Microbiol Infect Dis 1996; 24(4): 201-4.
21. Silva JO, Franceschini SA, Lavrador MA, Candido RC. Performance of selective and differential media in the primary isolation of yeasts from different biological samples. Mycopathologia 2004; 157(1): 29-36.
22. Jabra-Rizk MA, Brenner TM, Romagnoli M, Baqui AA, Merz WG, Falkler WA Jr, et al. Evaluation of a reformulated CHROMagar Candida. J Clin Microbiol 2001; 39(5): 2015-6.
23. Powell HL, Sand CA, Rennie RP. Evaluation of CHROM-agar Candida for presumptive identification of clinically important Candida species. Diagn Microbiol Infect Dis 1998; 32(3): 201-4.
24. Odds FC, Bernaerts R. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol 1994; 32(8): 1923-9.
25. Scarparo C, Piccoli P, Ricordi P, Scagnelli M. Comparative evaluation of two commercial chromogenic media for detection and presumptive identification of urinary tract pathogens. Eur J Clin Microbiol Infect Dis 2002; 21(4): 283-9.
26. Momani OM. Cost-effectiveness and efficacy of CHROMagar Candida medium in clinical specimens. East Mediterr Health J 2000; 6(5-6): 968-78.
27. Yera H, Poulain D, Lefebvre A, Camus D, Sendid B. Polymicrobial candidaemia revealed by peripheral blood smear and chromogenic medium. J Clin Pathol 2004; 57(2): 196-8.
28. Horvath LL, Hospenthal DR, Murray CK, Dooley DP. Direct isolation of Candida spp. from blood cultures on the chromogenic medium CHROMagar Candida. J Clin Microbiol 2003; 41(6): 2629-32.
29. García-Martos P, García-Agudo R, Hernández-Molina J, Marín P, Tallero E, Mira J. Identificación de levaduras de Interés Clínico en el Medio de Cultivo CHROMagar Candida. Rev Iberoam Micol 1998; 15: 131-5.
30. Kwon-Chung K, JE. B. Medical Micology. Philadelphia: Lea y Febiger, 1992.
31. Bukley HR. Identification of Yeasts In: Evans EGV & Richardson MD. Medical Mycology a Practical Approach. Oxford: IRL-PRESS, 1989: 97-109.
32. Barnett JH, Payne RW, Yarrow D. Yeasts: Characteristics and Identification. London: Cambridge University Press, 1983.
33. De-Hoog GS, Guarro J, Gené J, Figueras MJ. Yeasts and Yeast-Like Fungi: explanatory Chapter, key to the Genera, and Descriptions. In: Atlas of Clinical Fungi. 2nd ed. Utrecht: Centralbureau voor Schimmelcultures, 2000: 125-236.