Introducción
Se define como hidrops la acumulación excesiva de líquido en al menos dos compartimentos fetales, incluyendo derrame pericárdico o pleural, ascitis, edema subcutáneo mayor a 5 mm. Debido a características de la circulación fetoplacentaria y al pequeño tamaño fetal, habitualmente se acompaña de polihidramnios y edema placentario (más de 4 cm de espesor en el segundo trimestre y más de 6 cm en el tercero, próximo a la inserción normal del cordón en la placenta)1,3-5. El diagnóstico es ecográfico, siendo un desafío el diagnóstico etiológico para poder realizar el seguimiento y tratamiento adecuados. Los hallazgos ecográficos generalmente son: ascitis, derrame pleural o pericárdico, edema subcutáneo, aumento del espesor placentario y cardiomegalia1,2.
El diagnóstico etiológico se realiza en 55%-60% de los casos de forma prenatal, 75%-85% con los estudios posnatales, y hasta en un 15%-20% no se encontrará una causa2. En la etiología del hidrops se puede plantear inicialmente las causas inmunes o no inmunes.
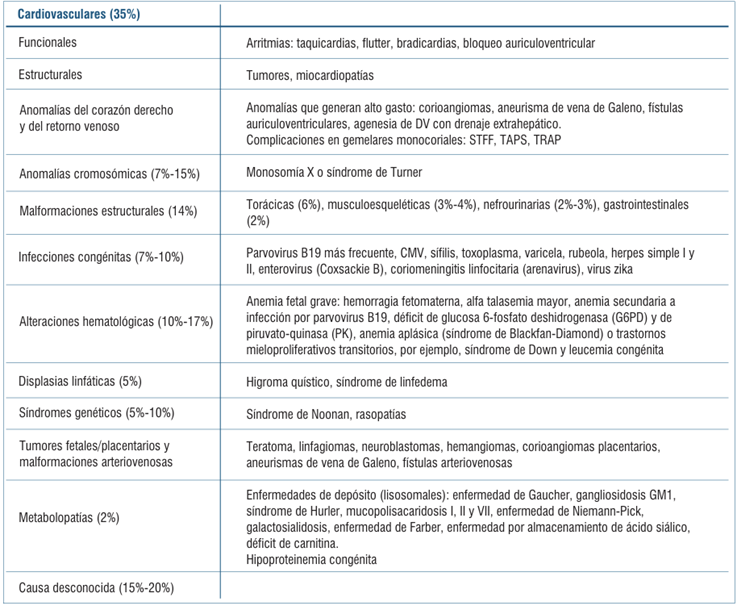
La etiología no inmune es la más frecuente, correspondiendo a alrededor de un 85%-90% del total, definida por la ausencia de anticuerpos maternos circulantes contra glóbulos rojos fetales y causa aproximadamente el 3% de las muertes neonatales. Sus principales causantes son las infecciones congénitas por el parvovirus B19 y la sífilis. Existen otras diversas etiologías para el hidrops no inmune (HNI) (tabla 1)2-5.
El hidrops inmune (HI) es causado por hemólisis fetal, mediada por anticuerpos maternos contra eritrocitos fetales que lleva a una anemia severa. Corresponde a un 10%-15% de las causas, las cuales son principalmente hemoglobinopatías (alfa talasemia) y conflicto Rh con enfermedad hemolítica perinatal (frecuencia de 1 de cada 1.500-4.000 nacimientos)1-3.
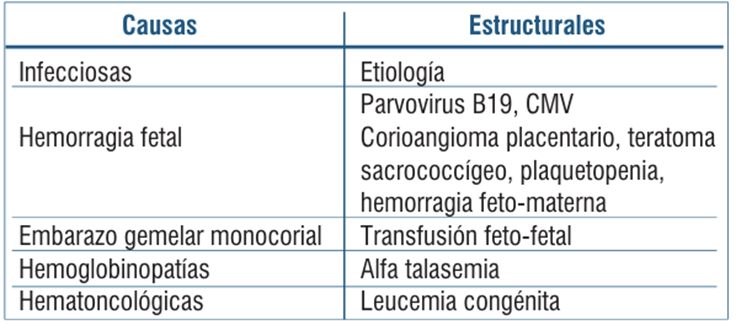
Se describen en la (tabla 2) las principales causas de anemia fetal no inmune3,4.
En cuanto a la fisiopatología, el hidrops es causado por un desequilibrio de volúmenes entre el líquido contenido en el espacio intravascular y el intersticial, debido a un aumento en su producción o disminución del retorno venoso, pudiendo considerarse como la etapa final de un proceso compensatorio fetal. El mecanismo por el cual se produce podrá diferir según la etiología, sin embargo, predomina el aumento de la presión venosa por oscilación del gasto cardíaco como mecanismo fisiopatológico1,3.
El tratamiento del hidrops depende de la etiología: transfusión intrauterina (TIU) en casos seleccionados de anemia o tecnologías complementarias (láser, coagulación de vasos nutricios, toracocentesis reiteradas o derivación toraco-amniótica y uso de antiarrítmicos en vena umbilical o digitalización transplacentaria)6,7. Son pocos los centros que ofrecen estas terapias, el equipo médico debe ser consciente de su disponibilidad y saber qué pacientes pueden beneficiarse para poder referirlos oportunamente.
El objetivo de este trabajo es analizar el caso de una gestante que requirió TIU tras diagnóstico de anemia fetal severa de etiología no aclarada.
Caso clínico
Paciente de 25 años, sana, cuatro gestas previas, dos abortos espontáneos (AE) y dos recién nacidos vivos (RNV), gestación actual de otro padre. Un hijo de sexo masculino, recién nacido a término (RNT), normopeso, sano. Una hija de sexo femenino, bajo peso al nacer (BPN) y anemia severa neonatal, presentó asfixia perinatal y plaquetopenia. Reiteró anemia de lactante que requirió una nueva transfusión, sin diagnóstico etiológico.
Referida a las 25 semanas, sin screening combinado de primer trimestre, complicada con anemia materna e hidrops fetal. Se planteó anemia severa mediante Doppler color de la velocidad sistólica máxima (VSM) de la arteria cerebral media (ACM), con valor de 80,2 cm/seg, que corresponde a 2,38 múltiplos de la mediana (MoM), estimando un riesgo de anemia fetal severa y concentración de hemoglobina (Hb) de 3,52 g/dl. Se planteó realizar una cordocentesis diagnóstica y eventualmente terapéutica (figuras 1a,1by2).
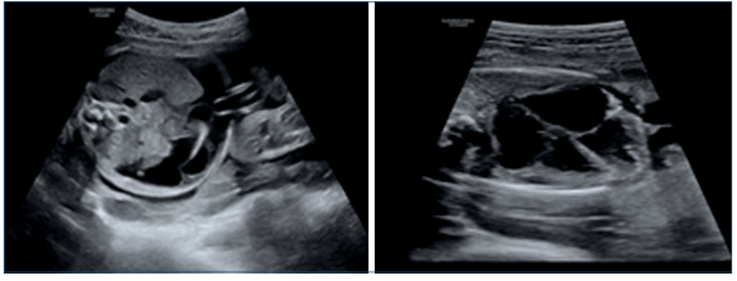
Figura 1a Corte axial del abdomen fetal (ascitis). 1b. Corte axial de 4 cámaras cardíacas, cardiomegalia fetal, derrame pericárdico leve.
La técnica de medición de la VSM se realizó de acuerdo a recomendaciones ISUOG (figura 2)5,8,9. Para la estimación de la anemia fetal se utilizó la calculadora de la FetalTest.com Medicina Fetal On Line9,10.
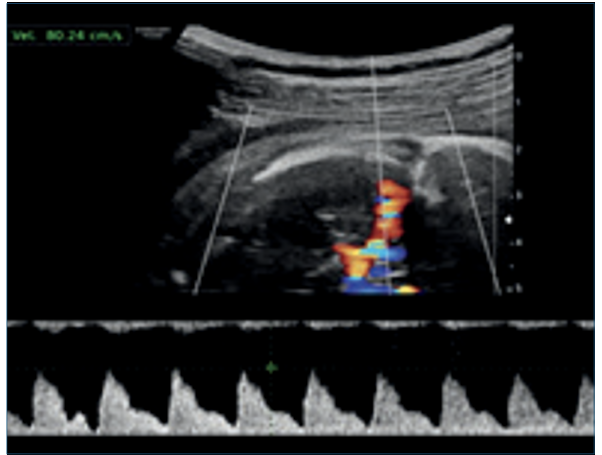
Figura 2 Corte axial de cráneo fetal, evaluación de la velocidad sistólica máxima de la arteria cerebral media. La velocidad sistólica máxima se encuentra aumentada, asociada a anemia fetal severa.
El procedimiento se realizó a las 25 semanas en block de partos de la maternidad, con consentimiento previo de la paciente. Bajo visión ecográfica, se realizó amniocentesis con extracción de líquido claro para estudio de infecciones y cordocentesis con extracción de sangre de vena umbilical, se confirmó feto A RhD positivo, test de Coombs directo negativo y se obtuvo hemograma con valores de anemia severa: Hb de 2 g/dl. Se realizó TIU de 35 ml de sangre desplasmatizada O RhD negativo, leucorreducida e irradiada, a 5 ml/minuto, con control postransfusión con valor de Hb 8,6 g/dl y Hto 25% (tabla 3)11-13. No se registraron complicaciones vinculadas al procedimiento.
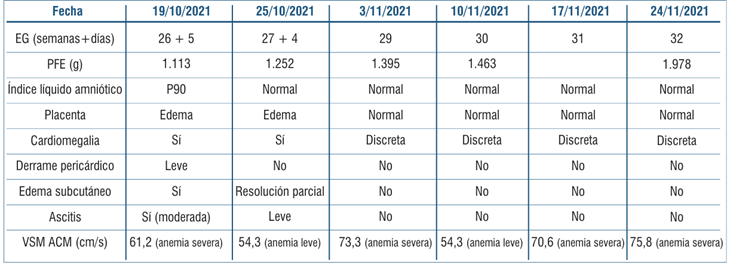
Tabla 3 Estimación de la Hb fetal mediante velocidad sistólica máxima de la arteria cerebral media con hemograma fetal en cada procedimiento realizado.
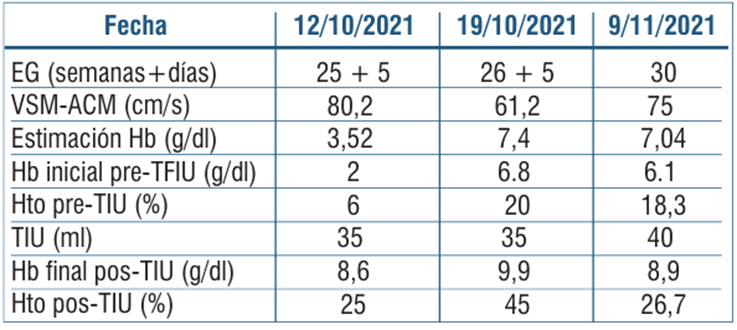
Para la programación de la segunda y posteriores transfusiones, nuestro objetivo fue mantener el Hto por encima de 25%. El seguimiento se realizó a los siete días (VSM-ACM), mostrando nuevamente anemia severa, si bien sabemos que el uso de este método se torna menos confiable luego de múltiples transfusiones. Posteriormente, requirió dos nuevas cordocentesis con TIU a las semanas 26 y 30 por presentar anemia severa (tabla 3) y (tabla 4). Luego de la segunda TIU, se observó retroceso ecográfico del hidrops, con percepción de movimientos fetales con mayor frecuencia.
En la evaluación etiológica se analizaron serologías para VIH, sífilis, VHB, VHC, CMV y parvovirus B19. Todos los resultados obtenidos fueron negativos.
Se realizó ecocardiograma fetal (semana 26), sin cardiopatía estructural. Se detectaron alteraciones funcionales: cardiomegalia, disfunción sistólica leve, insuficiencia tricuspídea significativa, lámina de foramen aneurismática con foramen no restrictivo, derrame pericárdico leve, ductus venoso normal, ritmo sinusal variable con frecuencia cardíaca normal.
Dada la persistencia de la anemia severa a las 33 semanas, se finalizó la gestación mediante cesárea, RNV, 2.280 g (p 75-90), PC 32 cm (p 75-90) y longitud de 44 cm (p 25-50). Buena adaptación inicial, llanto espontáneo, vigoroso, cordón grueso y turgente. Se realizó ligadura oportuna de cordón.
El RN presentó dificultad respiratoria precoz, lo que requirió presión positiva del final de la espiración (PEEP) no invasiva, con buena respuesta. Se diagnosticó enfermedad de membrana hialina que se trató con dos dosis de surfactante y asistencia ventilatoria mecánica. Del examen físico inicial, se destacó palidez generalizada, máculas eritematosas-violáceas generalizadas, que no desaparecen a la digitopresión y sí en la evolución. En este contexto planteamos que corresponden a focos extramedulares hematopoyéticos, como se observa en anemias severas e hidrops fetal.
Desde el punto de vista hematológico, el hemograma inicial mostró pancitopenia: Hb 6,1 g/dL, Hto 17,4%, plaquetas 101 x 103 cél/uL, leucocitos 2.250 cél/uL, neutrófilos 1.040 cél/uL, linfocitos 900 cél/uL. Presentó reticulocitosis absoluta 34,3 x 103 cél/uL, relativa 1,7% y corregida 0,7%. En la lámina periférica presentó anisocitosis, poiquilocitosis y plaquetas aisladas y dispersas. Dada la presencia de anemia severa, se realizó transfusión de sangre. Desde el tercer día de vida, eritropoyetina subcutánea por 10 días, se suspendió por falta de respuesta regenerativa.
Se reiteró hemograma postransfusión, Hb de 15,2 g/dL, Hto 43%, plaquetas 69.000 cél/uL, por lo que no se volvió a transfundir durante la internación. El hemograma al octavo día de vida fue: Hb 14 g/dL, Hto 41%, plaquetas 145 x 103 cél/uL, leucocitos 4.360 cél/uL y neutrófilos 1.310 cél/uL, reticulocitosis baja con valor absoluto: 29,6 x103 cél/uL, valor relativo 0,6%.
Presentó patrón colestásico con hiperbilirrubinemia a predominio de directa (BD): primer día de vida bilirrubina total (BT) 2,66 mg/dL (BD 1,36 mg/dL), y a los 9 días de vida: BT 3,88 mg/dL con BD 2,59 mg/dL. Etiologías infecciosas en sangre (mediante PCR) negativo (CMV, parvovirus B19, Epstein-Barr, herpes virus tipo 1, 2 y 6 y adenovirus). Cariotipo normal (46 XY), ecografías cerebrales, abdominal y ecocardiogramas normales. No hipoglucemias.
Del estudio anatomopatológico placentario se destacó edema y áreas de infarto vellositario, con un peso aumentado para la edad gestacional. Las membranas ovulares y el cordón umbilical se informaron con características habituales.
Peso mínimo de 2.066 g (descenso de 9,3% respecto al nacimiento). Recuperó su peso al nacimiento a los 13 días. Con evolución favorable, se otorgó alta al domicilio a los 13 días de vida con control coordinado para seguimiento y valoración.
Discusión
Se describe el caso de una paciente de 25 años, quinta gestación, cuyo hijo presentó anemia fetal que condicionó hidrops fetal a las 25 semanas. Se estimó un riesgo alto de anemia severa, por lo que se realizó cordocentesis y hemograma fetal que confirmó dicho diagnóstico. Requirió tres TIU y exanguinotransfusiones parciales (semanas 25, 26 y 30) de manera exitosa. El manejo prenatal que se realizó en relación con el diagnóstico, tratamiento y seguimiento del hidrops fetal, fue innovador en nuestro medio, con un abordaje terapéutico durante la gestación que favoreció una buena evolución neonatal.
La TIU constituye el tratamiento de elección de la anemia severa desde hace décadas y ha permitido mejorar el pronóstico y la sobrevida mediante su detección oportuna. Es un procedimiento invasivo a partir del cual se pueden infundir hemocomponentes y hemoderivados intraútero, accediendo a la vena umbilical a través de la pared abdominal materna14. La primera TIU fue realizada por Rodeck en 1981. En este caso se usó el abordaje intravascular percutáneo ecoguiado de la vena umbilical, técnica más utilizada porque permite controlar el volumen administrado al feto15. La TIU está indicada en caso de anemia fetal moderada o severa, si la hemoglobina fetal es dos desviaciones estándar por debajo del valor medio para la EG (<2 SD) o el Hto es menor a 30%, como lo fue en nuestro caso16.
En relación con la técnica, los posibles sitios de acceso fetal para realizar la TIU incluyen la vena umbilical, la cavidad peritoneal, la arteria umbilical y el corazón. Se prefirió la transfusión intravascular a la intraperitoneal debido a las mayores tasas de supervivencia, particularmente en fetos hidrópicos17. La cordocentesis con fines diagnósticos-terapéuticos se puede comenzar tempranamente, entre la 16 y las 34-35 semanas de gestación; sin embargo, el aumento de la relación riesgo/beneficio debe considerarse con intervenciones en embarazos avanzados17.
A pesar de ser un procedimiento realizado por personal entrenado, no está exento de complicaciones, que pueden ser graves, y en algunos casos llevar a la muerte fetal (0,9%-4,9% por procedimiento). Los factores que influyen en la aparición de complicaciones son la presencia de hidrops (hasta 20%), prematurez severa, experiencia del técnico, severidad de la anemia, transfusión en asa libre de cordón o punción arterial. La mayor tasa de mortalidad puede resultar de un feto con compromiso previo o secundario al procedimiento15,18. Los eventos adversos más frecuentes son el sangrado en el sitio de punción (20%-30%) y las desaceleraciones de la frecuencia cardíaca fetal (5% a 10%), generalmente autolimitados. Otras complicaciones son la rotura prematura de membranas, parto prematuro, infección, necesidad de cesárea de emergencia y la muerte fetal19,20.
En lo etiológico la madre no estaba aloinmunizada, ya que contaba con una investigación de anticuerpos irregulares negativa en el primer y tercer trimestre, con una técnica que permite la detección del 98% de los anticuerpos clínicamente significativos causantes de enfermedad hemolítica feto neonatal. Fueron reiterados previo a cada acto transfusional (negativos), y se realizaron pruebas cruzadas con resultado negativo con la unidad a transfundir y el suero materno21. A pesar de los resultados inmunohematológicos de rutina negativos, se amplió la búsqueda de conflictos de grupos sanguíneos privados y no encontramos que los glóbulos del feto estuvieran recubiertos de alguna inmunoglobulina que hiciera confirmar un componente inmune.
Para calcular el volumen a transfundir se tomaron en cuenta el Hto fetal inicial, tamaño del feto, Hto de los glóbulos rojos a transfundir y Hto objetivo(27,8). Antes de las 24 semanas, el Hto objetivo debe quedar como mínimo en 25% y como máximo el Hto inicial multiplicado por cuatro. A partir de las 24 semanas, nuestro Hto objetivo es del 40%-50%, de acuerdo con la bibliografía22.
Para programar la segunda y posteriores TIU nuestro objetivo fue mantener el Hto fetal por encima de 25%. El momento de la segunda TIU puede ser difícil de definir, el seguimiento con VSM-ACM ha mostrado efectividad después de la primera TIU. Detti y colaboradores reportaron que la VSM-ACM fue capaz de detectar anemia severa con 100% de sensibilidad y una tasa de falsos positivos de 6% y, por lo tanto, predecir con precisión la necesidad y el momento de la segunda TIU. Después de una TIU inicial, el umbral recomendado para el diagnóstico de anemia que requiere una segunda TIU es mayor (>1,69 MoM)23-26.
Otros autores plantean que utilizando como punto de corte el valor de 1,5 MoM, para una detección de 95%, presenta una tasa de 14%, 37% y 90% de falsos positivos, luego de la primera, segunda y tercera transfusión, respectivamente. Esto podría deberse a que las células adultas que se utilizan para la transfusión presentan menor viscosidad que las fetales27.
Se propone un manejo individualizado de los fetos con HNI, no habiendo evidencia de cuál es la edad gestacional óptima para el momento de la finalización, pudiendo alcanzar el término si hay respuesta al tratamiento. Si el feto presenta deterioro de su condición luego de la semana 34, estaría justificado el nacimiento. Lo ideal en patologías pasibles de terapia intrauterina es realizar el procedimiento oportunamente para revertir el hidrops (como fue en este caso) e intentar llevar el embarazo al término23.
En fetos sometidos a múltiples TIU, en quienes la última fue entre las semanas 34 y 35, y que se encuentran estables, se debe considerar finalizar la gestación tres semanas después de la última, dada la caída esperada del Hto y el riesgo que implicaría una nueva TIU, con el objetivo de obtener un RN sin anemia o con anemia leve o moderada. El equipo de neonatología y medicina transfusional deberá estar preparado para una eventual necesidad de transfusión neonatal, como fue en el caso que presentamos23,24.
Se decidió finalizar la gestación a las 33 semanas, dada la persistencia de anemia severa, la decisión fue individualizada comparando el riesgo de una nueva TIU y los riesgos de la prematurez en nuestro centro. A pesar de la anemia severa, el RN presentó una buena adaptación inmediata a la vida extrauterina sin elementos de hidrops, lo que tradujo la buena tolerancia de su condición previa con puesta en marcha de mecanismos compensatorios. Requirió transfusión de sangre en una oportunidad y posteriormente buena evolución.
Se analizaron las probables causas del HNI, y, sin embargo, no se logró el diagnóstico etiológico de la anemia. Dado el antecedente de hermano con anemia neonatal, se plantea como posible etiología la causa genética, pudiendo existir mutaciones de diferentes genes que condicionan la baja producción medular de eritrocitos, como en la anemia de Diamond-Blackfan, que no se pudo confirmar28,29.
El caso clínico representó un enorme desafío para el equipo tratante dada su complejidad, requiriendo un accionar coordinado de un equipo interdisciplinario integrado por gineco-obstetras, ecografía-medicina fetal, medicina transfusional y hemoterapia, enfermería, neonatología, anestesia, psicología médica y trabajo social. Destacamos la importancia de la valoración y el tratamiento en un centro de tercer nivel que cuente con todas las especialidades mencionadas en el mismo lugar, así como block quirúrgico y CTI neonatal.
Las intervenciones realizadas permitieron que naciera en mejores condiciones, evitando el óbito y con una edad gestacional más avanzada, con menores riesgos de morbimortalidad asociados a la prematurez30. No se encontraron publicaciones previas de cordocentesis para TIU en otros centros del país y tampoco hay protocolos establecidos que se puedan utilizar como guías. En Uruguay estos procedimientos se realizan con poca frecuencia, debido a que tiene una población pequeña, y hay una baja incidencia de esta patología gracias al éxito de la inmunoprofilaxis anti-D en pacientes de riesgo identificado. Es fundamental la coordinación entre los diferentes centros y la derivación de todos los casos hacia un centro de referencia, logrando una mayor experiencia en el tema.
En cuanto al RN se evitó la prematurez extrema, progresó con buen crecimiento intrauterino, y el nacimiento de un pretérmino moderado, con peso mayor a 2.000 g, que requirió dos dosis de surfactante y un período breve de ventilación mecánica (enfermedad de membrana hialina). Requirió una única transfusión de sangre desplasmatizada al nacer.
Conclusión
El hidrops fetal es una patología grave que aumenta la morbimortalidad feto neonatal, presentando un desafío para el equipo tratante dada su complejidad, requiriendo acciones interdisciplinarias de manera coordinada. El conocimiento de esta patología permite realizar un abordaje completo, orientar a la etiología, realizando un diagnóstico oportuno y la selección adecuada del tratamiento, y, cuando es consecuencia de anemia severa, definir el manejo para los fetos candidatos a TIU.
La TIU es un procedimiento que ha demostrado mejorar el pronóstico de estos fetos, si bien conlleva riesgos. Realizada por un equipo entrenado aumenta la tasa de éxito, mejorando considerablemente el resultado perinatal. Ante el diagnóstico de esta condición, el binomio debe ser derivado a un centro que cuente con los recursos para poder brindar la mejor atención.