Servicios Personalizados
Revista
Articulo
Links relacionados
Compartir
Revista Uruguaya de Cardiología
versión On-line ISSN 1688-0420
Rev.Urug.Cardiol. vol.27 no.3 Montevideo dic. 2012
Artículo original
Trasplante cardíaco
Experiencia de 15 años del Instituto de Cardiología Infantil
Dres. Beatriz Ceruti 1, Pedro Chiesa 2, Jorge Tambasco 3, Rafael Anzíbar 3, Carmen Gutiérrez 4, Aux. Enf. Sandra Barboza 5, Dres. Aníbal Manfredi 6, Ruben Leone 7
1. Pediatra. Neonatóloga. Cardióloga pediatra. Directora del Programa de Insuficiencia Cardíaca y Trasplante Cardíaco del ICI.
2. Cardiólogo pediatra. Hemodinamista pediátrico.
3. Cirujano cardíaco.
4. Profesora Agregada de Anatomía Patológica. UDELAR. Directora del Departamento de Patología Pediátrica del CHPR/ASSE.
5. Auxiliar de enfermería.
6. Cardólogo. Profesor Adjunto de Cardiología. UDELAR.
7. Cirujano cardíaco pediátrico.
Instituto de Cardiología Infantil. ICI/MUCAM.
Correspondencia: Dr. Pedro Chiesa. Correo electrónico: chiecam@adinet.com.uy.
Recibido abril 25, 2012; aceptado octubre 3, 2012
A los donantes anónimos que posibilitaron la continuación de la vida
En memoria del Dr. Víctor Nozar, pionero en el pais en el desarrollo del trasplante cardiaco
Resumen
El trasplante cardíaco es el tratamiento de elección para la insuficiencia cardíaca cuando no existe otra alternativa terapéutica que prolongue la expectativa de vida. En el año 1996 se inicia en Uruguay el Programa de Insuficiencia Cardíaca y Trasplante del Instituto de Cardiología Infantil, al realizar el primer trasplante cardíaco en un niño de 14 años. Tres años después se inicia el programa de trasplante cardíaco en adultos. Nuestro objetivo es mostrar la experiencia de trabajo en esta área.
Efectuamos un análisis descriptivo de los trasplantes cardíacos realizados en 15 años, en lo que se refiere a distribución etaria, indicaciones, protocolo inmunosupresor, técnica quirúrgica, complicaciones a corto, mediano y largo plazo, y curva actuarial de sobrevida.
Resultados: se realizaron 76 trasplantes cardíacos: 23 en niños y 53 en adultos. Referente a la etiología que motivó el trasplante: en niños menores de 1 año, 100% correspondió a cardiopatías congénitas; entre 1 y 10 años, 50% correspondió a miocardiopatía dilatada idiopática, 40% a cardiopatías congénitas y 10% a tumores; entre 11 a 17 años, 50% a cardiopatías congénitas y otro 50% a miocardiopatía dilatada idiopática. En adultos, 51% correspondió a miocardiopatía dilatada idiopática y 37% a miocardiopatía isquémica; el resto a etiología valvular y cardiopatías congénitas. Las complicaciones fueron: rechazo celular en 25%, infección bacteriana en 30%, un caso de tuberculosis peritoneal (1,3%) y tres casos (3,9%) de reactivación de citomegalovirus. Dos casos (2,6%) con complicación tumoral y en otros dos casos enfermedad vascular del injerto, en estos últimos se efectuó el retrasplante a los siete y cinco años, respectivamente, con buena evolución posterior. La sobrevida según curva actuarial a los diez años es de 70% para los adultos y de 45% para los niños.
Conclusión: el trasplante cardíaco continúa siendo una alternativa terapéutica válida en el paciente con insuficiencia cardíaca terminal.
Palabras clave:
MIOCARDIOPATíA DILATADA
TRASPLANTE CARDíACO
Summary
The cardiac transplant is the treatment of choice for the cardiac insufficiency when there is not another therapeutic alternative that prolongs the life expectancy. On December 1996 we begin the program of Cardiac Insufficiency and Transplants of the Institute of Pediatric Cardiology, achieving the first cardiac transplant in a 14-year-old child in Uruguay. Three years later we put in practice the program of cardiac transplant in adults. The objective is to show our experience in the area of cardiac transplantation. We carry out a descriptive analysis of the cardiac transplants done in 15 years, concerning age distribution, indications, immunosuppressant protocol, surgical technique, complications to short, medium and long term and actuarial survival curve.
Results: 76 cardiac transplants were done: 23 in children and 53 in adults. Regarding the etiology that led to the transplant: in children under 1 year, 100% were congenital heart disease, between 1 and 10 years, 50% were idiopathic dilated cardiomyopathy, 40% to 10% congenital heart disease and tumors; 11 to 17 years 50% to congenital heart disease and 50% to idiopathic dilated cardiomyopathy. In adults, 51% were idiopathic dilated cardiomyopathy and ischemic cardiomyopathy 37%, the rest for valvular and congenital heart disease etiology. Complications included cellular rejection in 25%, bacterial infection in 30%, a case of peritoneal tuberculosis (13%) and three cases of reactivation of cytomegalovirus (3,9%) Two cases of tumor involvement (26%). Two cases with graft vascular disease, who received a retransplant at seven and five years after transplantation, with good performance later. The actuarial survival curve according to the ten years is 70% for adults and 45% for children.
Conclusion: cardiac transplantation remains a valid therapeutic alternative in patients with terminal heart failure.
Key words:
CARDIOMYOPATHY, DILATED
CARDIAC TRANSPLANT
Introducción
El trasplante cardíaco (TxC) constituye la última alternativa en el tratamiento de la insuficiencia cardíaca clase III-IV (NYHA) y ha demostrado mejorar la calidad de vida y aumentar la sobrevida de los pacientes, aunque no está exento de complicaciones. La adecuada selección de receptor y donante así como el correcto manejo de los fármacos inmunosupresores y de las complicaciones a corto, mediano y largo plazo, son factores determinantes de la supervivencia (1-3).
El Programa de Insuficiencia Cardíaca y Trasplante del Instituto de Cardiología Infantil cuenta con un equipo formado por cardiólogos, cirujanos y personal de enfermería especializado en insuficiencia cardíaca, y con un grupo multidisciplinario de rehabilitación en el que participan nutricionistas, psicólogos, psiquiatras, trabajadoras sociales y fisioterapeutas. Los pacientes tienen acceso abierto al centro en caso de descompensación, realizándose además seguimiento telefónico. En 15 años se evaluaron en el programa 167 pacientes; a 30 se les ajustó la medicación y no fue necesario su inclusión en la lista; 10 pacientes por presentar taras asociadas no pudieron ser incluidos en lista, incluyéndose efectivamente en lista de espera para trasplante cardíaco 127 pacientes de los cuales en 76 se efectuó TxC, en 13 se efectuó resincronización cardíaca, saliendo tres de la lista, fallecieron 20 y continúan aún en lista 18 pacientes.
Durante el proceso de inclusión de un paciente como receptor deben contestarse afirmativamente tres preguntas básicas:
- ¿La condición del paciente fue lo suficientemente estudiada para concluir con certeza que la única opción terapéutica que admite es el TxC?
- ¿Luego de realizado el procedimiento, el paciente será capaz de realizar una vida funcional normal y activa?
- ¿El paciente será capaz de adherir a un régimen de tratamiento médico disciplinado: consultas, angiografías coronarias, biopsias, aun sintiéndose subjetivamente bien?
De la adecuada respuesta a las mismas dependerá la correcta selección del receptor, factor determinante de la evolución (4-7).
Analizamos las características de la población sometida a TxC en nuestro servicio, la etiología de la insuficiencia cardíaca, el tiempo de espera y su evolución y complicaciones.
Material y método
Realizamos un análisis retrospectivo de nuestra experiencia en el Programa de Insuficiencia Cardíaca y Trasplante en el Instituto de Cardiología Infantil, durante el período comprendido entre diciembre de 1996 y diciembre de 2011, en el que se realizaron 76 trasplantes cardíacos, 53 en adultos y 23 en pacientes en edad pediátrica (menores de 18 años)(figura 1).
Valoración pretrasplante: se consideran las siguientes situaciones como indicadoras de trasplante:
- Pronóstico vital inferior a los 12 meses.
- Ausencia de enfermedad sistémica.
- Ausencia de enfermedad pulmonar obstructiva crónica.
- Ausencia de enfermedad neoplásica metastásica.
- Funcionalidad renal y/o hepática normal o con insuficiencia reversible.
- Estabilidad psico-emocional-social y apoyo familiar.
- Resistencia vascular pulmonar inferior a las 6 unidades Wood y/o gradiente transpulmonar inferior a 15 mmHg, luego de efectuadas las pruebas terapéuticas, incluida la inhalación de óxido nítrico, en el estudio hemodinámico.
Una vez establecida la indicación de TxC, el paciente ingresa al módulo pretrasplante, permaneciendo internado durante 24 a 48 horas mientras se realizan los exámenes necesarios para descartar contraindicaciones. Superado este paso se lo ingresa en la lista de espera. Los exámenes se reiteran cada tres meses mientras no se realiza el trasplante. Además el paciente es registrado en el Instituto Nacional de Donación y Trasplantes, que determina, ante la existencia de un donante, cuál es el receptor adecuado.
En nuestro país, hasta el momento, para ser donante se requiere la voluntad expresa de serlo y, tratándose de un niño, la voluntad de los padres. La condición general para ser donante es la muerte cerebral.
Son contraindicaciones absolutas para ser donante: HIV positivo, hepatitis C, septicemia o enfermedad neoplásica metastásica.
La media de edad de los pacientes adultos al momento del trasplante fue de 48 años, con un desvío estándar de 12 años y una mediana de 52 años. La media de edad de los pacientes pediátricos al momento del trasplante fue de 9 años con un desvío estándar de 6 años (un intervalo de 26 días de vida a 17 años) y una mediana de 9 años (figura 2).
.Trece niños y 37 adultos eran del sexo masculino. Solo tuvimos un paciente adulto de raza negra, todos los restantes eran de raza blanca.
El TxC se efectuó con carácter urgente en 10 de los 23 niños y en 16 de los 53 pacientes adultos, ya que estaban internados con apoyo de fármacos vasoactivos (tabla 1) y/o asistencia ventilatoria mecánica. Ningún paciente se trasplantó estando en asistencia circulatoria.
Un paciente de sexo masculino de 55 años recibió un trasplante combinado corazón-riñón.
Indicaciones y etiología
Las indicaciones del TxC se muestran en la tabla 2.
En lo que respecta a las causas que motivaron el trasplante en nuestra serie, queda graficado en la figura 3. En niños menores de 1 año, 100% fue debido a cardiopatías congénitas; entre 1 y 10 años, 50% correspondió a miocardiopatía dilatada idiopática, 40% a cardiopatías congénitas y 10% a tumores; entre los 11 y 17 años, 50% a cardiopatías congénitas y el otro 50% a miocardiopatía dilatada idiopática; en adultos, 51% correspondió a miocardiopatía dilatada idiopática y 37% a miocardiopatía isquémica, el resto a etiología valvular y cardiopatías congénitas. De los 23 niños, 11 eran portadores de cardiopatías congénitas multioperados. No se registró ningún caso de TxC por miocarditis.
Las cardiopatías congénitas complejas que llevaron al TxC fueron: dextrocardia + ventrículo único + atresia pulmonar. Isomerismo izquierdo + defecto del septum auriculoventricular + aurícula única. Transposición de las grandes arterias. Atresia pulmonar + hipoplasia ramos pulmonares. Anomalía de Ebstein. Valvulopatía mitral. Estenosis aórtica. Comunicación interventricular con endocarditis tricuspídea. Ventrículo izquierdo hipoplásico. Todos los casos tenían antecedentes alejados de una o más cirugías previas.
En referencia a la relación peso donante-peso receptor en adultos, en general se toma más-menos 25% del peso del donante con respecto al peso del receptor, teniendo en cuenta que de existir hipertensión pulmonar se debe optar por un donante cuyo peso sea superior al del receptor para evitar la falla del injerto por insuficiencia cardíaca derecha posimplante inmediato. En niños, y dada la menor disponibilidad de donantes, se llega a aceptar hasta una relación peso donante-peso receptor de 4 a 1.
La técnica quirúrgica utilizada para implantar el corazón donante en nuestro servicio fue el trasplante ortotópico subtotal con anastomosis de ambas venas cavas (figura 4).
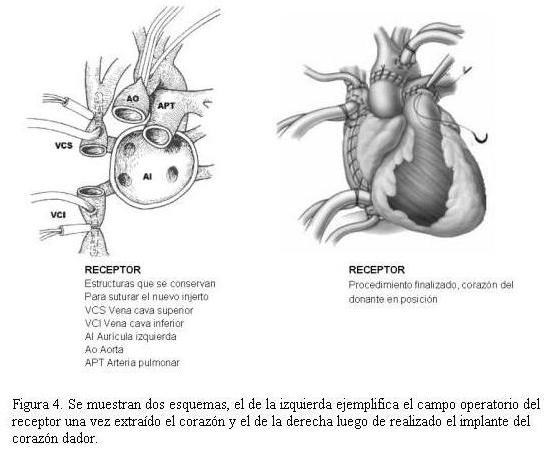
El tiempo medio de isquemia fue de 140 minutos para todos los trasplantes con un rango de 80 a 300 minutos. La ablación e implante, efectuados ambos en Montevideo, presentó una media de 120 minutos de tiempo de isquemia; mientras que cuando la ablación se efectuó en el interior del país con receptor de Montevideo o del interior, el promedio de tiempo de isquemia fue de 180 minutos. Solo diez de las ablaciones efectuadas en el interior del país se realizaron con traslado en avión (figura 5).
Postrasplante
Una vez efectuado el TxC se inicia el protocolo inmunosupresor y antiinfeccioso (tablas 3 y 4). A partir del año 2002 los corticoides se suspendieron, en todos los casos, antes del año de efectuado el trasplante. Se utilizó el anticuerpo monoclonal anti CD 25, habiendo administrado, en cada paciente, una dosis el día del trasplante y otra el día 4, controlando su administración en forma rigurosa incluyendo hemogramas seriados. Se administró un antihistamínico una hora antes del comienzo de la infusión y se evitó la administración simultánea de sangre o derivados. La ciclosporina se inicia una vez reestablecida la funcionalidad renal normal, regulando la dosis de acuerdo a su concentración en sangre, siendo deseables valores valle entre 250-300 nanogramos/ml durante el primer mes postrasplante. En el primer mes postrasplante la dosificación se efectuó dos veces por semana y luego en cada control. Dicha medicación se mantiene de por vida de no presentar efectos secundarios severos como hipertensión arterial de difícil manejo, o, en su defecto, si el paciente presenta rechazo celular reiterado se rota a tacrolimus.

Desde el año 2004 utilizamos de rutina en el posoperatorio inmediato asociado a la ciclosporina como terapia inmunosupresora el everolimus a dosis de 1,5 mg/día en dos dosis, manteniendo un nivel en sangre entre 3 y 8 ng/ml. Con dicho nivel en sangre registramos como efecto secundario en cuatro casos aftas al inicio, que retrocedieron posteriormente, y en un caso dislipemia que requirió el aumento de estatinas.
Todos los pacientes citomegalovirus negativo reciben además valganciclovir durante un período de 14 días. Se controla estrictamente la función renal.
En los primeros ocho años de nuestra serie se efectuaron 14 biopsias endomiocárdicas anuales por paciente, posteriormente se pasó a realizar la mitad de las mismas con un seguimiento ecocardiográfico seriado mediante ecocardiograma Doppler tisular y su derivada tissue tracking evaluando la aparición de un posible rechazo aun en pacientes asintomáticos, midiendo el desplazamiento de excursión del miocardio hacia el ápex en telesístole (trabajo presentado en el año 2005 en el curso de actualización en cardiopatías congénitas y trasplante cardíaco del Children’s Hospital of Philadelphia).
Se efectuó coronariografía a todos los pacientes una vez al año durante los primeros tres años y posteriormente cuando aparecieran elementos clínicos que lo ameritaran.
Resultados
En estos 15 años entraron en lista de espera para trasplante cardíaco 127 pacientes, de los cuales 20 fallecieron sin llegar al trasplante debido a progresividad lesional y a la no obtención de un corazón donante en tiempo y forma. En 13 se realizó resincronización cardíaca por estimulación biventricular, logrando que tres pacientes salieran de la lista de espera. Se realizaron 76 TxC, quedando aún en lista de espera 18 pacientes. Tuvimos un tiempo promedio en lista de espera de 36 meses para niños y de 18 meses para adultos.
El tiempo de internación promedio fue de siete días en adultos y de diez días en niños. El promedio de asistencia ventilatoria mecánica posoperatoria fue de seis horas en adultos y de 12 horas en niños. Los fármacos inotrópicos y vasoactivos utilizados (dopamina, dobutamina, milrinona y nitroglicerina), se mantuvieron en un promedio de tres días.
Mortalidad
La curva actuarial de sobrevida a los diez años fue de 45% en niños y de 70% en adultos (figura 6).
.
La mortalidad hospitalaria fue de 8%, a saber, tres pacientes portadores de cardiopatías congénitas complejas multioperados, dos pacientes con falla aguda del injerto y un paciente por sangrado incontrolable.
De los 11 niños portadores de cardiopatías congénitas tratadas que requirieron un trasplante, fallecieron siete.
Las otras causas de muerte fueron: una muerte súbita en un niño sin haber obtenido la autopsia; rechazo celular en seis pacientes: en tres casos por no haber respondido al tratamiento instituido y en otros tres casos el diagnóstico se realizó post mortem; rechazo humoral en cuatro pacientes corroborado por estudio anatomopatológico e infección en dos pacientes: un lactante de 4 meses por neumonitis a citomegalovirus y un adulto por tuberculosis.
Complicaciones precoces
Tuvimos dos casos de falla aguda del injerto y un caso de severo trastorno de la crasis, falleciendo los tres pacientes.
En el período postrasplante inmediato se observó insuficiencia renal de grado leve en dos casos, uno de ellos correspondió al paciente en que se efectuó trasplante corazón-riñón, el cual requirió hemodiálisis con buena evolución posterior (actualmente 12 años postrasplante con función renal normal).
Se observó hiperglicemia en todos los casos en los primeros días de posoperatorio, vinculada al tratamiento con corticoides, requiriendo insulina la mitad de los casos; solo los dos pacientes diabéticos tipo II continuaron con tratamiento: uno de ellos con hipoglucemiantes orales y otro con insulina.
Se observó derrame pericárdico en 25% de los casos, pero solo en dos pacientes fue necesario el drenaje del mismo por repercusión hemodinámica.
Cuatro niños presentaron convulsiones en el posoperatorio, dos de ellos vinculados a encefalopatía hipertensiva con electroencefalograma y tomografía computada de cráneo normales, con la resolución de la misma luego del tratamiento antihipertensivo.
Un paciente debió ser intervenido por hematoma subdural a los cuatro días de posoperatorio, con buena evolución. Se trató de un niño de 7 años portador de cardiopatía congénita multioperado que había presentado una caída desde su altura el día anterior al trasplante, hecho no referido por los padres al momento del TxC, evolucionando sin complicaciones y sin secuelas.
Complicaciones tardías
Las complicaciones más frecuentes dependieron del tiempo de evolución postrasplante, como se observa en las figuras 7, 8 y 9. La infección bacteriana en primer lugar y luego la viral son las que se observaron con mayor frecuencia con una incidencia similar en niños y adultos. Luego de las infecciones predominó el rechazo celular. Hemos detectado rechazo celular en seis niños con ocho episodios y en 12 adultos con 16 episodios y rechazo humoral en dos niños y en cuatro adultos. El rechazo celular grado 1 y 2 no requirió tratamiento y tuvo reversión espontánea, evidenciándose en 90% de los casos tanto en adultos como en niños. El rechazo celular grado III en niños se dio en 35% de los casos; episodios que revirtieron con push de metilprednisolona. El rechazo celular grado IV se registró en 17% de los niños cuyo dato se obtuvo de las necropsias efectuadas. En lo que respecta a adultos, 22% de los casos presentó por lo menos un episodio de rechazo grado III con buena evolución con el tratamiento con metilprednisolona. Se constató rechazo grado IV por necropsia en dos casos (3,7%). El rechazo humoral se trató con push de metilprednisolona seguido de ciclofosfamida con disminución del mismo, aunque sin desaparecer en dos casos (3,7%) desde el punto de vista anatomopatológico pero con recuperación de la fracción de eyección del ventrículo izquierdo (FEVI) y sin síntomas de insuficiencia cardíaca, mientras que en un caso fue necesario realizar plasmaféresis, falleciendo posteriormente con evidencia anatomopatológica de rechazo humoral. El restante caso se diagnosticó mediante necropsia.
.
Desde la utilización de everolimus a partir del año 2004 en 43 pacientes, no hemos tenido nuevos casos de enfermedad vascular del injerto (EVI) y en aquellos que ya la presentaban, esta no ha aumentado por lo menos hasta el momento. Cabe destacar que se realiza coronariografía. Ningún paciente tiene ecografía intraluminal. Dos pacientes, un adolescente de 14 años de edad con siete años de trasplantado (figura 10), y un paciente adulto luego de cinco años de trasplantado, presentaron EVI; ambos requirieron angioplastia coronaria con colocación de stent como puente al retrasplante, el cual se efectuó a los seis meses en el primer caso y a los dos años en el segundo. Actualmente llevan siete y tres años, respectivamente, posretrasplante, con buena evolución sin evidencia de rechazo ni EVI.
En lo referente a la función renal como complicación tardía, no la presentó ningún caso desde el punto de vista clínico, aunque 24% de los casos presentó una creatininemia entre 1,20 y 1,35 mg/dl.
Todos los pacientes reciben, además de la medicación inmunosupresora al alta, IECA o anticálcicos (diltiazem), debiendo aumentar la dosis de los mismos en 30% de los casos por hipertensión arterial.
Todos los pacientes reciben tratamiento con rosuvastatina observándose la dislipemia a pesar del tratamiento en 20% de los casos, los que requieren un aumento de la dosis de la misma y el agregado de ezetimibe.
La neoplasia se observó solo en un caso (neoplasma laríngeo) con buena evolución con tratamiento radiactivo.
Siete pacientes presentaron ateromatosis coronaria, de los cuales cinco requirieron angioplastia coronaria con colocación de stent con fármacos y a dos se les efectuó revascularización quirúrgica, todos con buena evolución.
En la figura 11 se muestra la imagen anatomopatológica de un rechazo celular de grado severo; en la figura 12 se muestra la imagen anatomopatológica de un rechazo humoral, y en la figura 13 se muestra la imagen anatomopatológica de una EVI de pacientes de nuestra casuística.
Ecocardiograma Doppler tisular
Cuarenta pacientes fueron valorados con ecocardiograma Doppler tisular, encontrando en aquellos pacientes con rechazo significativo una disminución de la excursión miocárdica hacia el ápex en telesístole igual o superior a 25% con respecto a los valores tomados como referente para cada paciente (figuras 14, 15, 16 y 17).Igual comportamiento se registró en las curvas del Doppler tisular espectral en los mismos segmentos, siendo más evidente en la onda S’ del doppler tisular. Dicho estudio mostró una alta sensibilidad (95%) con baja especificidad (50%) para el diagnóstico de rechazo dado que los cuadros infecciosos banales (gripe, angina, etcétera) presentaron mayor repercusión en el paciente trasplantado que en el no trasplantado. El uso de este método diagnóstico complementado con la valoración clínica permitió disminuir el número de biopsias endomiocárdicas en 40%.
Los pacientes adultos se reintegraron a su trabajo habitual en buenas condiciones. Los adolescentes y adultos jóvenes retomaron los estudios y la actividad deportiva habitual, en todos los casos promedialmente al mes y medio de efectuado el trasplante. Tres pacientes realizaron una actividad deportiva de alta competencia a los tres meses de efectuado el trasplante.
Discusión
Presentamos la experiencia de nuestro centro en 15 años de trasplante cardíaco.
Comparando nuestra población de pacientes trasplantados con las de estudios internacionales, observamos que la distribución etaria y las etiologías son similares. De manera similar a lo publicado en la literatura las causas que llevan al trasplante cardíaco en nuestra serie se vinculan a las cardiopatías congénitas en niños y a la miocardiopatía dilatada al ir avanzando en edad. Los tiempos de internación y el porcentaje de mortalidad hospitalaria son similares a los existentes en la literatura.
Nuestro tiempo en lista de espera es demasiado prolongado vinculado a la baja tasa de donantes. En el Registro Español de Trasplante Cardiaco es de 99 días versus nuestros 36 meses en niños y 18 meses en adultos (9). De esta manera se explica que la mortalidad en lista de espera sea solo de 5% en dicho registro, pero que ascienda a 14,5% en el nuestro.
Tiene importancia en los últimos años el uso optimizado de determinados fármacos como betabloqueantes y vasodilatadores, así como la evaluación del tratamiento con la monitorización del péptido natriurético, donde los niveles del mismo parecieron ser capaces de predecir los episodios de descompensación y el descenso en sus niveles hablaría de un mejor pronóstico, hipótesis que aún no ha podido ser demostrada y que no tiene nivel de evidencia en la actualidad. Igualmente es de suma utilidad el control del pro BNP durante el tratamiento de la insuficiencia cardíaca, pero relacionándolo con el contexto clínico del paciente (10). Si además sumamos la aplicación de dispositivos implantables, especialmente la terapia de resincronización ventricular (11), y el uso de asistencia ventricular ya sea temporal o definitiva, se ha visto disminuido el número de pacientes que requieren esta terapéutica. Este hecho unido a la escasez de donantes hace que deban respetarse criterios muy selectivos para colocar a un paciente en lista de espera para TxC. El cumplimiento de las indicaciones médicas por parte de los pacientes así como el seguimiento correcto por parte del equipo asistencial son los pilares para una buena evolución. El objetivo fundamental debe ser detectar precozmente las complicaciones para tratarlas adecuadamente y lograr así el máximo bienestar bio-psico-social de los pacientes.
Aunque en la evolución del paciente trasplantado el rechazo es la complicación más temible, rara vez se observa antes del séptimo día de posoperatorio. En su grado mínimo no es considerada una complicación sino que es la respuesta natural del huésped ante un haloantígeno. A pesar de los importantes avances en terapia inmunosupresora, el rechazo sigue siendo una de las causas más importantes de muerte en el primer año postrasplante junto con la infección (12).
El método más confiable para aseverar un rechazo sigue siendo la biopsia endomiocárdica (13,15). Es el estudio de rutina ante la sospecha precoz del rechazo cardíaco así como también del control seriado y posterior a los cambios de fármacos inmunosupresores. Las complicaciones del procedimiento se observan en 0,13% a 4% de los estudios (16). En el presente trabajo se registró una complicación por biopsia al inicio del programa con derrame pericárdico por perforación en un total de 240 biopsias efectuadas. Estos riesgos están en relación directa con el número de biopsias realizadas, la técnica utilizada y la experiencia del técnico. En la interpretación de las biopsias realizadas en el postrasplante inmediato se debe considerar el tiempo de isquemia y el uso previo de fármacos catecolaminérgicos. En estos casos se pueden observar pequeños focos de daño celular con migración de células inflamatorias de caracteres mixtos con presencia de polimorfonucleares (17).
En la actualidad el rechazo celular se ve con menor frecuencia. Este tipo de rechazo tiene mayor severidad, mayor incidencia de pérdida del injerto y de desarrollo de enfermedad vascular coronaria. Los pacientes afectados tienen mayor mortalidad. Se sospecha rechazo humoral en casos de biopsia endomiocárdica negativa para rechazo celular o isquemia, en un paciente trasplantado que tiene falla cardíaca y se asegura mediante el examen inmunohistológico efectuado en la biopsia (20).
Los factores de riesgo para rechazo son: incompatibilidad HLA, donante mujer joven, tipo de grupo sanguíneo no O. El Registro Español de Trasplante Cardiaco muestra que la falla aguda del injerto ocupa el primer lugar con una incidencia de 16,5%, en segundo lugar la infección con 15,9% y en tercer lugar el rechazo celular con una incidencia de 7,8% como causas de muerte (13). En nuestra serie el rechazo se presentó en 25%, similar a la serie española o al Registro Internacional de Trasplantes (ISHLT) (27); con origen variado, incompatibilidad corazón donante-receptor, abandono de la medicación, etc., logrando en la mayoría de los paciente su reversión mediante tratamiento médico. No obstante, en una revisión similar efectuada en la Clínica Abood Shaio de Bogotá se observa una incidencia de 50% de rechazo celular entre el primer y el tercer año post TxC (28).
Nuestros pacientes tenían una expectativa de vida al momento de realizar el trasplante menor al año, logrando una tasa de sobrevida a diez años de 45% para niños y de 70% para adultos.
La baja tasa de sobrevida a diez años en nuestra población pediátrica se explicaría por la predominancia de las cardiopatías congénitas con múltiples intervenciones quirúrgicas previas y las pobres condiciones económicas, similar a lo citado en la literatura (29).
El bajo número de pacientes de nuestra serie comparado con las internacionales podría explicar la diferencia con estas: curva actuarial de sobrevida a diez años en el Registro Español, 54% y en el Registro de la Sociedad Internacional de Trasplante, 55%.En dichas series la tasa de sobrevida es mejor en los últimos años que al inicio, donde pueden influir diferentes variables: curva de aprendizaje, mejoría del tratamiento inmunosupresor, etiología que motivó el trasplante y grado de urgencia en la realización del mismo (30).
Agradecimientos
Se agradece la colaboración de médicos cardiólogos, intensivistas, ecocardiografistas, anestesistas, sicólogos, siquiatras, asistentes sociales, fisioterapeutas, licenciados en neumocardiología, técnicos en informática y personal de enfermería del Instituto de Cardiología Infantil, sin la cual no hubiera sido posible llevar adelante este programa.
Bibliografía
1. Alfaro M, Asenjo R, Castro P, Jalil J, LLancaqueo M, Sepúlveda L, et al. Guías para el diagnóstico y tratamiento de la Insuficiencia Cardíaca. Rev Chilena de Cardiol 2007; 26: 473-504.
2. Almenar L, Delgado J. Situación actual del trasplante cardiaco en España. Rev Esp Cardiol 2010; 63:132-49.
3. Hunt Sh A, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation J Am Coll Cardiol 2009; 53: e1-e90.
4. Mancini D, Liet K. Selection of Cardiac Transplantation Candidates in 2010. Circulation 2010; 122:173-83.
5. Francis GD, Greenberg BH, Hsu DT, Jaski BE, Jessup M, LeWinter MM, et al. ACCF/AHA/ ACP/HFSA/ISHLT 2010 Clinical competence statement on management of patients with advanced heart failure and cardiac transplant. A report of the ACCF/AHA/ACP Task Force on Clinical Competence and Training. J Am Coll Cardiol 2010; 56:424-53.
6. Constanzo MR, Dipchand A, Starling R, chairs. The International Society for Heart and Lung Transplantation Guidelines for the Care of Heart Transplantation Recipients. Task Force 1: peri-operative care of the heart transplantat recipient (Aug. 4, 2010) [monografìa en Internet]. Texas: ISHLT; 2010 [citado 24 Set 2012]. Disponible en: http://www.ishlt.org/publications/guidelines.asp
7. Stehlik J, Edwards LB, Kucheryavaya AY, Benden C, Christie JD, Dobbels F, et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-eighth Adult Heart Transplant Report - 2011. J Heart Lung Transplant 2011; 30:1078-95.
8. Grun S, Ceruti B, Chiesa P, Díaz P, Manfredi A, Leone R. Retrasplante cardíaco: a propósito del primer caso en Uruguay. Rev Urug Cardiol 2006; 21: 124-30.
9. Almenar L, Segovia J, Crespo-Leiro MG, Palomo J, Arizón JM, Cobo M, et al. Registro español de trasplante cardiaco. XXII Informe oficial de la sección de insuficiencia cardiaca y trasplante cardiaco de la Sociedad Española de Cardiología (1984-2010). Rev Esp Cardiol 2011; 64:1138-46.
10. Eurlings LW, van Pol PE, Kok WE, van Wijk S, Lodewijks-van der Bolt C, Balk AH, et al. Management of Chronic Heart Failure Guided by Individual N-Terminal Pro-B-Type Natriuretic Peptide Targets. Results of the PRIMA (Can PRo-brain-natriuretic peptide guided therapy of chronic heart failure Improve heart failure morbidity and mortality?) Study. J Am Coll Cardiol 2010; 56: 2090-100.
11. Sociedad Europea de Cardiología. Guías europeas de práctica clínica sobre marcapasos y terapia de resincronización cardiaca. Rev Esp Cardiol 2007; 60:1272.e1-e51.
12. Taylor D, chair, Meiser B, Webber S, co-chairs. The international society for heart and lung transplantation guidelines for the care of heart transplantation recipients. Task Force 2: inmunosuppression and regection (Nov. 8, 2010) [monografìa en Internet]. Texas: ISHLT; 2010 [citado 24 Set 2012]. Disponible en: http://www.ishlt.org/publications/guidelines.asp
13. Cunningham KS, Veinot JP, Butany J. An approach to endomyocardial biopsy interpretation. J Clin Pathol 2006; 59:121-9.
14. Sakakibara S, Konno S. Endomyocardial biopsy. Jpn Heart J 1962;3: 537-43.
15. Caves PK, Schulz WP, Dong E, Stinson EB, Shumway NE. New instrument for transvenous cardiac biopsy [Abstract]. Am J Cardiol 1974; 33:264.
16. Saraiva F, Matos V, Gonçalves L, Antunes M, Providência LA. Complications of Endomyocardial Biopsy in Heart Transplant Patients: A Retrospective Study of 2117 Consecutive Procedures. Transplant Proc 2011; 43: 1908-12.
17. San Luis-Miranda R, Lázaro-Castillo JL, Munayer-Calderón J, Ramírez-Reyes HA, Arias-Monroy L, Aldana-Pérez T, et al. Biopsia endomiocárdica. Revisión y experiencia de 176 procedimientos. Arch Cardiol Mex 2007; 77: 200-8.
18. Shehata BM, Steelman CK. Heart transplant pathology. En: Husain AN, Stocker JT, editors. Color atlas of pediatric pathology. New York :Demos Medical Publishing; 2011.p.143-46.
19. Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J, et al. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant 2005; 24: 1710-1720.
20. Fishbain MC, Kobashigawa J. Biopsy-negative transplant rejection: etiology, diagnosis, and therapy. Curr Opin Cardiol 2004; 19: 166-169.
21. Fedrigo M, Gambino A, Tona F, Torregrossa G, Poli F, Benazzi E, et al. Can C4d immunostaining on endomyocardial biopsias be considered a prognostic biomarker in heart transplant recipients? Transplantation 2010; 90: 791-798. Fe de erratas en: Transplantation 2011;91(1):135
22. Takemoto SK, Zeevi A, Feng S, Colvin RB, Jordan S, Kobashigawa J, et al. Nacional conference to access antibody- mediated rejection in solid organ transplantation. Am J Transplant 2004; 4: 1033-41.
23. Tan CD, Rodríguez ER. Diagnosis of antibody-mediated rejection in cardiac transplantation: a call for standarization. Curr Opin Organ Transplant 2010. Publicación electrónica 24 Set 2010.
24. Yun JJ, Fischbein MP, Laks H, Ardehali A. Chronic rejection of transplanted hearts. Curr Opin Organ Transplant 2001; 6: 205-10.
25. Winters GL. Allograft coronary disease: a major limitation to long-term heart transplant recipient survival. Pathology Case Reviews 2001;6:274-80.
26. Alexander RT, Lathrop S, Volmer R, Blue L, Russell SD, Steenbergen C. Graft vascular disease after cardiac transplantation and its relation to mean acute rejection score. Arch Pathol Lab Med 2005; 129: 1283-1287.
27. Kirk R, Edwards LB, Kucheryavaya AY, Aurora P, Christie JD, Dobbels F, et al. The Registry of the International Society for Heart and Lung Transplantation: thirteenth official pediatric heart transplantation report - 2010. J Heart Lung Transplant 2010; 29:1119–28.
28. Páez Lesmes G. Morbimortalidad, función ventricular e incidencia del rechazo celular en el trasplante cardíaco en la clínica Abood Shaio [monografía en Internet].Bogotá: Universidad del Rosario;2011 [citado 24 Set 2012]. Disponible en: http://repository.urosario.edu.co/ bitstream/10336/2987/1/79284865-2012.pdf
29. Pietra BA, Kantor PF, Bartlett HL, Chin C, Canter CE, Larsen RL, et al. Early Predictors of Survival to and After Heart Transplantation in Children with Dilated Cardiomyopathy. Circulation 2012;126:1079-86
30. Hunt SH, Chair, Burch, Co-Chair. The international society for heart and lung transplantation guidelines for the care of heart transplantation recipients. Task Force 3: long-term care of heart transplant recipients (Aug. 6, 2010) [monografía en Internet ].Texas: ISHLT;2010 [24 Set 2012]. Disponible en: http://www.ishlt.org/publications/guidelines.asp





























