Fármacos cardiotóxicos utilizados en oncología y hemato-oncología
Dahiana Amarillo, Matilde Boada, Liliana Farrero, Claudia Martínez, Federico Pagnussat
En oncología existen diferentes modalidades de tratamiento onco-específico: sistémicos y locorregionales. Se denomina tratamiento sistémico cuando afecta a todo el organismo, como la quimioterapia, la hormonoterapia, las terapias biológicas y los tratamientos contra blancos moleculares. La cardiotoxicidad vinculada al tratamiento varía según la selectividad de éste sobre las células cancerosas y sobre los tejidos normales del organismo. En la (tabla 1) se muestran las diversas manifestaciones de cardiotoxicidad y los fármacos más frecuentemente involucrados.

Tabla 1: Manifestaciones de cardiotoxicidad vinculada al tratamiento del cáncer. En negrita se destacan los fármacos asociados con más frecuencia.
La disfunción ventricular por quimioterapia (DV-QT) es una de las toxicidades más frecuentemente vinculada a los fármacos antineoplásicos. Se asocia a mayor morbimortalidad en sobrevivientes, pudiendo presentarse de forma sintomática como asintomática, durante el tratamiento oncológico o en la evolución. La incidencia de esta complicación depende de múltiples factores: el tipo de fármaco, las dosis acumuladas, así como de los factores de riesgo cardiovascular del paciente.
Mecanismos de cardiotoxicidad
Dentro de las manifestaciones de cardiotoxicidad, la DV-QT es la que cuenta con mayor información sobre la etiopatogenia del daño miocárdico. Se describen dos tipos de fármacos cardiotóxicos en relación con el tipo de efecto que generan sobre el miocardio: cardiotóxicos tipo I (efecto dosis dependiente y frecuentemente irreversible) y cardiotóxicos tipo II (efecto dosis independiente y habitualmente reversible).
Cardiotóxicos tipo I
Dentro de los cardiotóxicos tipo I se destacan los antracíclicos. Los antracíclicos son antibióticos antineoplásicos producidos por Streptomyces peucetius9. Las antraciclinas más utilizadas son doxorubicina, epirubicina e idarubicina. Son fármacos de amplio uso en el tratamiento de linfomas, leucemias y cáncer de mama, entre otros. Se utilizan de forma intravenosa, en general en combinación con otros fármacos. Dentro de sus mecanismos de acción antineoplásica se plantean9,12:
1) Inhibición de la síntesis ácidos nucleicos y proteínas.
2) Inhibición de la topoisomerasa II (resultando en roturas del ADN).
3) Formación de radicales libres.
4) Efecto alquilante y peroxidación de lípidos celulares, unión a fosfolípidos y alteración de la fluidez de membranas celulares.
La cardiotoxicidad asociada a antraciclinas es dosis dependiente y se divide, según su momento de aparición, en: toxicidad aguda (posinfusión), de inicio temprano (en el primer año) y tardía (luego del primer año)13. La presentación clínica también varía según el momento de inicio de la sintomatología, siendo las manifestaciones agudas más frecuentes las alteraciones eléctricas y la miopericarditis, mientras que la disfunción miocárdica va a ser la forma de presentación más frecuente en el inicio temprano y tardío14. Las manifestaciones de inicio tardío pueden presentarse luego del año y en un período de 10 a 20 años después del tratamiento15.
La incidencia de DV-QT para una dosis acumulada de 400-550 mg/m2 ronda entre 3%-26%, y aumenta 18%-48% para una dosis acumulada de 700 mg/m2(9. Sin embargo, incluso dosis menores (<300 mg/m2) están asociadas con un riesgo no despreciable (1,6%). Cuando calculamos la dosis acumulada de diferentes antracíclicos, debemos utilizar una tabla de equivalencias con el factor de conversión correspondiente (tabla 2)16,17).
Dentro de los mecanismos patogénicos de DV-QT por antracíclicos se plantean principalmente dos: la inhibición de la topoisomerasa II beta expresada en los cardiomiocitos (siendo su actividad antineoplásica medida principalmente por la inhibición de la topoisomerasa II alfa), la producción de estrés oxidativo y su interacción con el metabolismo intracelular del hierro (Fe).
Dentro de las estrategias dirigidas a disminuir la cardiotoxicidad de los antracíclicos se han planteado:
- Formulaciones liposomales: significativamente menos cardiotóxicas y con eficacia comparable18).
- Protocolos de administración infusionales.
- Uso de quelantes de Fe, como el dexrazoxane19.
- Profilaxis con inhibidores de la enzima convertidora de angiotensina (IECA) y betabloqueantes (BB)20.
Cardiotóxicos tipo II
Dentro del grupo de los cardiotóxicos tipo II se destacan los anticuerpos monoclonales anti-Her-2 (que han sido los más estudiados) y los inhibidores del proteasoma. Otros agentes de este grupo son los alquilantes, antimetabolitos, inhibidores de tirosin-quinasas y nuevos fármacos, como los inhibidores de check point inmunológico (ICI) e inhibidores de las quinasas dependientes de ciclinas (CDK 4-6).
Agentes anti-Her-2
El trastuzumab es un anticuerpo monoclonal humanizado anti-Her-2 (receptor de factor de crecimiento). Se utiliza en el tratamiento del cáncer de mama Her2+ por medio de administración intravenosa. Se ha asociado con una incidencia de DV-QT de más de 20%, la cual aumenta cuando se combina con antracíclicos, teniendo un efecto sinérgico. Sin embargo, el riesgo de insuficiencia cardíaca (IC) severa es de 2,5%. Son por definición cardiotóxicos tipo II y determinan una disfunción sistólica frecuentemente reversible. Los mecanismos patogénicos que participan son la regulación en menos de la expresión de la topoisomerasa II beta y el bloqueo de la señalización reparadora a través de Her-221-23.
El pertuzumab es otro anticuerpo monoclonal humanizado anti-Her-2, de administración intravenosa, que se utiliza en conjunto con el trastuzumab en el cáncer de mama diseminado. La combinación de trastuzumab y pertuzumab no se asoció con un incremento significativo de la cardiotoxicidad en comparación con trastuzumab monodroga24.
El ado-trastuzumab-emtansine (T-DM1) es un fármaco que conjuga el trastuzumab con un agente quimioterápico inhibidor de microtúbulos (emtansine), que también se utiliza en cáncer de mama Her2+ metastásico. Si bien los estudios que lo han validado tienen corto seguimiento, son también cardiotóxicos tipo II, con una tasa de eventos cardíacos totales, incluida la IC congestiva de cualquier grado, la disminución de la fracción de eyección del ventrículo izquierdo (FEVI), la isquemia cardíaca aguda o arritmias de 3,4%, siendo más frecuente el descenso asintomático de la FEVI25.
Inhibidores del proteasoma
Los inhibidores del proteasoma son fármacos ampliamente utilizados en el tratamiento del mieloma múltiple, destacándose bortezomib y carfilzomib. Su acción se produce por medio de la inhibición de diferentes sitios catalíticos del proteasoma, y a través de la señalización de caspasas determinando apoptosis celular. Si bien todos los fármacos del grupo han demostrado efectos cardiotóxicos en modelos animales, carfilzomib tiene mayor incidencia de cardiotoxicidad clínica. Este fármaco inhibe de forma irreversible la subunidad beta 5 del complejo proteasoma 20S y se ha asociado con una incidencia de 5%-10% de DV-QT. Su efecto cardiotóxico es sinérgico con la doxorubicina26,27.
Otros agentes quimioterápicos
Agentes alquilantes
La ciclofosfamida es un antineoplásico sintético relacionado químicamente con las mostazas nitrogenadas. Actúa como agente alquilante inhibiendo la síntesis de ADN, ARN y proteínas. Es un agente electrofílico que actúa específicamente en la fase S del ciclo celular. La DV-QT inducida por ciclofosfamida es relativamente infrecuente y se observa principalmente en pacientes que reciben dosis altas (>140 mg/kg) como tratamiento de condicionamiento del trasplante de progenitores hematopoyéticos9.
Antimetabolitos
Las fluoropirimidinas, capecitabine y 5-fluorouracilo (5-FU) son antineoplásicos antimetabolitos cuyo mecanismo de acción consiste en interferir con la síntesis del ADN, actuando en la fase S. La incidencia de cardiotoxicidad reportada por estos agentes varía entre 1% y 20%, dependiendo del tipo de agente, dosis y forma de administración. El mecanismo de cardiotoxicidad no está del todo establecido, se asocia al vasoespasmo coronario, aunque también se ha involucrado toxicidad directa del miocardio y efecto trombogénico. Si bien la manifestación más frecuente es el ángor, puede presentarse también como infarto agudo de miocardio (IAM), alteraciones en el ritmo y falla cardíaca. El riesgo se incrementa con la forma de administración continua (capecitabine se administra vía oral y los esquemas de 5-FU en infusión continua intravenosa), el antecedente de coronariopatía y la concomitancia con antraciclinas o radioterapia (RT)28.
Inhibidores de tirosin-kinasa
El ibrutinib es un inhibidor irreversible de la Bruton tirosin kinasa (BTK) aprobado para el tratamiento de la leucemia linfoide crónica, linfoma del manto y macroglobulinemia de Waldenstrom. Es un fármaco de administración oral, en general como monoterapia. La cardiotoxicidad es uno de sus efectos adversos, presentándose principalmente como alteraciones eléctricas, siendo la arritmia más frecuente la fibrilación auricular (FA). El tratamiento con ibrutinib se asocia con cinco veces mayor riesgo de FA, con una incidencia de 5%-10% y tiene una presentación temprana con una media de siete meses desde el inicio del tratamiento. Además de las complicaciones eléctricas, este fármaco se podría asociar a falla cardíaca reversible. Dentro de los mecanismos patogénicos participantes se destaca la expresión de BTK por parte de los cardiomiocitos29,30.
El vemurafenib es un inhibidor vía oral de formas mutadas de la quinasa activadora BRAF (mutación V600E), que se ve hasta en un 50% de los melanomas cutáneos y que se utiliza como tratamiento en melanoma metastásico. Se ha asociado con prolongación del intervalo QT (en 5%-9%), por lo que no se recomienda en pacientes que ya presenten dicha alteración o utilizarlos en conjunto con otros fármacos que prolonguen el intervalo QT. Debe monitorizarse el tratamiento con electrocardiograma (ECG), pudiendo disminuir la dosis o discontinuar el tratamiento en función de la afección generada (menos de 1%), siendo en los estudios pocas veces sintomático31.
Trametinib y cobimetinib son fármacos administrados vía oral, inhibidores de la vía MEK, utilizados en conjunto con el dabrafenib (anti-BRAF) y vemurafenib en el melanoma metastásico con mutación en BRAF. Se ha visto que ambas combinaciones presentan riesgo de DV-QT. En el ensayo pivotal con vemurafenib y cobimetinib el riesgo de disminución de la FEVI fue de 7% (1% severa), mientras que con dabrafenib y trametinib fue de 4%-10%. Se recomienda evaluar la FEVI antes del inicio de la terapia, un mes después del inicio del tratamiento y luego a intervalos de dos a tres meses durante el tratamiento, pudiendo modificar dosis y eventualmente suspenderlo32,33.
Contamos, además, con otros ITK utilizados en nuestro medio que agrupamos bajo la denominación de antiangiogénicos, como ser pazopanib, sunitinib, axitinib y regorafenib, entre otros. Se les suma a este grupo algunos anticuerpos monoclonales inhibidores de la angiogénesis, como bevacizumab y ramucirumab (anti-VEGF). Como grupo, se describe un amplio espectro de efectos adversos cardiovasculares (hipertensión arterial (HTA), trombosis arterial y venosa, disección aórtica), incluyendo también la disfunción ventricular. Un metaanálisis que incluye 77 ensayos fase III mostró que los fármacos inhibidores de la angiogénesis se asociaron con un mayor riesgo de isquemia cardíaca (OR 2,83; IC 95%: 1,72-4,65) y disfunción cardíaca (OR 1,35; IC 95%: 1,06-1,70), no mostrando el análisis de subgrupos diferencias significativas entre los distintos fármacos34).
Inhibidores de check point inmunológico
Los inhibidores de check point inmunológico (ICI) son una nueva clase de medicamentos bloqueadores del punto de control inmunitario. Se trata de anticuerpos monoclonales dirigidos contra CTLA-4, PD-1 (nivolumab, pembrolizumab) y su ligando PD-L1, disponibles en Uruguay. Han revolucionado el manejo de una amplia variedad de neoplasias sólidas y hematológicas. Estos inhibidores estimulan la respuesta inmune antitumoral, lo que ha demostrado ser muy efectivo. Este efecto inmunoestimulador se asocia también a un amplio espectro de eventos adversos inmuno relacionados (IRAE) a nivel de diferentes órganos y sistemas. Curiosamente, PD-1 y PD-L1 se expresan en cardiomiocitos humanos y roedores, y los primeros estudios en animales han demostrado que CTLA-4 y la eliminación de PD-1 pueden causar miocarditis autoinmune. Revisiones recientes de toxicidad de ICI han evidenciado durante los últimos años varios casos de miocarditis, así como casos de IC fatal en algunos pacientes tratados (aunque estas últimas son menores a 1% y se han visto fundamentalmente con asociación de anti-CTLA-4 y anti-PD-1)35 ). Se encontrará más información en el capítulo de miocarditis por ICI.
Inhibidores de quinasas dependientes de ciclinas CDK 4-6
Son fármacos que se utilizan en cáncer de mama metastásico con receptores hormonales positivos que inhiben las CDK 4-6, fundamentales para que se lleve a cabo el ciclo celular, suprimiendo de dicha forma la proliferación celular. Se han asociado con prolongación del intervalo QT dentro de las primeras cuatro semanas de iniciar el tratamiento, siendo reversible con la interrupción de éste. El fármaco del grupo que se ha asociado con mayor frecuencia a esta complicación (7%) es ribociclib36.
Disfunción ventricular e insuficiencia cardíaca
Virginia Beneditto, Andreina Gómez, Gabriel Parma
La afectación de la función cardíaca es una de las variables que puede limitar el tratamiento oncológico, ya que contribuye a la morbilidad y la mortalidad de la población expuesta. La correcta evaluación cardiovascular de los pacientes expuestos a la quimioterapia es determinante de su evolución y pronóstico. Es capital el enfoque multidisciplinario e integral para realizar el análisis del riesgo de cada paciente, prevenir o minimizar la injuria cardíaca y monitorizar la función ventricular durante y después de la terapia37,38).
La DV-QT se define como la reducción absoluta de la FEVI >10% respecto al valor basal alcanzando un valor inferior a 53%, considerado este valor como límite inferior de la normalidad39, ya sea asintomática o acompañada de síntomas de IC, lo que implica un peor pronóstico9,38.
El estudio de la deformación miocárdica mediante la técnica de strain longitudinal global (SLG) identifica el daño miocárdico en una fase más precoz. La incorporación del SLG en el análisis mejora la estratificación del riesgo de DV-QT, en comparación con la utilización de la FEVI como único parámetro40. Un descenso relativo del SLG >15%, con respecto al basal, identifica daño estructural cardíaco38.
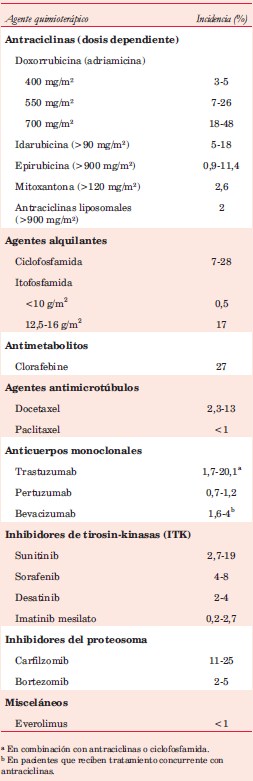
La disfunción ventricular como manifestación de cardiotoxicidad puede ser generada por cardiotóxicos tipo I y tipo II, cuyo mecanismo de acción ya fue analizado en el capítulo previo40-44. En la (tabla 3) se resume la incidencia de disfunción ventricular asociada a fármacos quimioterápicos.
Considerando la definición, debemos marcar una matriz clínica y paraclínica en cuanto al diagnóstico y monitorización de la cardiotoxicidad38. Se sugiere la estratificación del riesgo de DV-QT en todos los pacientes, con posterior seguimiento clínico y paraclínico. En aquellos pacientes con mayor riesgo o complejidad, o en los que cumplen criterios de cardiotoxicidad, ya sea por el desarrollo de síntomas de IC, descenso de la FEVI o alteraciones en el SLG o biomarcadores, como será comentado posteriormente, se sugiere la consulta con cardiólogo o Unidad de Cardio-Oncología (UCO) de acuerdo a la disponibilidad de cada institución45,46.
Estratificación de riesgo
La estratificación de riesgo de los pacientes se debe realizar previo al inicio del tratamiento. Es fundamental para la elección del plan terapéutico, planificación del seguimiento y diagnosticar precozmente las posibles complicaciones. La identificación y modificación de los factores de riesgo cardiovascular (FRCV) será abordada en el capítulo de prevención de la disfunción ventricular y seguimiento.
Actualmente no se dispone de escalas prospectivas que valoren de forma conjunta el riesgo cardiovascular (RCV) y de DV-QT. A pesar de esto, las recomendaciones europeas proponen estratificar el RCV previo al inicio del tratamiento oncológico utilizando las tablas SCORE que permiten estimar el riesgo de morir por una una enfermedad cardiovascular (ECV) a diez años en pacientes sin ECV previa38. Se han identificado, además, factores específicos vinculados con la DV-QT.
Ciertas características basales del individuo son reconocidas como factores de riesgo para el desarrollo de DV-QT38,47:
- Factores genéticos: existen polimorfismos que predisponen al desarrollo de disfunción ventricular48,49.
- Mujeres.
- Edad <15 o >65 años.
- HTA o diabetes.
- Cardiopatía estructural previa: coronariopatía, miocardiopatía dilatada, hipertensiva, infiltrativa o restrictiva, valvulopatía al menos moderada.
- FEVI basal en el rango normal-bajo (50%- 55%)41,50).
- Historia previa de DV-QT.
- Insuficiencia renal.
- Obesidad (índice de masa corporal >30 kg/m2) en tratamiento con anti-HER-2.
- Radioterapia mediastinal previa.
- Mayor tiempo transcurrido desde el tratamiento con radioterapia.
De acuerdo al tratamiento propuesto, cualquiera de los siguientes51:
- Antraciclinas a dosis altas (>250 mg/m2 doxorubicina52-54, >600 mg/m2 epirubicina)55-58.
- Radioterapia a dosis altas (>30 Gy)53, estando el corazón en el campo de tratamiento.
- Combinación de antraciclinas a dosis menores (<250 mg/m2 doxorubicina, <600 mg/m2 epirubicina) y radioterapia a dosis menor (<30 Gy), estando el corazón en el campo de tratamiento.
- Tratamiento con dosis bajas de antraciclinas o trastuzumab y la presencia de alguno de los siguientes factores de riesgo:
- Dos o más FRCV (tabaquismo, HTA, diabetes, dislipemia y obesidad)59,60).
- Edad > 60 años al momento del tratamiento del cáncer.
- Cardiopatía estructural: FEVI borderline (50%- 55%), antecedente de IAM, afectación valvular moderada o severa.
- Tratamiento secuencial con dosis bajas de antraciclinas, seguido de trastuzumab10,41,61).
Los fármacos utilizados se pueden clasificar en diferentes grupos de riesgo de DV-QT38:
- Alto: antraciclinas, ciclofosfamida, trastuzumab.
- Moderado: docetaxel, pertuzumab, sunitinib, sorafenib.
- Bajo: bevacizumab, dasatinib, imatinib, lapatinib.
Diagnóstico y monitorización
Para el diagnóstico y monitorización, tanto en prevención primaria como secundaria, contamos con técnicas de imagen que evalúan la función sistólica del ventrículo izquierdo y marcadores de lesión que ayudan a detectar precozmente el daño miocárdico (figura 1).

Figura 1: Algoritmo de diagnóstico y seguimiento de la DV-QT durante el tratamiento oncológico. Modificado de(38).ECV: enfermedad cardiovascular; ETT: ecocardiogrma transtorácico; SLG: strain longitudinal ; FEVI: fracción de eyección del ventrículo izquierdo; DV-QT: disfunción ventricular por quimioterapia; UCO: Unidad de Cardio-Oncología; IECA: inhibidores de la enzima convertidora de angiotensina; BB: betabloqueantes.
Evaluación imagenológica
La ecocardiografía es la técnica de elección para la cuantificación de la FEVI. Sin embargo, la elección del método de evaluación dependerá de la sensibilidad y especificidad del método, de la capacidad de detectar precozmente cardiotoxicidad (en prevención primaria) y de la disponibilidad de cada institución.
La cuantificación de la FEVI mediante un ecocardiograma transtorácico bidimensional (ETT- 2D), utilizando el método de Simpson, es aceptada por su masividad de uso y su disponibilidad en todos los laboratorios de ecocardiografía. Pero debemos considerar que presenta una limitada sensibilidad para detectar cambios sutiles en la FEVI y que la variabilidad interobservador es similar al intervalo diagnóstico de cardiotoxicidad (entre 5%-10%). En tal sentido, la cuantificación de la FEVI por ecocardiograma transtorácico tridimensional (ETT-3D) cuenta con mayor exactitud diagnóstica y menor variabilidad (5%), siempre y cuando sea realizado en un laboratorio de ecocardiografía que cuente con experiencia en dicha técnica, con el mismo equipo e idealmente el mismo técnico. La resonancia magnética cardíaca (RMC) es el patrón oro para cuantificación de la FEVI, pero dada su limitada disponibilidad, se reserva para casos borderline o dudosos.
Actualmente contamos con otra técnica ecocardiográfica capaz de evaluar la función sistólica del ventrículo izquierdo, evaluando la deformación miocárdica o SLG. Esta técnica ha demostrado ser un marcador de daño miocárdico precoz, con menor variabilidad que la cuantificación de la FEVI por ETT. Para utilizar este parámetro, debemos contar con un laboratorio de ecocardiografía entrenado en la técnica, utilizando siempre el mismo equipo y software para cada paciente, dado que existe gran variabilidad entre ellos. Si contamos con estas premisas, es un excelente método de evaluación de la función sistólica del VI, previo a la afectación de la FEVI, con especificidad suficiente para detectar cardiotoxicidad precoz como instrumento de seguimiento en pacientes de mayor riesgo, permitiendo además detectar recuperación funcional9,62-65.
Biomarcadores
El único marcador de injuria miocárdica de utilidad es la troponina I. Se ha demostrado su capacidad diagnóstica como marcador de daño miocárdico precoz en pacientes expuestos fundamentalmente a antraciclinas. Se recomienda su utilización en los pacientes expuestos a antraciclinas con mayor riesgo, tanto por las dosis acumuladas o por la presencia de factores de riesgo para el desarrollo de DV-QT. Este biomarcador tiene un alto valor predictivo negativo y su presencia permite identificar a pacientes con peor pronóstico cuando existe una elevación persistente de sus cifras9,66,67.
Estrategias de prevención y seguimiento de la disfunción ventricular por quimioterapia
Andreina Gómez, Rosanna Torighelli
La mejor estrategia de prevención es la identificación de aquellos pacientes en riesgo de desarrollar complicaciones cardiovasculares relacionadas con el tratamiento del cáncer. Se debe realizar una valoración del RCV global e iniciar el mejor tratamiento de prevención primaria disponible47,68) (figura 2).
Se podría considerar a los pacientes que van a recibir tratamientos antitumorales cardiotóxicos como en una categoría de alto RCV y también en un estadio A de IC según la clasificación propuesta por ACC/AHA (American College of Cardiology/American Heart Association)69.
La colaboración entre cardiólogo, oncólogo y hematólogo es fundamental. El objetivo es que el paciente reciba el mejor tratamiento oncológico, previniendo o minimizando las complicaciones cardiovasculares46.
La evaluación del riesgo de cardiotoxicidad incluye una valoración clínica y examen físico completo. Se sugiere además la realización de un ECG, ETT basal con determinación cuantitativa de la FEVI e idealmente SLG y determinación de troponina durante la evaluación cardíaca basal y en el seguimiento38,43,70,71.
La disfunción ventricular y el desarrollo de IC representan una de las complicaciones más temidas por su impacto pronóstico oncológico y cardiovascular. La detección precoz permite el tratamiento en una etapa preclínica, cuando el daño miocárdico es potencialmente reversible71.
I. ¿Quiénes tienen riesgo aumentado de disfunción ventricular por quimioterapia?
Se han identificado múltiples factores de riesgo para el desarrollo de DV-QT, como se detalló en el capítulo de disfunción ventricular e IC. Para poder realizar una evaluación global del riesgo debemos considerar:
- Características basales del paciente.
- Tratamiento propuesto.
II. ¿Cuáles son las estrategias de prevención para minimizar el riesgo de disfunción ventricular por quimioterapia?
Previo al inicio del tratamiento:
- Evaluación completa del paciente, incluyendo historia clínica con identificación de los FRCV (HTA, diabetes, dislipemia, obesidad, tabaquismo) y particularmente aquellos modificables. Realizar un examen físico completo, ECG y ETT, si es posible con SLG43,72,73.
Durante el tratamiento:
- Evaluación seriada y tratamiento precoz de los FRCV modificables.
- El ejercicio físico regular en pacientes con cáncer ofrece numerosos beneficios, mejora la capacidad funcional, calidad de vida, función inmune, tasa de culminación del tratamiento quimioterápico y reduce efectos secundarios y estadía hospitalaria74-76.
Pueden ser incorporadas algunas estrategias adicionales luego de una evaluación individualizada, como ser:
- Quimioterapia en infusión continua77.
- Uso de dexrazoxane, compuesto quelante de Fe que antagoniza la lesión del ADN inducida por la doxorubicina78-80. Su uso se asoció a un descenso del riesgo de IC clínica y asintomática en más de 80%, sin disminución de la tasa de respuesta oncológica, sobrevida o la aparición de segundas neoplasias77,81,82.
- Formulaciones liposomales de doxorubicina77,83). Su uso en pacientes de alto riesgo que van a recibir planes con dosis altas de antraciclinas se asoció a una reducción significativa del riesgo de DV-QT, sin afectar la sobrevida global84.
- Seleccionar la menor dosis de radiación cuando sea posible y aplicación de campos dirigidos intentando excluir la zona del corazón.
- En pacientes de muy alto riesgo de desarrollar DV-QT y FEVI basal <53%, o que presentan troponinas positivas, considerar la utilización de IECA y BB para disminuir el riesgo de disfunción ventricular85-89.
- Aún no está claramente definido el rol cardioprotector de las estatinas90,91.
III. ¿Cómo realizar el seguimiento durante el tratamiento de pacientes en riesgo de desarrollar disfunción ventricular por quimioterapia?
Realizar historia clínica y examen físico completos, valoración y tratamiento precoz de FRCV.
En pacientes asintomáticos con riesgo incrementado de desarrollar DV-QT, se sugiere realizar:
- ETT con SLG, considerando significativo un descenso relativo del SLG >15% con respecto al basal. El uso de la RMC se restringe a situaciones donde el ETT es técnicamente deficiente39,43,63,92-97.
- Biomarcadores séricos (troponina)67,97,98.
- Interconsulta con cardiólogo o consulta con equipo de cardio-oncología.
No hay estudios clínicos que comparen la eficacia de diferentes protocolos de seguimiento, existiendo pautas variables. La frecuencia del ETT va a depender de la valoración clínica y de las circunstancias del paciente52.
De acuerdo a las recomendaciones internacionales, sugerimos este seguimiento ecocardiográfico9,38,42,45,71,72,99,100).
- Modelo de cardiotoxicidad tipo 1 (antraciclinas).
- Valoración de FEVI basal, al alcanzar la mitad de la dosis prevista (generalmente en torno a los tres meses de iniciado el tratamiento), o con una dosis acumulada de 240-250 mg/m2 de doxorubicina (o equivalente) y posteriormente previo a cada dosis adicional de 50-100 mg/m2. Revaloración al final del tratamiento y luego a los seis meses.
- Modelo de cardiotoxicidad tipo 2 (trastuzumab).
- ETT cada tres meses hasta culminar el tratamiento101.
Utilización de biomarcadores para el seguimiento.
Las pautas de dosificación de troponina son variables y los protocolos internacionales sugieren:
- Contar con un valor basal (previo al inicio del tratamiento) de troponina de alta sensibilidad y previo a cada ciclo de quimioterapia en pacientes de alto riesgo.
- Se sugiere que la extracción coincida con la evaluación rutinaria de laboratorio indicada por el oncólogo/hematólogo.
- En pacientes de alto riesgo de cardiotoxicidad, se podrá considerar añadir dosificación a las 72 horas de cada ciclo9,67,72,92,100.
- La presencia de troponina positiva es un marcador de alto riesgo que implica una revaloración por el equipo de cardio-oncología.
- La elevación precoz y persistente de troponina está asociada a incremento del riesgo de DV-QT y ausencia de recuperación de la FEVI, identificando a un grupo de peor pronóstico66,97,102-105.
- La presencia de troponinas persistentemente negativas tiene un alto valor predictivo negativo, lo que implica que dichos pacientes tienen muy bajo riesgo de DV-QT en el primer año de seguimiento posquimioterapia67,85,106.
El rol del NT-proBNP seriado en contexto de quimioterapia no está definido66,107.
En individuos con síntomas o signos sugestivos de disfunción cardíaca durante una evaluación de rutina, se recomienda revaloración a la brevedad de la FEVI para un diagnóstico precoz de compromiso de la función ventricular e inicio del tratamiento correspondiente.
La decisión de modificar el tratamiento quimioterápico en quienes desarrollan disfunción ventricular debe ser tomada en conjunto entre el oncólogo-hematólogo, el cardiólogo y el paciente, idealmente en una UCO, evaluando RCV y beneficios oncológicos de mantener el tratamiento.
De acuerdo a las recomendaciones internacionales9,38,42,108, se sugiere suspender el tratamiento en presencia de:
- Síntomas y signos de IC.
- En el paciente asintomático:
- Cardiotóxicos tipo 1 (antraciclinas): suspender el tratamiento si la FEVI desciende >10% y a valores <45%-50% o el descenso es >20%.
- Cardiotóxicos tipo 2 (trastuzumab): suspender el tratamiento si la FEVI desciende >10% y a valores <40%-45%.
- Revalorar la FEVI a las 3-4 semanas. Se podría reiniciar si existe una recuperación de la FEVI.
- Se sugiere individualizar el tratamiento de acuerdo al RCV y beneficio oncológico esperado.
Actualmente no existe evidencia suficiente para interrumpir o diferir el tratamiento en base a la presencia de troponina positiva o descenso del SLG en ausencia de descenso significativo de la FEVI9. En aquellos pacientes que cumplen criterios de DV-QT, asintomática o sintomática, se sugiere el inicio de IECA o antagonistas de los receptores de angiotensina II (ARA-II) y BB de acuerdo a las guías de práctica clínica9.
IV. ¿Cómo realizar el seguimiento luego de finalizado el tratamiento en pacientes con riesgo de disfunción cardíaca?
- Historia clínica, examen físico, valoración periódica y tratamiento precoz de FRCV.
- En individuos con síntomas o signos sugestivos de IC durante una evaluación de rutina, se recomienda realizar un ETT a la brevedad e interconsulta con cardiología o equipo de cardio-oncología.
- Se sugiere seguimiento con ETT-2D entre 6-12 meses luego de finalizar el tratamiento, reiterándolo a los 24 meses y posteriormente de acuerdo a los hallazgos.
- La RMC puede ser utilizada si el ETT no está disponible o es técnicamente deficiente9,15,109.
- Los pacientes que presentan disfunción ventricular asintomática durante una monitorización de rutina deben ser referidos al cardiólogo o equipo de cardio-oncología para valoración y tratamiento.
V. ¿Cómo realizar el seguimiento en sobrevivientes al cáncer en la infancia?
En los niños sobrevivientes al cáncer el riesgo de cardiopatía precoz es alto, incluso después de muchos años, y en la mayoría de los casos tienen más probabilidad de morir por un evento CV que por cáncer. El seguimiento sistemático y tratamiento de los FRCV reduce la incidencia acumulada de IC hasta en un 18%110-114.
Las guías internacionales recomiendan el seguimiento a lo largo de toda la vida en supervivientes al cáncer en la infancia tratados con fármacos potencialmente cardiotóxicos. En aquellos con altas dosis de antraciclinas (>250 mg/m2), altas dosis de radioterapia torácica (>35 Gy) o tratamiento combinado (>100 mg/m2 AC y >15 Gy), se sugiere ETT a los dos años de finalizado el tratamiento y luego cada cinco años113,115,116.
Consideramos que es fundamental el seguimiento conjunto en equipos multidisciplinarios para brindar la mejor asistencia integral a todos los pacientes.