Introducción
Las enfermedades cardiovasculares afectan aproximadamente del 1 al 4% de las embarazadas en los países desarrollados1. Hasta hace unos años, la cardiopatía reumática era la forma más común de enfermedad cardíaca en mujeres embarazadas; sin embargo, esta ha ido disminuyendo en países desarrollados y en la actualidad la cardiopatía congénita (CC) es la causa cardíaca más frecuente que complica el embarazo en países como Estados Unidos2. Uruguay tiene una mortalidad materna muy similar a los países desarrollados y presenta también una incidencia en descenso de la cardiopatía reumática.
Los cambios en el estilo de vida han llevado a que la edad en la que se produce el primer embarazo sea mayor, por lo que se asocia a factores de riesgo cardiovasculares propios de la edad como hipertensión, diabetes y obesidad, lo que hace que aumente la incidencia de enfermedades cardíacas adquiridas que complican el embarazo1,3.
Debido a los cambios fisiológicos cardiovasculares que se producen durante el embarazo, el diagnóstico de estas puede ser dificultoso, lo que genera retrasos en el diagnóstico y tratamiento2.
El acceso al sistema de salud es también un factor importante en la prevención de la morbimortalidad materna. En Reino Unido, un estudio de 2015 reportó que los cuidados de salud por debajo del estándar eran responsables de más del 50% de las muertes maternas, la mitad de las cuales eran evitables4.
Importancia del tema e incidencia
Las enfermedades cardiovasculares son la principal causa de muerte relacionada con el embarazo en los países desarrollados3, representa un 49,2% de las muertes maternas. Su distribución es la siguiente: cardiomiopatías: 12,1%; tromboembolismo pulmonar y otros embolismos: 10,5%; estados hipertensivos del embarazo: 6,3%; accidentes cerebrovasculares: 5,8%; otras condiciones cardiovasculares: 14,5%.
Entre estas últimas, las CC son la enfermedad cardiovascular más frecuente durante la gestación (75 a 82%). Por otro lado, las cardiomiopatías son raras, pero representan una causa de complicaciones cardiovasculares severas durante el embarazo5.
Como fue mencionado, el aumento de la edad materna al momento del primer embarazo, la presencia de factores de riesgo cardiovasculares y la mayor sobrevida de las mujeres portadoras de CC hacen que la incidencia de complicaciones por enfermedad cardíaca en la embarazada esté en aumento a nivel mundial1.
En los países desarrollados, las CC son el tipo más frecuente de enfermedad cardíaca en la embarazada y las enfermedades cardiovasculares son la principal causa de muerte no obstétrica en la embarazada1.
La mejoría en las técnicas de reparación quirúrgica de los defectos congénitos y su manejo posterior permiten una mayor esperanza y calidad de vida, lo que ha originado que un mayor número de mujeres con cardiopatía lleguen a la edad reproductiva. La morbilidad y mortalidad materna por CC son del 11% y 0,5%, respectivamente2.
En la actualidad, el 90% de los niños a los que se les diagnostica una CC llegan a la edad adulta6. Las CC representan riesgo de morbilidad significativos tanto para la madre como para el feto. Existe un aumento en la estadía hospitalaria luego del nacimiento y mayor riesgo de reingreso luego del alta. Las complicaciones maternas pueden incluir falla cardíaca, arritmias, enfermedad tromboembólica, endocarditis, preeclampsia y hemorragia. Para el feto los principales riesgos son prematurez, restricción del crecimiento intrauterino, tamaño pequeño para la edad gestacional, CC y muerte neonatal4.
Por todo lo expuesto, es evidente que frente a una mujer portadora de una cardiopatía que está realizando una consulta preconcepcional o ya está embarazada, se requiere un enfoque multidisciplinario. Conocer los cambios fisiológicos que se producen durante el embarazo a nivel cardiovascular y la traducción que estos cambios tienen en la sintomatología es fundamental.
Cambios fisiológicos durante el embarazo y el parto
Los cambios fisiológicos normales relacionados con el embarazo pueden agravar una cardiopatía subyacente, lo que aumenta la morbilidad y mortalidad materna. Estos aumentan la demanda cardíaca, que puede transformarse en crítica si la función cardíaca se encontraba previamente comprometida.
Estos cambios incluyen:
•Aumento progresivo del agua corporal total de 6 a 8 litros, por retención de 500 a 900 mEq de sodio adicionales.
•Aumento del volumen plasmático durante el primer, segundo e inicio del tercer trimestre. Al final del embarazo este aumento es aproximadamente 50% mayor que en mujeres no embarazadas7,8.
•Disminución de la resistencia vascular sistémica (RVS) durante toda la gestación, volviendo a valores normales cerca del término.
•Descenso de la presión arterial durante el primer y segundo trimestre, secundario entre otros a la disminución de las RVS, con su punto mínimo entre las semanas 24 y 28, y retorna a valores pregestacionales en el tercer trimestre7,8.
•Aumento del gasto cardíaco desde la semana 10, con una meseta a inicio del tercer trimestre, llega a valores 30-50% mayores que en no embarazadas, debido sobre todo al aumento del volumen sistólico y la frecuencia cardíaca. Este aumento de la frecuencia cardíaca es de 10-15 latidos/minuto promedio7,8.
•Disminución de la presión oncótica intersticial y plasmática, lleva en conjunto con el aumento de la presión hidrostática capilar a la aparición de los edemas fisiológicos del embarazo en miembros inferiores. Estos edemas pueden agravarse frente a estados hipertensivos que aumenten aún más la presión hidrostática capilar o frente a patologías que disminuyen la presión oncótica como las nefropatías o hipoalbuminemia de otra causa (malabsorción, etc.)7,8.
La postura materna, sobre todo en el tercer trimestre, puede afectar la presión arterial y el gasto cardíaco, ya que el útero grávido en posición supina puede comprimir la aorta y más aún la vena cava, por lo que disminuye el retorno venoso al corazón. Este es el llamado efecto Poseiro, que se revierte con el decúbito lateral. Este efecto fue descrito durante las contracciones uterinas y se puede detectar clínicamente por la disminución de la amplitud del pulso femoral durante la contracción uterina9,10.
En el periparto ocurren cambios adicionales en la hemodinamia materna, este es uno de los períodos de mayor riesgo en las pacientes cardiópatas:
•En la operación cesárea, la presión que se realiza a nivel del fondo uterino para facilitar el nacimiento comprime la vena cava y disminuye aún más la precarga. También disminuye la frecuencia cardíaca, probablemente por estímulo vagal, lo que lleva a la disminución del gasto cardíaco.
•En el puerperio inmediato ocurren cambios a nivel del sistema venoso. En un parto normal se pueden perder hasta 500 mL de sangre y en una cesárea hasta un litro aproximadamente. En los casos de hemorragia posparto, el retorno venoso puede estar gravemente disminuido. Por otro lado, el alumbramiento de la placenta y la contracción rápida y tónica del útero pueden generar un aumento brusco del retorno venoso, sobre todo si la placenta es removida de forma manual durante la cesárea y se administran oxitócicos.
•Los fármacos uteroconstrictores que se utilizan en el alumbramiento activo tienen efecto en el tono vascular, la oxitocina habitualmente lo disminuye mientras que la metilergonovina lo aumenta.
•En el puerperio inmediato ocurre una disminución adicional en la presión oncótica plasmática, con un punto máximo entre las 6 y 16 horas. El edema marcado secundario a esto puede hacer que pase desapercibida una descompensación cardíaca7,8.
Clasificación y riesgo
Para una correcta estratificación de riesgo es fundamental considerar el tipo de “lesión” cardíaca que presenta y el estado funcional materno.
Se debe ahondar sobre el diagnóstico de cardiopatía previo y analizar los datos presentes en la historia clínica. Es fundamental determinar la clase funcional, la presencia de cianosis, así como de otras patologías asociadas intercurrentes.
Mediante la evaluación ecocardiográfica se determinará la función ventricular y valvular, las presiones arteriales pulmonares y otros trastornos presentes. En caso de contar con los niveles del péptido natriurético auricular previo al embarazo su valor puede ser de utilidad como elemento pronóstico11.
Las patologías cardiovasculares se clasifican de acuerdo con su etiología en congénitas y adquiridas y serán abordadas específicamente en otro capítulo de esta edición.
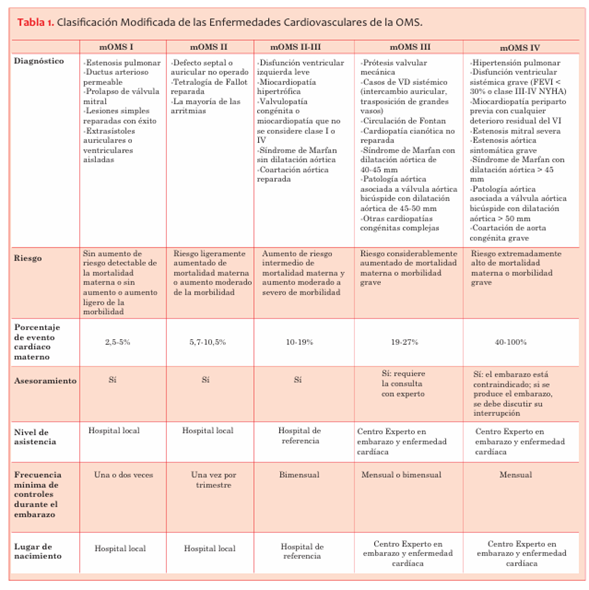
Existen diferentes clasificaciones pronósticas para valorar el riesgo de complicaciones maternas en la gestación de mujeres con patología cardíaca. Las más conocidas y utilizadas son: la Clasificación Modificada de las Enfermedades Cardiovasculares de la Organización Mundial de la Salud (mOMS)1, el score de CAPREG y ZAHARA12,13,14. La clasificación de riesgo modificada de la OMS es la que mejor se correlaciona con las complicaciones maternas durante la gestación y es la que se recomienda usar para valorar el riesgo del embarazo12,13. Incluye todos los factores de riesgo cardiovasculares maternos conocidos, incluidas las cardiopatías de base y cualquier otra comorbilidad (Tabla 1).
El riesgo de cada patología específica debe ser evaluado de acuerdo a esta clasificación. Esta permite, considerando el diagnóstico previo y el riesgo de mortalidad materna, realizar asesoramiento preconcepcional, determinar el número mínimo de controles prenatales y las características del sitio de asistencia al momento del nacimiento.
Controles durante el embarazo: rol del equipo multidisciplinario
El manejo de la gestación debe realizarse en una Unidad de Medicina Materno-Fetal a cargo de un equipo multidisciplinario que incluya al cardiólogo de referencia, especialista en medicina materno-fetal de alto riesgo, obstetra, anestesiología y neonatología.
Será de especial interés contar con el seguimiento del equipo de psicología, dado que es fundamental que la paciente y su familia entiendan los riesgos que estos embarazos conllevan.
La frecuencia de los controles en las Unidades interdisciplinarias de Medicina Materno-Fetal dependerá de la gravedad de la patología de base que presenta. Se recomienda que en patologías grado I y II de la OMS la frecuencia sea al menos uno por trimestre. En patologías II y III de la OMS se recomienda un control mensual y puede requerirse un control de dos veces por mes a medida que progresa el embarazo o si aparecen síntomas nuevos13.
En caso de presentar una valoración de riesgo de grado IV de la OMS, se recomendará la interrupción del embarazo dada la alta morbimortalidad presente en un embarazo en estas condiciones. Si se continúa con el embarazo, los controles deberán ser muy estrechos e incluso requerirán hospitalización durante el embarazo.
La determinación basal de los niveles de péptido natriurético auricular (BNP) pueden ser de utilidad para detectar la presencia de descompensaciones durante el embarazo. Los niveles medios de BNP en plasma de mujeres embarazadas normales son el doble que los de los controles de no embarazadas. En aquellas embarazadas con patología cardiovascular crónica o hipertensión arterial crónica severa la elevación significativa de los valores de BNP puede ser un indicador de descompensación15. A su vez, los valores de pro-BNP elevados (> 128 pg/ml) medidos a las 20 semanas de edad gestacional en pacientes con CC podrían ser un factor de riesgo independiente de eventos cardíacos adversos16.
El objetivo de este documento es intentar estandarizar el manejo general de la gestante con cardiopatía, pero en muchas ocasiones se requerirá un manejo individualizado según la patología de base.Las recomendaciones generales son:
•Valorar la clase funcional NYHA en cada visita.
•Valorar la indicación o el riesgo/beneficio de la profilaxis tromboembólica.
Los embarazos en pacientes con cardiopatía conllevan mayor riesgo tromboembólico. La correcta valoración de la cardiopatía de base junto con otros factores de riesgo trombóticos asociados (como edad, paridad, obesidad, presencia de otras comorbilidades médicas, etc.) pueden determinar la necesidad de realizar tromboprofilaxis anteparto y/o posparto. Destacamos que durante el puerperio el riesgo tromboembólico es aún mayor que durante el embarazo, por lo que debe considerarse fuertemente la necesidad de tromboprofilaxis en este período.
Las pacientes que ya requerían anticoagulación previa al embarazo (válvulas protésicas, fibrilación auricular o enfermedad tromboembólica previa) deberán continuar anticoaguladas. Las consideraciones para elegir un régimen anticoagulante deben incluir efectos adversos fetales (embriopatía por warfarina en el primer trimestre), riesgo de sangrado y riesgo de trombosis en la válvula protésica. Existen numerosas guías clínicas al respecto y existe más de un esquema posible1,12,13.
•Adaptar la actividad física a la cardiopatía de base y a la clase funcional.
Puede ser necesario realizar un test de la marcha para valorar si existe desaturación de oxígeno durante el ejercicio y/o tolerancia a este. En caso de caída de la saturación o aparición de sintomatología, debe limitarse la actividad física y valorar la necesidad de oxigenoterapia. No está indicada la oxigenoterapia en forma sistemática en las CC cianóticas17.
Es importante recordar que en las embarazadas luego de la segunda mitad del embarazo puede existir una mala tolerancia al decúbito supino, por la disminución en el retorno venoso por compresión de la vena cava inferior, y se recomienda el decúbito lateral izquierdo.
•Garantizar un buen nivel de Hb y ferritina utilizando suplemento de hierro, si es necesario, para evitar el componente de anemia ferropénica.
•Elegir el tratamiento farmacológico y determinar los fármacos que se indicarán en cada momento de la gestación deben estar determinados por la ecuación riesgo-beneficio, se deben priorizar aquellos fármacos que cuentan con evidencia que determina seguridad en su uso durante este período.
•Planificar el nacimiento.
Finalización de la gestación
Uno de los aspectos que más preocupa a las gestantes y el equipo de salud es el momento del nacimiento y la posibilidad de que este sea prematuro, sabiendo que la prematurez es la principal causa de morbimortalidad neonatal. Durante mucho tiempo la decisión sobre el momento oportuno de nacimiento se basó en la experiencia clínica personal del equipo tratante.
Hoy en día, sabemos que la toma de decisiones acerca del momento oportuno para la finalización de la gestación debe ser individualizada. No existen guías que determinen el momento de interrupción de la gestación en pacientes con enfermedad cardiovascular, sin embargo, a nivel internacional múltiples estudios coinciden en que, si no media ninguna complicación obstétrica, neonatal o peoría sintomática desde el punto de vista cardiovascular materno, el nacimiento debería ser al término del embarazo18.
Si bien la paciente con cardiopatía tiene un riesgo aumentado de complicaciones maternas y fetales, el riesgo absoluto de la aparición de estas y mortalidad materna es bajo al momento del nacimiento, ocurre en menos de un 0,5% de los casos19.
En el año 2023 fue publicado por la American Heart Association un estudio de cohorte retrospectivo que incluía 110 mujeres embarazadas con cardiopatía, con embarazo único y cuyo nacimiento sucedió luego de las 37 semanas en un centro de atención de cuarto nivel, en un período de tiempo de 8 años (2013-2021)20. El objetivo de este estudio fue comparar los efectos adversos a nivel cardiovascular, complicaciones obstétricas y complicaciones neonatales en dos grupos de pacientes: nacimientos de términos precoces (37 + 0 a 38 semanas + 6 días) y nacimientos al término tardío (≥ 39 semanas de edad gestacional). No se encontró diferencia significativa en cuanto al desarrollo de eventos adversos obstétricos ni cardiovasculares (aparición de insuficiencia cardíaca o empeoramiento de esta; arritmia sintomática o mantenida; aparición de disfunción valvular o empeoramiento ya preexistente; endocarditis, complicaciones embólicas, necesidad de intervención cardíaca o tratamiento; paro cardíaco; muerte cardíaca) entre ambos grupos.
No obstante, la tasa de complicaciones neonatales fue mayor en aquellos nacimientos que se produjeron en el término precoz de la gestación versus el término tardío.
Como conclusión de este estudio, la finalización de la gestación entre las 37 semanas-38 semanas + 6 días de edad gestacional no disminuyó el riesgo de aparición de efectos adversos cardiovasculares maternos ni obstétricos y sí se asoció con un aumento de complicaciones neonatales. Si no median indicaciones obstétricas y/o neonatales para el nacimiento en el término precoz, se recomienda la inducción del parto a partir de ls 39 semanas en adelante.
Por otra parte, la Sociedad Europea de Cardiología (ESC) recomienda la finalización de la gestación en madres con cardiopatías a las 40 semanas. De esta manera, disminuye el riesgo de cesáreas y de bajo peso al nacer del neonato1.
Vía de finalización
El solo hecho de que una mujer embarazada sea portadora de cardiopatía no es indicación de cesárea. Las guías internacionales coinciden en que las mujeres con cardiopatías (salvo algunas excepciones como uso de anticoagulantes orales en paciente en trabajo de parto activo, disfunción aórtica significativa, hipertensión pulmonar severa e insuficiencia cardíaca intratable) se benefician de la finalización por parto vaginal en la gran mayoría de los casos. Esta última se asocia con menor pérdida sanguínea, menor riesgo de infección y menor tasa de complicaciones tromboembólicas1.
Es esencial que la asistencia de trabajo de parto, parto y puerperio sea estrictamente monitorizada, tanto a nivel materno como feto-neonatal.
Se recomienda registro de presión arterial, saturometría de pulso y frecuencia cardíaca materna, así como también monitorización fetal continua. En pacientes con enfermedad cardíaca grave, se recomienda la monitorización a través de catéter arterial.
Por todo lo antedicho, se recomienda el nacimiento en un centro obstétrico de tercer nivel que cuente con unidad de cuidados críticos obstétricos neonatales e idealmente un centro de hemodinamia1,19.
Contamos con métodos farmacológicos y no farmacológicos para la inducción del trabajo de parto. El uso de prostaglandinas como el misoprostol y la dinoprostona pueden causar vasodilatación, pero en general son bien tolerados por estas pacientes.
El uso de oxitocina puede generar cambios a nivel electrocardiográfico materno y vasodilatación, pero son complicaciones infrecuentes.
Las medidas no farmacológicas como colocación de sonda Foley intracervical y la rotura artificial de membranas ovulares (amniorexis) son métodos seguros1,19.
Durante el trabajo de parto, los niveles de adrenalina y noradrenalina se elevan en forma significativa; la administración de analgesia del parto se asocia con la disminución de estos valores. A su vez, la presencia de un catéter peridural normoposicionado permite la conversión rápida a anestesia en caso de requerir una operación cesárea. Las fluctuaciones en el gasto cardíaco durante el trabajo de parto están en relación con el aumento del volumen sanguíneo durante las contracciones por autotransfusión, así como por la liberación de catecolaminas. A medida que el trabajo de parto progresa, estas fluctuaciones del gasto cardíaco son mayores en amplitud. Por esto, en las pacientes con patología cardíaca el inicio de la analgesia del parto debe hacerse en forma temprana para reducir estas variaciones bruscas del gasto cardíaco21,22,23.
La analgesia epidural puede causar hipotensión sistémica (10%), por lo que su administración debe ser cuidadosa en estos casos.
El uso rutinario de una carga de fluidos intravenosos para prevenir la hipotensión arterial asociada al inicio de la analgesia del parto tiene poca evidencia y no está indicado en las pacientes con cardiopatías previas. Tanto la administración cuidadosa de bolos pequeños de fluidos como de vasopresores pueden usarse al inicio de la analgesia para tratar disminuciones de la presión arterial. En caso de necesitar aumentar las resistencias vasculares sistémicas, se pueden administrar dosis bajas de fenilefrina y noradrenalina, la cual utilizada en infusiones diluidas puede ser administrada por vía periférica en forma segura.
Muchas veces las pacientes portadoras de enfermedades cardíacas se encuentran bajo tratamiento con anticoagulantes, se deberá considerar el tiempo desde la última dosis y el tipo de anticoagulantes para disminuir el riesgo de hematoma epidural. Las guías de la Sociedad Americana de Anestesia Regional señalan que las técnicas neuroaxiales pueden ser administradas con seguridad a mujeres que reciben heparina de bajo peso molecular a bajas dosis luego de 12 horas de la última dosis (por ejemplo, enoxaparina ≤ 40 mg día o 30 mg cada 12 h) o luego de 24 h si recibe altas dosis (por ejemplo, enoxaparina 1 mg/kg cada 12 h o 1,5 mg/kg por día) de heparina de bajo peso molecular1,24.
En el caso de la finalización del embarazo por vía cesárea, se prefiere el uso de técnicas neuroaxiales siempre que sea posible, incluso en pacientes con lesiones clase III o IV de la clasificación de la OMS. Los cambios hemodinámicos relacionados con la instalación de la anestesia intratecal son más rápidos y pronunciados que los que produce la anestesia peridural. Las mujeres que presentan patologías clasificadas como clase I o II de la clasificación de la OMS toleran generalmente bien la anestesia raquídea. Según la patología cardíaca previa, algunas mujeres pueden beneficiarse de una instalación más gradual del bloqueo simpático.
La monitorización durante la operación cesárea incluye los monitores estándar de la ASA y muchas veces se agrega la monitorización de la PA invasiva. La monitorización de la PA latido a latido permite titulación de vasopresores tanto en la instalación del bloqueo neuroaxial como en caso de requerir anestesia general.
La anestesia general está indicada en casos de descompensación cardiopulmonar, anticoagulación, plaquetopenia severa o negativa de la madre a la anestesia regional21,25.
En el puerperio, se suceden grandes cambios hemodinámicos y de fluidos, por lo cual debemos mantener una monitorización materna estricta durante las primeras 24-48 horas.
Se recomienda el uso de métodos de compresión a nivel de miembros inferiores, deambulación precoz y tromboprofilaxis (si no existen contraindicaciones)1.
Anticoncepción
Es crucial para el éxito de un embarazo en una mujer con cardiopatía la valoración preconcepcional y también el asesoramiento anticonceptivo, el cual debe comenzar en la adolescencia. El uso de estrógenos aumenta el riesgo de tromboembolismo venoso e hipertensión. La ESC recomienda evitar el uso de estrógenos en caso de mujeres con cardiopatía con antecedentes de trombosis, cianosis, circulación de Fontan; asimismo, si son portadoras de válvulas mecánicas y si tienen hipertensión pulmonar. El uso de anticonceptivos con progesterona exclusivos es considerado de menor riesgo para estas pacientes, por el bajo riesgo de trombosis.
Los dispositivos intrauterinos (DIU) son un método seguro en pacientes de alto riesgo. Dentro de ellos se encuentra el DIU no hormonal, que puede ocasionar aumento de sangrado menstrual (por lo cual no se considera el método de elección en pacientes anticoaguladas) y el SIU, sistema intrauterino de liberación de levonorgestrel, que tiene un efecto anticonceptivo excepcional y disminuye el sangrado menstrual, por lo que se considera el método de elección en la mayoría de las pacientes con cardiopatía.
Es importante que la colocación de los dispositivos intrauterinos se realice en un centro de tercer nivel de atención dado el riesgo de reacción vasovagal tras su colocación19.