Introducción
La hernia diafragmática congénita (HDC) es un defecto en el diafragma que lleva a la herniación del contenido abdominal a la cavidad torácica durante el período intrauterino, estando presente al nacimiento. Se caracteriza por la presencia de hipoplasia pulmonar que puede afectar al pulmón izquierdo, derecho o ambos según la localización del defecto. La morbimortalidad está determinada fundamentalmente por la asociación con otras malformaciones, el grado de hipoplasia pulmonar y la presencia de hipertensión pulmonar secundaria1.
Presenta una incidencia estimada de 1 cada 2.500-3.000 recién nacidos vivos. En las últimas tres décadas, los avances en el cuidado neonatal han mejorado la sobrevida de estos pacientes, aumentando hasta un 85% en centros altamente especializados2. Sin embargo, esto se ha visto acompañado de un aumento en la morbilidad a largo plazo1.
Según la ubicación se pueden clasificar en izquierdas, que constituyen el 85%, derechas 13% y bilaterales 2% siendo estas últimas consideradas letales. Otras formas de presentación menos frecuentes son las anteriores, tipo Morgagni (27%) o paraesternal (2-3%). La forma de presentación más frecuente es posterolateral izquierda (de Bochdalek)3.
60% constituyen una malformación aislada pero hasta en 40% de los casos pueden asociar otras malformaciones o síndromes genéticos4. Las anomalías más frecuentemente asociadas son los defectos cardíacos (60%), renales (23%), gastrointestinales (17%) y los del sistema nervioso central (14%).
La etiopatogenia es desconocida. Originalmente se creía que el defecto comenzaba con el cierre incompleto de los canales pleuroperitoneales entre la semana 6 y 10 de gestación, lo que provocaba la herniación de vísceras abdominales a la cavidad torácica interfiriendo en el proceso normal del desarrollo traqueobronquial. En la actualidad se postula que podría existir una anomalía primaria del desarrollo pulmonar con hipoplasia pulmonar severa, siendo la hernia diafragmática una consecuencia. Este mecanismo podría explicar las diferencias existentes en el resultado perinatal y en la respuesta a terapia prenatal en casos aparentemente similares5.
En un estudio realizado por Vezzaro en el Centro Hospitalario Pereira Rossell (CHPR) entre enero de 2007 y julio de 2022, se encontró una incidencia de 0,04 cada 1.000 recién nacidos vivos, lo que equivale a ½.500 RNV. Un 18% fueron HDC derechas, 72% izquierdas, una sola bilateral y en un 8% no se encontró dato al respecto. La sobrevida global fue de un 49% mientras que la mortalidad global de un 51%, discriminando dentro de la última un 86% en HDC derechas y un 39% en izquierdas. De los pacientes fallecidos 85% desarrollaron hipertensión pulmonar3.
Cabe destacar ante la elevada incidencia y mortalidad de nuestro centro que es de referencia para el país y recibe pacientes tanto del medio público como del privado de todo el Uruguay.
Definición
La hernia diafragmática congénita se trata de un defecto durante la vida fetal en el diafragma que lleva a la herniación del contenido abdominal en la cavidad torácica, presentando sintomatología después del nacimiento. En algunos casos puede ser un diagnóstico incidental en la vida adulta.
El contenido abdominal en la cavidad torácica puede llegar a ocasionar desarrollo pulmonar anormal, con hipoplasia e hipertensión pulmonar, que son los principales determinantes de la morbimortalidad de estos pacientes.
Diagnóstico prenatal
El diagnóstico de HDC se ha vuelto un diagnóstico prenatal en los últimos tiempos dado el correcto control del embarazo y la realización de la ecografía morfoestructural y subsiguientes.
La HDC es una patología evolutiva que puede ser diagnosticada a partir de la semana 20-24.
El diagnóstico ecográfico se basa en las siguientes características:
- Desviación mediastínica: parámetro universal de hernia diafragmática. Toda hernia diafragmática tiene desviación del mediastino. A las 22 semanas las asas libres de meconio tienen la misma ecogenicidad que el pulmón por lo que la única pista es la desviación mediastínica. El diagnóstico de hernia diafragmática izquierda en el segundo trimestre sin herniación de cámara gástrica suele ser dificultoso y la única sospecha es ante la dextroposición cardíaca. El diagnóstico de hernia diafragmática derecha es mucho más dificultoso.
- Herniación de vísceras abdominales (intestino, estómago, hígado, bazo) a la cavidad torácica: el diagnóstico de hernia diafragmática es más fácil en el tercer trimestre por la mayor distensión de las asas intestinales y en los casos en que el estómago está en el tórax. En el primer trimestre es muy raro realizar diagnóstico aún con herniación de cámara gástrica.
- La presencia de líquido amniótico aumentado puede ser objetivado a partir de la semana 26 en la mayoría de los casos.
Si bien la posibilidad de diagnóstico prenatal es alta existen falsos positivos, donde las imágenes son compatibles con otro tipo de patología.
Las malformaciones congénitas de las vías respiratorias, como las lesiones quísticas pulmonares, son el principal diagnóstico diferencial. Son las lesiones pulmonares congénitas más frecuentes, en general son unilaterales y se clasifican según el tamaño de sus quistes, sus características celulares y su localización. La tipo 1 es la lesión más frecuente, se caracteriza por la presencia de quistes grandes mayores de 2 cm que se originan en los bronquios distales o bronquiolos proximales, y se limitan a un único lóbulo en un 95% de los casos. El diagnóstico prenatal es ecográfico, pudiéndose observar desviación mediastínica debido al efecto de masa de la lesión y una masa sólida, intermedia o quística6.
Otro de los posibles diagnósticos diferenciales es el secuestro pulmonar. Esta es una anomalía congénita caracterizada por una porción de tejido pulmonar embrionario, no funcional, con falla en la conexión con el árbol traqueobronquial normal, que recibe aporte sanguíneo de una arteria aberrante sistémica originada en la aorta descendente en lugar de la circulación arterial pulmonar7,8. Estas anomalías se localizan casi siempre en la base de los pulmones y más a menudo en el izquierdo9. Ecográficamente se evidencia una masa hiperecogénica y otros signos indirectos como desviación cardíaca, hidropis fetal, derrame pleural y polihidramnios10,11.
Por último dentro de los diagnósticos diferenciales cabe mencionar a la atresia laríngea o el síndrome de obstrucción de las vías aéreas altas (CHAOS). Este corresponde a una malformación poco frecuente, que se comporta de forma letal para el recién nacido tras el parto. Se define como una obstrucción completa o casi completa de las vías aéreas altas, que puede ser provocada por diversas etiologías: atresia laríngea, atresia traqueal o quistes o «telas» laríngeas. Algunos de los hallazgos ecográficos que ayudan a sospechar esta patología son el alargamiento, hipertrofia e hiperecogenicidad pulmonar bilateral, inversión del diafragma, vías aéreas dilatadas, pudiendo confundirse con la presencia de asas intestinales dentro de la cavidad torácica12.
Dadas las características de los diagnósticos diferenciales pueden ser beneficiosos para un diagnóstico adecuado estudios complementarios como un estudio ecográfico detallado, ecocardiografía fetal y una resonancia magnética para definir con exactitud la patología pulmonar y descartar diferenciales. Además supone mayor información en lo que respecta en la evaluación de la localización del defecto y sus características, valoración de factores pronósticos así como su asociación con otro tipo de malformaciones.
Se debe ofrecer consulta con genetista y amniocentesis para cariotipo y array-CGH dada la posibilidad de asociación con defectos cromosómicos. Si bien la mayoría de las veces es un evento esporádico (60%), puede presentarse como parte de defectos cromosómicos, principalmente trisomía 13 o 18 y ocasionalmente tetrasomía 12p o síndrome de Pallister-Killian, en el 15%-20% de los casos. El 2%-3% se asocia a síndromes genéticos. El más común es el síndrome de Fryns (anoftalmia, fisura facial, micrognatia, ventriculomegalia, hernia diafragmática)13. Aún en ausencia de síndromes genéticos existe asociación a defectos cardíacos, pulmonares y craneofaciales.
La valoración prenatal cardíaca es muy importante, dado que los defectos cardiovasculares son los más comúnmente asociados con la presencia de HDC (un tercio de los casos y en un 15% de los pacientes sin síndromes asociados)14,15.
Evaluación de severidad y factores pronósticos
La hipoplasia pulmonar (pulmón mal desarrollado y chico) es una de las más graves e irreversibles causas de mortalidad por dificultad respiratoria, que llega hasta 50% a 70%. La HDC es una de las patologías responsables de esta grave entidad. La evaluación de la hipoplasia pulmonar fetal es fundamental para establecer pronósticos vitales.
- El grado de severidad se establece midiendo el área de pulmón contralateral a la HD, en un corte transverso de tórax y la circunferencia cefálica.
- Ambas medidas se relacionan entre sí mediante el lung-to-head-ratio (LHR) que se compara con el LHR en fetos normales LHR O/E. Es una medida indirecta del grado de hipoplasia pulmonar y del grado de desviación del mediastino. Estima el volumen pulmonar contralateral. Se debe realizar entre las 20 y 30 semanas de edad gestacional, ya que es más constante y después de las 30 semanas cae su valor predictivo. Clasifica a la hernia en severa si el ratio es menor o igual a 25%, moderada si es entre 26% y 45% o leve si es mayor a 45%. Una relación <1,2 indica una evolución adversa con una supervivencia menor del 38%, mientras que si la relación es de 1,4 pronostica una supervivencia cercana al 100%.
Valores de corte: O/E LHR 26% LHR 1,2
La RNM puede valorar con mayor precisión la proporción de hígado herniado en tórax y el volumen pulmonar total (VPT).
La evaluación de la posición del estómago se ha transformado en los últimos tiempos en el factor pronóstico más utilizado. La posición exacta del estómago se ha correlacionado con la morbimortalidad posnatal independientemente del LHR O/E15,16. La posición grado 4, donde la mayor parte de estómago se encuentra al lado de la aurícula en el hemitórax derecho, presenta una sobrevida del 12%17.
Valorar la posición del hígado: si se encuentra intratorácico se asocia con mal pronóstico, con supervivencia de 43%, si es intraabdominal la supervivencia es de 93%.
Índice de McGoon, postnatal: diámetro de arteria pulmonar derecha + diámetro de arteria pulmonar izquierda, dividido el diámetro de la aorta descendente a nivel del diafragma(RPA+LPA)/DA). El punto de corte es 1,4. Un índice de 1,3 presenta una mortalidad de 80%.
Otros indicadores de mal pronóstico son: polihidramnios, prematurez, malformaciones asociadas, hipertensión pulmonar.
Tanto el diagnóstico prenatal como la evaluación de la severidad son de gran importancia para asesorar a los padres, establecer pronósticos y determinar el lugar del nacimiento. Además permite seleccionar los pacientes podrían beneficiarse de tratamiento fetal intraútero.
El tratamiento fetal, FETO por sus siglas en inglés (fetoscopic endoluminal tracheal occlusion), consiste en la inserción endoscópica de un balón intratraqueal, con la consecuente retención de fluido secretado por los pulmones para favorecer el crecimiento pulmonar. Para aquellas HDC severas, el balón se inserta entre las 26 y 30 semanas y se retira a las 34-36 semanas, dependiendo del centro18-20.
La terapia fetal aumenta la supervivencia del 24% al 49% en HDC izquierda y del 0% al 35% en la HDC del lado derecho21.
Se debe realizar control ecográfico cada 4 semanas para monitorizar el crecimiento pulmonar y el volumen de líquido amniótico, pudiendo ser necesario realizar un amniodrenaje en caso de polihidramnios y acortamiento cervical. Existe un riesgo de muerte fetal de alrededor de 5%20.
Asistencia en sala de partos
El momento adecuado para el nacimiento continúa siendo controversial. Hutcheon y colaboradores realizaron un estudio retrospectivo, donde se captaron todos los recién nacidos a término con HDC e inicio de trabajo de parto espontáneo, valorando según la edad gestacional al nacimiento y la mortalidad. Con un total de 928 pacientes enrolados, se vio un descenso significativo de la mortalidad neonatal en los nacidos a las 40 semanas de edad gestacional con respecto a los nacidos a las 37 semanas (de 25 a 16,7%)22. Sin embargo otros estudios no encontraron diferencia significativa entre las diferentes edades gestacionales al nacimiento y la mortalidad, o de la vía de nacimiento (parto o cesárea). Dada la falta de consenso y la necesidad de mayores estudios, con la evidencia actual parece lo más conveniente planificar el nacimiento a partir de las 39 semanas de gestación, siempre y cuando las condiciones maternas y fetales lo permitan.
Debemos tener en cuenta que si el parto se anticipa, en fetos menores de 34 semanas el uso de corticoides antenatales se encuentra indicado por la prematurez y no como uso sistemático por la presencia de la HDC.
Luego del nacimiento, durante la estadía en sala de partos, es muy importante mantener una adecuada monitorización de la frecuencia cardíaca, la saturación pre y posductal y la presión arterial. Esto permite asegurar una adecuada perfusión y mantener la saturación entre 80%-95%.
En las primeras dos horas después del nacimiento se toleran niveles de saturación de hasta 70% si el paciente va a la mejoría sin cambios en los parámetros ventilatorios, con una adecuada perfusión, un pH mayor a 7,2 y con PcO2 menores a 65 mmHg.
El Consenso Europeo para el manejo de los recién nacidos con HDC recomienda la intubación orotraqueal sistematizada en todos los recién nacidos con diagnóstico prenatal de HDC, inmediatamente después del nacimiento1.
Como se mencionó anteriormente se deben mantener presiones bajas en vía aérea (menores a 25 mm H2O), para evitar el daño del pulmón sano. Se debe administrar medicación previa a la intubación, dado que se han demostrado aumentos en la presión arterial sistémica e intracraneal, con caída de la frecuencia cardíaca y de la saturación en los recién nacidos que no lo reciben.
Los bloqueadores neuromusculares deben evitarse durante el tratamiento inicial en la sala de parto, dado que no se ha visto beneficio y deterioran la compliance pulmonar, por lo que deben optarse otros agentes para mantener la sedación y analgesia del recién nacido.
Se debe colocar sonda nasogástrica u orogástrica con el fin de desgravitar el estómago, evitando su sobredistensión y la compresión del pulmón ipsilateral.
Traslado del paciente
El adecuado diagnóstico prenatal permite la preparación para el momento del nacimiento, coordinando el mejor ambiente para el parto y el tratamiento neonatal en un centro terciario con experiencia (mayor a 5 pacientes por año).
En más de un tercio de los pacientes se desencadena trabajo de parto espontáneo previo a las 35 semanas, por lo que de ser necesario el traslado, lo más adecuado es que sea intrauterino a las 34 semanas de edad gestacional18.
Si se realiza luego del nacimiento, el paciente debe encontrarse en asistencia ventilatoria mecánica de acuerdo a la recomendación de ventilación al nacimiento de las guías europeas. La ventilación debe ser gentil, evitando altas presiones, por lo que lo más adecuado es realizar el traslado con ventilador o en su defecto con reanimador neumático neonatal, evitando la bolsa autoinflable. Mantener saturaciones entre 85% a 95% luego de la primera hora de vida.
El traslado se realizará con el paciente en incubadora, posicionado a 45º para mejorar la dinámica ventilatoria y evitar aspiraciones del contenido gástrico. Se debe realizar monitorización electrocardiográfica y saturometría de pulso, y colocar sonda orogástrica en posición de degravitacion y por lo menos un acceso vascular.
El traslado deberá realizarse por personal idóneo que conozca el manejo de la patología.
Asistencia en cuidados intensivos
Un recién nacido con diagnóstico de HDC, tiene indicación de ingreso a cuidados intensivos neonatales, de ser posible en una unidad con experiencia en el manejo de ésta patología.
El paciente se debe mantener monitorizado (Tabla 1).
Accesos vasculares
La vía arterial debe colocarse preferiblemente en la arteria radial derecha, ya que la PaO2 preductal es la que refleja el nivel de oxígeno administrado al cerebro. Además del control de la oxigenación, se utilizará también para la toma de muestras de sangre y controlar la presión arterial.
La vía arterial umbilical es menos deseable, dado que refleja la situación posductal, pero puede brindar un acceso arterial más seguro a largo plazo.
Es necesario contar con al menos dos accesos vasculares venosos centrales: catéter venoso umbilical (puede ser difícil su correcta topografía por la herniación del hígado, en caso de dudas confirmar posición por ecografía) en los casos de disponer es conveniente la colocación de catéter doble lumen, y un catéter percutáneo.
Radiografía de tórax
Para la evaluación inicial del paciente, se debe obtener lo antes posible una radiografía de tórax (Figura 1).
Ventilación
Se debe realizar ventilación inmediata al nacimiento en recién nacidos con diagnóstico prenatal de HDC.
Si se predice que tendrán un buen desarrollo pulmonar (diagnóstico de desarrollo pulmonar por estudios fetales: defecto del lado izquierdo, LHR O/E >50% e hígado hacia abajo), y en función de su evolución neonatal, la respiración espontánea podría considerarse para prevenir la lesión pulmonar inducida por el ventilador1.
Siempre se debe iniciar la asistencia ventilatoria mecánica en modo convencional ya que se ha demostrado que la duración de la ventilación es significativamente más corta, los pacientes tienen menos necesidad de óxido nítrico inhalado (iNO) o sildenafil, requieren menor tiempo de inotrópicos y presentan menos probabilidades de requerir ECMO1,23.
Se deben utilizar bajas presiones inspiratorias máximas (PIM), preferiblemente <25 cm H2O, y PEEP de 3-5 cmH2O, ajustando la frecuencia del ventilador para obtener PaCO2 entre 50 y 70 mmHg (Tabla 2).
La hipercapnia permisiva y la “ventilación suave” aumentan la supervivencia en neonatos con HDC.
En el caso del destete, lo primero que debe reducirse es la presión máxima. A partir de entonces, la frecuencia o PEEP pueden reducirse siempre que pCO2 <50 mmHg.
Si se necesita un PIM >28 cm H2O para alcanzar los niveles de pCO2 y saturación dentro del rango objetivo, se deben considerar otras modalidades de tratamiento (como la ventilación de alta frecuencia oscilatoria o ECMO).
Hemodinamia
La inestabilidad hemodinámica es frecuente en los recién nacidos con HDC, y requiere una detección oportuna con búsqueda de la causa y tratamiento efectivo para optimizar la perfusión y atenuar los efectos de la hipertensión pulmonar severa.
Varios mecanismos podrían contribuir al compromiso cardiovascular en los pacientes con HDC. La hipoplasia pulmonar podría disminuir el flujo sanguíneo pulmonar que retorna a la aurícula izquierda en la vida fetal, el flujo sanguíneo a través de los vasos pulmonares se reduce a la mitad en los pacientes con HDC. Esto altera el correcto desarrollo de la vascularización pulmonar y la vía aérea24.
Por otra parte la posición anormal del eje cardíaco dentro del tórax fetal podría impedir el retorno venoso a las cavidades derechas así como la redistribución del volumen minuto de las cavidades izquierdas podría empeorar aún más la función del ventrículo izquierdo subdesarrollado, complicando la evolución24.
Manejo de la presión arterial
Mantener la presión arterial en niveles normales para la edad gestacional si las saturaciones preductales permanecen entre 80 y 95% (Tabla 4).
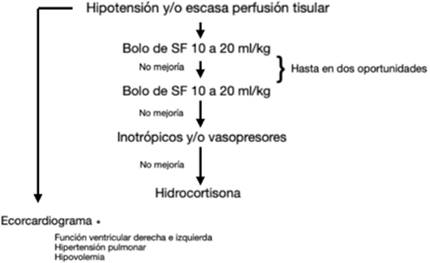
Puede que se requiera el uso de inotrópicos e hidrocortisona para lograr los objetivos (Figura 2), (Tabla 5).
En el caso de la HDC con hipoplasia pulmonar e hipertensión pulmonar de difícil manejo, en pacientes con hipotensión sistémica y buena función cardíaca, la noradrenalina puede tener un mejor efecto a dosis bajas (0,01-0,5 µg/kg/min).
En los casos de hipotensión sistémica con disfunción cardiaca (VI o VD), que no mejora con adrenalina, existe la posibilidad de agregar milrinona (0,35 - 0,75 µg/kg/min hasta un máximo de 1 µg/kg/min). Antes de su inicio es conveniente controlar la volemia en caso de confirmar o sospechar hipovolemia asociada, administrar volumen (SF 10 ml/kg en 30 minutos) previo a su inicio.
Ecocardiograma
Se recomienda realizar dos ecocardiogramas reglados.
En las primeras 48 horas de vida para valorar anatomía y función cardíaca, el tamaño de las arterias pulmonares (índice de McGoon), la severidad de la hipertensión pulmonar y la presencia y dirección de shunts tanto ductal como intracardíaco, y la función ventricular.
En el período posoperatorio se debe valorar por un lado la posición del corazón ya que se vio que su retorno a una posición normal luego de la reparación quirúrgica del defecto diafragmático se asocia con evolución desfavorable24, como mencionaremos posteriormente.
Además de alterar la posición del corazón, la HDC también altera el desarrollo del mismo. La medición de la masa del ventrículo izquierdo también es un indicador de supervivencia dado que una masa disminuida se asocia con peor pronóstico24. Esta no es una medición que se realice de forma rutinaria en nuestro medio.
Otro hallazgo ecocardiográfico es el aumento en el índice entre el flujo en la válvula pulmonar y el flujo en la válvula aórtica en comparación con los fetos sanos. Esto refleja una redistribución del volumen minuto desde el ventrículo izquierdo a las cámaras derechas, también parecería contribuir al menor desarrollo de la masa ventricular izquierda24.
Entre las dos a tres semanas de vida, tiene valor predictivo de resultado adverso si existe hipertensión pulmonar persistente más allá de los 14 días de vida.
Hipertensión pulmonar
La hipertensión pulmonar (HTP) es una afección de severidad variable que se presenta cuando, luego del nacimiento, la resistencia vascular pulmonar se mantiene anormalmente elevada y esto produce hipoflujo pulmonar, con shunt de derecha a izquierda a través del ductus arterioso permeable o del foramen oval permeable, lo que determina hipoxemia. La mayoría de los pacientes con HTP presentan un desarrollo cardiopulmonar normal, pero también se presenta en niños con enfermedades pulmonares con detención del desarrollo alveolar o vascular, como por ejemplo con malformaciones pulmonares congénitas e hipoplasia pulmonar.
En el caso de los pacientes con HDC se puede explicar en parte por la desviación del mediastino y la posición anormal del corazón y el impacto de esto sobre el desarrollo de la circulación fetal y el corazón en la etapa intrauterina (Figura 3)24.
Otras estrategias a tener en cuenta son: la reapertura del ductus arterioso con prostaglandina E1 puede proteger el ventrículo derecho de una sobrecarga excesiva debido al aumento de la poscarga, y el uso de milrinona ya que mejora la función ventricular derecha y el índice de oxigenación (Tabla 6).
El uso de otros fármacos como la vasopresina, está en aumento en el ámbito neonatal y sería otra herramienta para incluir en el manejo de hipertensión pulmonar persistente severa. La vasopresina provoca vasoconstricción en la piel, el hígado y páncreas y vasodilatación coronaria y de vasos sanguíneos pulmonares a través de la estimulación del receptor V1 en el sistema vascular celular del músculo liso. Estimulando el receptor V2 vasodilata los vasos pulmonares, coronarios y del SNC. Se debe utilizar en casos de shock refractario (dopamina-adrenalina-corticoides) o HTPP severa sin respuesta al tratamiento estándar. Dosis recomendada 0,0001-0,02 unidades/kg/min. Dosis máxima: 0,04 unidades/kg/hora. Se recomienda monitoreo estricto de la función renal y el medio interno25.
Sedación y analgesia
Sedación con fentanilo a 0,5 a 3 Y/kg/minuto controlando alteraciones hemodinámicas.
Evitar el uso de bloqueadores neuromusculares (curarización) inmediatamente después de la intubación, deteriora la compliance pulmonar y no se han demostrado efectos beneficiosos1.
Se deben valorar los distintos tipos de dolor: asociado a la patología, por procedimientos dolorosos y por situaciones de disconfort para tomar las medidas correspondientes26. Se debe utilizar una escala analgésica, en nuestro caso la escala de Confort (Tabla 7).
Las medidas universales son: disminuir los estímulos nociceptivos, cuidados ambientales y conductuales y los fármacos.
Siempre que sea posible se debe realizar premedicación para la intubación orotraqueal1.
Preoperatorio y cirugía
Una vez que el paciente cumpla con los criterios de estabilidad (Tabla 8) tiene indicación de tratamiento quirúrgico. La cirugía debe realizarse de forma electiva, siendo esta entidad una emergencia fisiológica y no quirúrgica por lo que primero se debe controlar la hipertensión pulmonar.
Se debe contar con la valoración por el equipo de anestesia.
Rutinas preoperatorias para realizar la cirugía el recién nacido: hemograma y crasis.
La profilaxis antibiótica ayuda a prevenir las infecciones del sitio quirúrgico, y su importancia radica en que estas aumentan la morbimortalidad (2 a 11 veces el riesgo de muerte)27. Se debe indicar una primera dosis entre 30 minutos y 1 hora antes de la intervención quirúrgica. La presencia de drenaje no justifica prolongar su uso, dado que no hay evidencia de mejoría de la tasa de infección, aumenta el riesgo de desarrollar resistencia bacteriana y la probabilidad de presentación de eventos adversos es mayor. Se debe elegir el antibiótico adecuado a la intervención, efectivo contra la mayoría de los patógenos probables (en este caso Staphylococcus aureus y S. epidermidis), con baja toxicidad y que alcance altas concentraciones plasmáticas y tisulares.
Se recomienda el uso de cefazolina 50 mg/kg dosis previo a la intervención y luego 20 mg/kg dosis cada 8 horas 2 dosis poscirugía (Tabla 9)27.
La cirugía está destinada al descenso del contenido herniado y reintroducción al abdomen, con el cierre del defecto diafragmático. Siempre que sea posible se intentará un cierre primario, de preferencia mediante sutura de ambos rodetes diafragmáticos o de lo contrario se podrá optar por la utilización de material protésico (malla).
Si la estabilidad del paciente lo permite, se realizará la cirugía en block quirúrgico. En caso de estar ventilado en alta frecuencia, o que el equipo médico tratante (neonatólogos, anestesistas, cirujanos) lo consideren, la cirugía se realizará en la unidad.
El abordaje podrá realizarse tanto por vía abdominal como torácica.
Un 20% de las hernias diafragmáticas pueden presentar saco herniario, en este caso se recomienda su resección para disminuir del riesgo de recidiva herniaria.
Se intentará siempre el cierre del abordaje abdominal luego de la reparación diafragmática. En caso de ser necesario se podrá realizar estiramiento o stretching de la pared para aumentar la capacidad abdominal. Se sugiere la medición de la presión intraabdominal antes y/o después del cierre abdominal, pudiendo ser necesario el cierre parietal en diferido si se presenta una presión abdominal mayor a 15 cm H2O.
La necesidad de dejar drenaje torácico queda a cargo y consideración del cirujano tratante, no está indicada su colocación de forma rutinaria.
Posoperatorio
Se mantendrán los mismos criterios ventilatorios que se manejaron en el preoperatorio. Habitualmente luego de las primeras 48-72 horas de posoperatorio se ve una mejoría clínica lo que permite el destete progresivo de la ventilación mecánica28,29.
Pueden verse secuelas en el postoperatorio vinculadas a la hipoplasia pulmonar y a la lesión pulmonar vinculada a la ventilación (barotrauma y lesión por toxicidad del oxígeno). Por otra parte también se vio que el acto quirúrgico disminuye la compliance del sistema lo que puede llevar a períodos más prolongados de ventilación mecánica28,29.
Como ya fue mencionado se mantendrá SOG abierta a bolsa colectora. Al presentar residual gástrico claro, menor de 20 ml/día y en presencia de RHA y/o deposiciones, se podrá iniciar vía enteral progresivamente.
De haberse dejado drenaje de tórax, se retirará en ausencia de gasto según el criterio del cirujano tratante.
Se recomienda iniciar terapia antirreflujo al comenzar la vía enteral y posicionamiento a 45º.
Es muy importante tener en cuenta las complicaciones que se pueden presentar en el posoperatorio24.
Suelen requerir aumento del aporte de volumen así como infusión de inotrópicos y vasopresores como tratamiento de soporte, ya que con la corrección del defecto y el retorno del contenido a la cavidad abdominal se normaliza el retorno venoso y el volumen minuto, mejorando el flujo sanguíneo tanto sistémico como pulmonar24.
Puede provocar una caída de la saturación posductal debida al shunt de derecha a izquierda que provoca mezcla de sangre no oxigenada con oxigenada24.
Si la hipoxemia generada por la hipertensión pulmonar no responde a la ventilación mecánica, está indicado el inicio de óxido nítrico por vía inhalatoria.
Algunos pacientes con hipoplasia pulmonar grave experimentan una crisis de hipertensión pulmonar de rebote en el período posoperatorio, en caso de que no respondan al ONi podrían mejorar con el agregado de sildenafil24.
La presentación de un neumotórax es una complicación frecuente por barotrauma, tanto en el preoperatorio como en el posoperatorio. En caso de que se haya dejado un drenaje pleural se deberá valorar la permeabilidad del mismo, de lo contrario puede estar indicada la colocación de un drenaje pleural. De presentarse un neumotórax hipertensivo el mismo deberá ser drenado de emergencia (tanto por equipo de neonatología como de cirugía).
Otras complicaciones posoperatorias se pueden presentar: hemorragia, quilotórax, obstrucción intestinal, reflujo gastroesofágico y hernia hiatal.
Seguimiento
El seguimiento de los pacientes con HDC debe ser a largo plazo, a cargo de equipo interdisciplinario (neonatólogo, pediatra, neumólogo, cirujano, gastroenterólogo, otorrinolaringólogo, nutricionista).
Los pacientes con HDC presentan un riesgo aumentado de enfermedad neurológica, trastornos del desarrollo, hipoacusia, enfermedad pulmonar obstructiva crónica, hipertensión pulmonar, neumonías, hiperreactividad bronquial, fallas de crecimiento, reflujo gastroesofágico (hasta un 80%), oclusión intestinal, vólvulos, recidiva de la hernia diafragmática congénita, toracopatía, entre otras. Por lo cual es indispensable un seguimiento cercano de estos pacientes.
Asesoramiento genético
El riesgo de recurrencia en una próxima gestación, si el recién nacido se presentó con una hernia diafragmática aislada es del 2% aproximadamente. Sin embargo si se presenta asociada a cromosomopatías el riesgo es mayor, por lo que es necesario asesoramiento con genetista.
Recomendaciones claves
1) Parto planificado después de una edad gestacional de 39 semanas en un centro terciario con experiencia.
2) IOT desde la sala de partos, con las presiones más bajas posibles.
3) Utilizar sedoanalgesia, evitando los bloqueadores neuromusculares.
4) Sonda orogástrica a permanencia, abierta a bolsa colectora por debajo del nivel de la cama, la cual se mantendrá en el postoperatorio. Realizar enema evacuador.
5) La ventilación mecánica convencional es la estrategia de ventilación inicial óptima.
6) Ventilacion gentil: PIM <25 cm H2O. PEEP 3-5 cm H2O.
7) Adaptar el tratamiento para alcanzar una saturación preductal de entre 80 y 95% y una saturación postductal >70%.
8) El objetivo de PaCO2 es entre 50 y 70 mmHg.
9) Considerar ONi y sildenafil en HTPP severa.
10) Realizar la cirugía electiva, después de 24 horas de estabilidad clínica mantenida.