Introducción
La sepsis bacteriana neonatal precoz es un síndrome clínico caracterizado por signos sistémicos de infección acompañado de bacteriemia, que se presenta en las primeras 72 horas de vida siendo una causa importante de morbimortalidad neonatal1,2. Estos neonatos tienen mayor riesgo de muerte y a largo plazo peores resultados en el neurodesarrollo, parálisis cerebral y alteraciones psicomotrices. Estos resultados adversos se ven acentuados en recién nacidos (RN) prematuros3-5.
Su diagnóstico y tratamiento oportuno representan un importante desafío para las unidades de terapia intensiva neonatal.
La enfermedad se puede manifestar de diversas maneras. Los signos más comunes son la disminución de la ingesta, succión pobre, letargia, irritabilidad, distermias y dificultad respiratoria6.
El aislamiento del microorganismo a partir de sangre o líquido cefalorraquídeo es considerado el estándar de oro para el diagnóstico2. Dentro de la etiología bacteriana, los patógenos más frecuentemente implicados son el Estreptococo de grupo B (EGB) y Eschericha coli. EGB continúa siendo uno de los principales causantes de sepsis, aunque su incidencia ha disminuido debido a la implementación, desde la década de 1990, del tamizaje materno mediante exudado rectovaginal y la adecuada quimioprofilaxis intraparto7.
El EGB es más frecuente en niños de peso mayor a 1.500 g y la E. coli en niños menores de 1.500 g8; sin embargo, en la última década se ha visualizado un cambio en la epidemiología con una tendencia al aumento de la sepsis causada por E. coli y una disminución de la causada por EGB7. La causa de esta situación es debida a múltiples factores, como la mayor supervivencia de prematuros severos, la resistencia antibiótica y el uso o no de quimioprofilaxis adecuada para EGB.
Otros microorganismos implicados, aunque más infrecuentes, son Listeria monocytogenes, Klebsiella pneumoniae, H. influenzae y otras enterobacterias9.
La incidencia de sepsis precoz varía dependiendo del país y su nivel de desarrollo sociocultural, sanitario y económico. En países desarrollados la incidencia es de 1-2 cada 1.000 RN vivos1,10, mientras que en países pertenecientes a África es de 39,3 cada 1.000 y en Asia 55,8 cada 1.00011.
En pretérminos, la incidencia aumenta al doble en comparación con los RN de término, y es más elevada aun en aquellos de muy bajo peso al nacer, reportándose una incidencia de 10-15 cada 1.000 RN vivos1 y una mortalidad aumentada de hasta 10 veces10.
No existen en nuestro medio datos de incidencia de sepsis neonatal precoz, como aproximación, Herrera y colaboradores describen que en el período entre los años 2007 y 2015 en el Centro Hospitalario Pereira Rossell (CHPR) la sepsis precoz por EGB tuvo una incidencia de 0,23 cada 1.000 RN vivos2.
El objetivo de este estudio es determinar la incidencia, factores de riesgo, microbiología y resultados neonatales asociados a la sepsis neonatal precoz.
Metodología
Estudio observacional, descriptivo, retrospectivo, determinando la incidencia de la sepsis precoz en neonatos nacidos en el CHPR en el período 2014-2020.
El estudio se basó en un total de 46.023 RN vivos. Se excluyeron aquellos RN ingresados desde otros centros asistenciales y óbitos con cultivos positivos como hallazgo post mortem.
Se definió caso de sepsis precoz a todo neonato con hemocultivo positivo o cultivo positivo de líquido cefalorraquídeo en las primeras 72 horas de vida. Los datos fueron aportados por el laboratorio de Bacteriología del CHPR y por el sistema informático perinatal. Éstos fueron codificados y presentados de manera anónima. Se analizaron las características de la población en base a la edad materna, rotura de membranas, quimioprofilaxis antibiótica recibida previo al parto, edad gestacional al momento del nacimiento, peso del recién nacido, microorganismo aislado, sintomatología y tipo de tratamiento antibiótico instaurado.
Se definió rotura prematura de membranas (RPM) como la rotura de las membranas previa al inicio del trabajo de parto, y rotura prematura y prolongada (RPPM) cuando superaba las 18 horas de evolución.
Durante el período de estudio se implementaron las recomendaciones del Centers for Disease Control and Prevention (CDC) del año 2002 de cribado universal a las 35-37 semanas de gestación y de quimioprofilaxis antimicrobiana intraparto para prevenir la enfermedad de adquisición vertical por EGB.
El estudio fue aprobado por el Comité de Ética del CHPR.
Análisis estadístico
La tasa de incidencia se determinó cada 1.000 nacimientos vivos de forma global y por categoría de edad gestacional.
La microbiología se determinó mediante las proporciones de aislados en general y según grampositivos o gramnegativos.
Se analizaron las características demográficas y clínicas mediante el uso de estadísticas descriptivas estándar como media, mediana, odds ratio, test de chi cuadrado o de Fisher, según correspondiese. El programa estadístico utilizado fue GraphPad Prism 8.4.
Resultados
Características neonatales
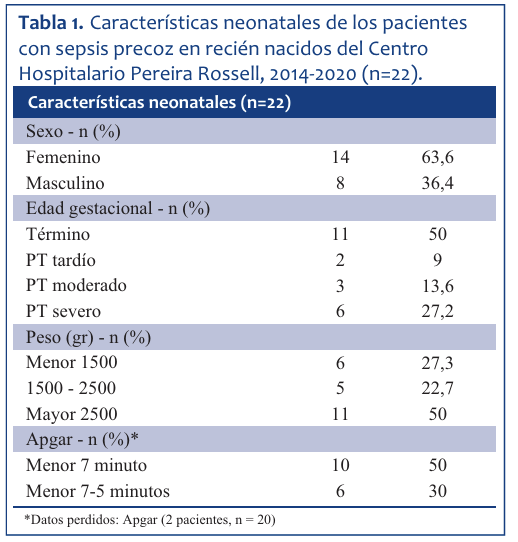
De los 22 recién nacidos, 11 fueron mayores de 37 semanas y 11 pretérminos (Tabla 1). De estos últimos, el 55% fueron pretérminos severos (menores de 32 semanas), 27% pretérminos moderados (entre 32 y 34 semanas) y 18% pretérminos tardíos (35 a 37 semanas). La media de peso fue de 2.411 g. Once tuvieron bajo peso al nacer (menor a 2.500 g). Seis de 20 (30%) pacientes tuvieron puntajes de Apgar bajo (menor a 7 puntos) a los 5 minutos de vida. En la (Tabla 1) se detallan estos datos.
Tabla 1 Características neonatales de los pacientes con sepsis precoz en recién nacidos del Centro Hospitalario Pereira Rossell, 2014-2020 (n=22).
Características maternas
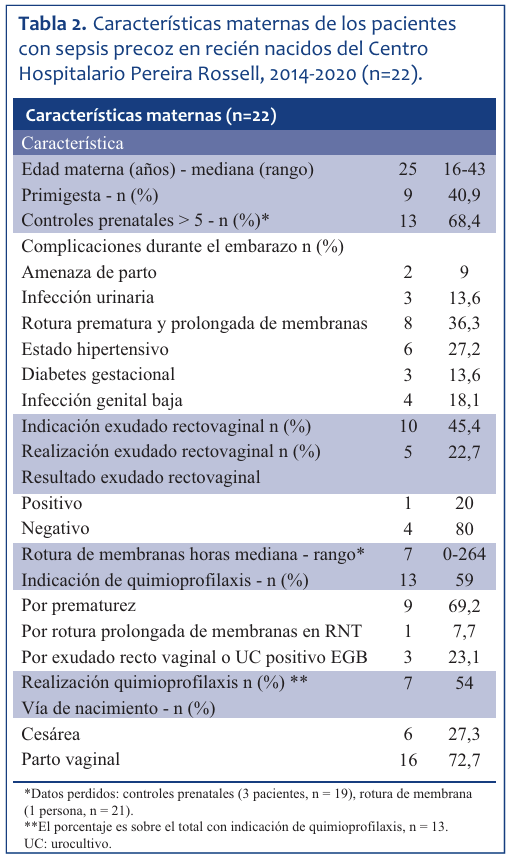
La mediana para la edad fue de 25 años. El 41% de las embarazadas cursó su primera gestación. Trece (68,4%) controlaron correctamente el embarazo. La RPPM fue la complicación más frecuente (36,3%), seguida por el estado hipertensivo del embarazo (27,2%). En menor frecuencia se registró infección urinaria (13,6%), diabetes gestacional (13,6%) y amenaza de parto prematuro (9%).
Con respecto a la muestra rectovaginal para la búsqueda de EGB, de diez madres que tenían indicación de realizarse dicho estudio, la mitad se lo realizó, siendo solo un caso de éstos positivo. El 59% de las embarazadas tenía indicación de recibir quimioprofilaxis para EGB previo al nacimiento. El 54% la recibió de forma oportuna y correcta. El principal motivo de la indicación de quimioprofilaxis fue el parto inminente de un RN prematuro (69%), seguido de un resultado positivo para EGB obtenido de exudado rectovaginal o urocultivo.
El parto vaginal fue la vía más frecuente (72,7%), mientras que la cesárea se realizó en el 27,3% restante, lo que corresponde a seis embarazadas.
Las características maternas analizadas se encuentran representadas en la (Tabla 2).
Tabla 2 Características maternas de los pacientes con sepsis precoz en recién nacidos del Centro Hospitalario Pereira Rossell, 2014-2020 (n=22).
Morbilidad neonatal
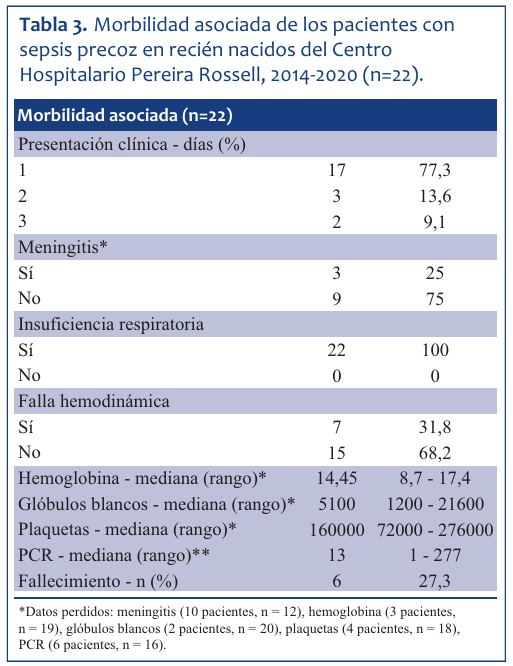
El inicio de síntomas fue precoz (primeras 12 horas) en 17 niños (77,3%): 3 (13,6%) iniciaron síntomas entre las 24 y 48 horas, y 2 (9%) lo hicieron luego de las 48 y antes de las 72 horas. La sintomatología respiratoria en forma de insuficiencia ventilo respiratoria estuvo presente en todos los RN. Quince de 22 niños (68%) requirieron asistencia ventilatoria mecánica, y siete requirieron ventilación no invasiva con CPAP. Se constataron tres casos de meningitis. Esto corresponde a 25% del total de sepsis.
Entre las complicaciones en la evolución se destacan: falla hemodinámica (31,8%), apneas (27,2%), inestabilidad térmica (18%), intolerancia digestiva (13,6%) y convulsiones (4,5%). Datos observados en la (Tabla 3).
Tabla 3 Morbilidad asociada de los pacientes con sepsis precoz en recién nacidos del Centro Hospitalario Pereira Rossell, 2014-2020 (n=22).
Patógenos
Se identificaron 12 microorganismos gramnegativos y 10 grampositivos. Estos fueron: 6 Estreptococo de grupo B, 5 Haemophilus influenzae, 4 Escherichia coli, 2 Listeria monocytogenes, 2 Streptococus pneumoniae, 1 Klebsiella oxytoca, 1 Klebsiella pneumoniae, 1 Enterobacter cloacae.
En las infecciones por microorganismos gramnegativos solo 1 de los 6 aislamientos se dio en RN término, mientras que los otros cinco aislamientos se dieron en pretérminos.
Cinco de los 11 aislamientos en los pacientes pretérminos menores de 37 semanas fueron bacterias de probable origen entérico, mientras que las ocurridas en RN término fue un aislamiento de los 11, (p 0,055) (Figura 1).
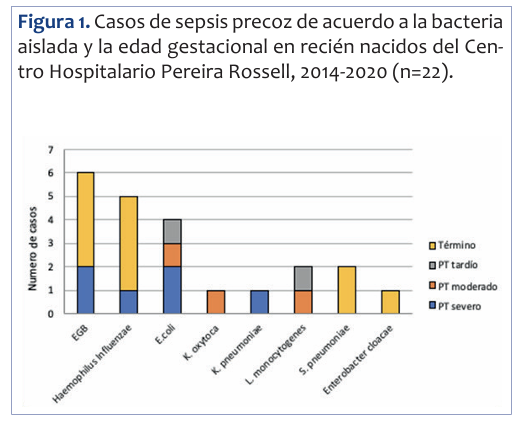
Figura 1 Casos de sepsis precoz de acuerdo a la bacteria aislada y la edad gestacional en recién nacidos del Centro Hospitalario Pereira Rossell, 2014-2020 (n=22).
Incidencia
Se identificaron 22 casos de sepsis precoces. La incidencia global en el período de estudio fue de 0,47 cada 1.000 RN vivos. La (Figura 2) muestra la variación de la incidencia anual de sepsis precoz en nuestro centro hospitalario.
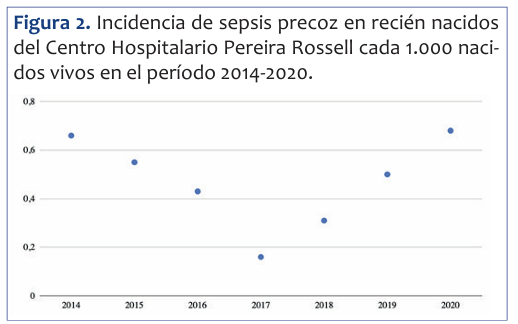
Figura 2 Incidencia de sepsis precoz en recién nacidos del Centro Hospitalario Pereira Rossell cada 1.000 naci dos vivos en el período 2014-2020.
La incidencia de la sepsis precoz aumenta a medida que disminuye la edad gestacional. En neonatos mayores de 37 semanas la incidencia fue de 0,05 cada 1.000; entre 35 y 37 semanas 1,1 cada 1.000; de 32 a 34 semanas 8,2 cada 1.000, y en menores de 32 la incidencia fue de 11,7 cada 1.000 nacidos vivos. La (Figura 3) muestra esta variación.
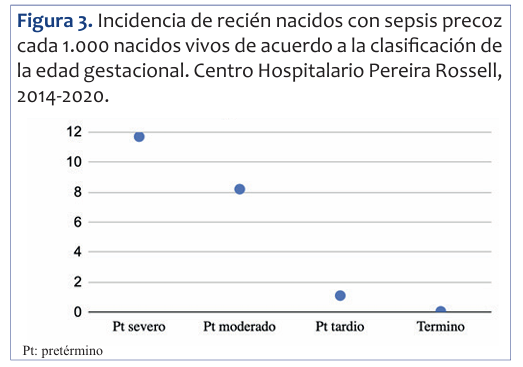
Figura 3 Incidencia de recién nacidos con sepsis precoz cada 1.000 nacidos vivos de acuerdo a la clasificación de la edad gestacional. Centro Hospitalario Pereira Rossell, 2014-2020.
Mortalidad
Del total de pacientes que cursaron la infección, 6/22 fallecieron. Tres fueron RN de término, mientras que el resto fueron pretérminos severos.
Tratamiento
El plan antibiótico empírico inicial fue la asociación de ampicilina con gentamicina en 10 pacientes. La ampicilina sola o asociada a otro antibiótico se utilizó en 16 y la gentamicina sola o asociada a otro antibiótico en 12 pacientes. El inicio de la terapia se realizó en la mayoría de los RN el primer día de vida (20 pacientes).
Sensibilidad antibiótica
Las diez bacterias grampositivas fueron sensibles a ampicilina.
De las doce bacterias gramnegativas, los cinco aislamientos de Haemophilus influenzae fueron betalactamasa negativa, las siete enterobacterias fueron resistentes a ampicilina (Klebsiella spp. y Enterobacter cloacae por resistencia natural), en E. coli por betalactamasa de espectro ampliado (BLEA), o betalactamasa de espectro expandido (BLEE). El aislamiento de E. coli que portaba BLEE fue también resistente a la gentamicina.
Factores de riesgo
En el análisis multivariado se identificaron: menor de 32 semanas OR 10,14 (IC 95% 3,95-25,8) p < 0,0001, mal control de embarazo (menos de cinco controles) OR 2,57 (IC 95% 1,01-6,59) p = 0,0470, RPPM OR 24,6 (IC 95% 9,28 - 54,33) p < 0,0001.
Para bacterias entéricas, comparando el grupo de neonatos mayores y menores de 37 semanas de edad gestacional, presentó un OR 12,2 (IC 95% 1,12 - 128,8) p = 0,0402.
Discusión
La incidencia de la sepsis precoz en este estudio fue similar e incluso más baja que en países desarrollados. La incidencia aumenta a medida que disminuye la edad gestacional de manera significativa (prematuros 21 vs 0,05/1.000 nacidos vivos en RN de término). Esta cifra es similar a la documentada a nivel internacional en estudios de redes nacionales, como en Estados Unidos, donde la incidencia en prematuros fue de 10-20/1.000 nacidos vivos10.
El perfil microbiológico encontrado coincide con la literatura internacional. El microorganismo aislado con mayor frecuencia fue EGB en 27,2% (seis pacientes). A pesar de que la quimioprofilaxis periparto puede disminuir la probabilidad de presentar una sepsis neonatal precoz para este microorganismo, continúa siendo el más importante y frecuente en la sepsis precoz. Parecería ser este un punto donde trabajar para disminuir estos casos cumpliendo de forma sistemática las guías utilizadas al respecto.
En pacientes de término predominaron EGB y Haemophilus influenzae (cuatro casos ambos), mientras que en prematuros E. coli fue el agente más frecuentemente aislado en este rango etario; incidencia 7,15/1.000 nacidos vivos, 36,3% (cuatro casos en 11 pacientes). Incluso no se reportó ningún caso de E. coli en RN de término.
Hay un aumento de la incidencia de la sepsis precoz causada por E. coli, el doble si se compara el año 2014 con el 2020. Este microorganismo afecta principalmente a prematuros, y se especula que este aumento se vincula, entre otras causas, a la presencia de RPPM, corioamnionitis y a la mayor sobrevida que existe actualmente en comparación con años pasados12. Existe también un aumento de la resistencia antibiótica a la ampicilina o a la gentamicina, antibióticos universalmente elegidos empíricamente para el tratamiento de la sepsis precoz. La resistencia antibiótica conlleva un incremento en la incidencia de sepsis causada por microorganismos en los cuales estos antibióticos no generan el efecto bactericida o bacteriostático deseado. En un estudio realizado en Estados Unidos se constató un aumento de 3% a 11% en la resistencia a gentamicina y una mayor frecuencia de resistencia a ampicilina en niños prematuros (83,1% vs 37,5% término; p < .001)13. Sin embargo, el efecto sinérgico de ambos antibióticos mostró en estos casos su eficacia en los tratamientos de estos RN a excepción de un caso.
La quimioprofilaxis intraparto disminuye la incidencia de sepsis precoz de tres maneras diferentes: disminuye la colonización vaginal materna por EGB, previene la colonización bacteriana en la mucosa fetal y alcanza en el RN niveles de antibiótico en sangre por encima de la concentración inhibitoria mínima del EGB14.
La misma está indicada principalmente en mujeres portadoras de EGB y en aquellas cursando trabajo de parto pretérmino. Este último motivo fue la principal indicación de quimioprofilaxis en nuestra población, pero existieron oportunidades perdidas en cuanto a cribado prenatal de EGB.
Las oportunidades perdidas se deben a una falla en la adherencia al control del embarazo por parte de las embarazadas en estudio y a una falla del equipo de salud en la captación y seguimiento de éstas. De las 13 mujeres que tenían indicación de quimioprofilaxis según la guía de CDC15, 6 no la recibieron o esta fue incompleta. Esta omisión tiene dos causales primarias: consulta tardía, usualmente en etapas avanzadas del trabajo de parto, generando al momento del parto un tratamiento antibiótico incompleto, y el parto fuera del centro hospitalario, en un lugar falto de recursos para realizar la antibioticoterapia prenatal.
Sin embargo, estas cifras mejoraron respecto a las cifras publicadas previamente2, donde el 20% de las mujeres se realizó el exudado (en esta cohorte 50% se lo realizó) y ninguna de las que tenía indicación de quimioprofilaxis la recibió (en esta cohorte 54% sí la recibió cuando estaba indicada).El principal factor de riesgo identificado para sepsis precoz estadísticamente significativo fue la prematurez severa. La incidencia en este grupo etario fue de 11,7 cada 1.000 nacidos vivos. La incidencia aumenta de manera inversamente proporcional a la edad gestacional (Figura 3).
Con respecto al tipo de microorganismo, se encontró una relación directa entre bacterias entéricas y prematurez. Los RN que cursaron sepsis causada por bacterias gramnegativas fueron prematuros menores de 34 semanas a excepción de un caso. Este se refiere a un niño con inmunodeficiencia.
La RPPM se identificó como factor de riesgo de sepsis. Sin embargo, en el análisis estadístico existe un sesgo al comparar con los pacientes prematuros que no tuvieron sepsis, ya que en muchos de ellos se interrumpió la gestación por una causa obstétrica, como la restricción del crecimiento intrauterino (RCIU), estados hipertensivos del embarazo, etc. La rotura artificial de membranas con bajo riesgo de infección podría explicar en parte el elevado OR obtenido.
Similarmente al estudio previo sobre sepsis neonatal precoz realizado en nuestro hospital, ninguna de las madres presentó fiebre intraparto2. El riesgo de sepsis neonatal en RN de madres con fiebre intraparto o con diagnóstico de corioamnionitis clínica es bajo, aproximadamente 0,24 %16. A su vez, la fiebre materna aislada puede ser secundaria no solo a infección, sino a anestesia epidural, deshidratación, exceso de calor ambiental u otras causas no infecciosas17. Por lo tanto, ni la presencia de fiebre materna predice con certeza el riesgo de sepsis neonatal, ni su ausencia sirve para descartar el diagnóstico.
No se encontraron diferencias estadísticamente significativas en lo que respecta a edad materna y cesárea versus parto.
La mayoría de los RN infectados fueron del sexo femenino (14 vs 8). No es significativo este dato, ya que se interpreta como un sesgo dado el bajo número muestral (n=22).
El inicio de síntomas fue precoz en el 77,3% de los casos. Al igual que lo reportado, los neonatos se presentan con clínica precoz, siendo la dificultad respiratoria la regla.
En solo dos casos los síntomas comenzaron luego de las 48 y antes de las 72 horas. A destacar de estos últimos, ambos eran inmunodeprimidos, uno con síndrome de Joubert asociado a un hipopituitarismo congénito y, en el otro caso, una insuficiencia suprarrenal.
La sintomatología respiratoria en forma de insuficiencia ventilo-respiratoria primó en todos los RN; 15/22 niños requirieron asistencia ventilatoria mecánica y el resto requirió algún tipo de apoyo respiratorio.
Se constataron tres casos de meningitis en 12 neonatos a los cuales se les realizó punción lumbar (25%), dato esperado si comparamos la incidencia global de meningitis en sepsis precoces18,19. En los restantes pacientes la punción lumbar fue pospuesta y no se realizó por inestabilidad clínica hemodinámica del paciente (Listeria monocytogenes, Streptococcus pneumoniae, Haemophilus influenzae). La incidencia de meningitis en sepsis precoz en nuestro centro está sesgada debido a que diez neonatos no lograron ser estudiados.
Se registró una mortalidad de 0,13 cada 1.000 RN vivos. La mitad de los fallecimientos corresponden a prematuros severos. Si bien la sepsis en estos niños fue un factor influyente en la causa de muerte, no se pueden descartar otras causas propias de la prematurez extrema debidas a inmadurez respiratoria, cardíaca e intestinal.
El 50% de los niños fallecidos eran de término. En dos de ellos se aisló EGB, lo que demuestra la gran capacidad invasora y potencialmente letal de esta bacteria.
En el caso restante, que aisló una enterobacteria no habitual en la sepsis precoz a las 72 horas de vida productora de betalactamasas de espectro extendido, se trató de un niño con inmunodeficiencia (síndrome de Joubert). Si bien cumple con los criterios de ingreso al estudio, tanto la patología de base del neonato como el microorganismo aislado son más habituales en la sepsis tardía y su descripción debe ser tomada con cautela en las conclusiones del estudio.
En dos casos de sepsis el microorganismo causante fue Streptococcus pneumoniae, serotipos 3 y 8, serotipo vacunal y no vacunal respectivamente.
En nuestro país, la vacuna antineumocócica conjugada 7 valente (VCN7) fue introducida en 2008, siendo sustituida en 2010 por la vacuna antineumocócica conjugada 13 valente (VCN13). Esta segunda vacuna contiene, además de los antígenos capsulares de VCN7 (4, 6B, 9V, 14, 18C, 19F, 23F), seis serotipos adicionales (1, 3, 5, 6A, 7F y 19A). Dicha vacuna se administra a los 2, 4 y 12 meses de edad. La administración universal disminuyó los casos de enfermedad invasiva en neonatos debido a este patógeno, como ya reportamos previamente, siendo hasta ese momento todos los serotipos involucrados no vacunales20.
A diferencia de la mayoría de los serotipos contenidos en la VCN13, la enfermedad neumocócica del serotipo 3 no ha disminuido sustancialmente a nivel de la población general después de la introducción de la VCN13 en los programas de inmunización pediátrica de rutina en todo el mundo21. VCN13 es menos inmunogénica para el serotipo 3 en comparación con otros serotipos vacunales22.
La madre del RN no estaba inmunizada por su edad; sin embargo, este hallazgo alerta sobre la inmunidad de rebaño asociada a esta vacuna. Como resultado existe cierto debate sobre la efectividad de VCN13 contra la enfermedad del serotipo 323,24.
En los RN de término los agentes más frecuentemente recuperados fueron bacterias grampositivas y H. influenzae con una adecuada cobertura por el tratamiento antibiótico empírico dado que todas fueron sensibles a ampicilina.
Sin embargo, en los pretérminos en los que predominan las enterobacterias resistentes a la ampicilina, la cobertura antibiótica empírica estuvo dada por la gentamicina asociada a la ampicilina con buena respuesta al tratamiento, ya que no encontramos bacteriemias persistentes en este grupo de neonatos. Al momento esta asociación demostró ser efectiva y ajustada para el tratamiento empírico de la enfermedad. Es importante la vigilancia bacteriológica para futuros ajustes de esta terapéutica de ser necesario.
La rápida obtención y comunicación del resultado de identificación bacteriana por el uso de herramientas de biología molecular permite adecuar rápidamente los planes antibióticos empíricos.
Esta comunicación describe la forma de presentación, perfiles de sensibilidad bacteriana y evolución de la sepsis precoz en la maternidad más grande del país. Este estudio está limitado por la forma retrospectiva de la obtención de los datos y el escaso número de casos.
Conclusiones
Este estudio es el primer reporte sobre la incidencia y morbimortalidad de sepsis neonatal precoz en Uruguay, siendo la incidencia similar a la de países desarrollados. La mortalidad es baja, afectando principalmente a prematuros severos. En los RN de término los microorganismos más frecuentemente recuperados fueron Streptococcus agalactiae y Haemophilus influenzae, y en prematuros severos predominó Escherichia coli y otras enterobacterias. La asociación ampicilina más gentamicina continúa siendo una opción terapéutica correcta. Aún siguen existiendo las oportunidades perdidas en la prevención de la transmisión materno-fetal del EGB.















