Introducción
La tasa de mortalidad infantil (TMI) ha experimentado un descenso paulatino en las últimas décadas. Entre 1990 y 2009 se redujo en 53% (de 20,4 a 9,56 cada 1.000 nacidos vivos). Las causas de esta reducción fueron la aplicación de los antibióticos, el auge de la cooperación internacional en materia de salud y las acciones preventivas (vacunación, terapia de rehidratación oral, servicios prenatales, atención del parto, expansión de servicios básicos, incremento de la escolaridad), haciendo hincapié en los hogares más vulnerables1,2. En el año 2019 fue de 6,8, manteniendo la tendencia global descendiente y en el año 2021 se registró la TMI más baja de 6,2, probablemente vinculado a la reducción de las infecciones respiratorias en la edad pediátrica durante los meses de la pandemia COVID-193. Estas políticas de salud han situado a las enfermedades genéticas entre las primeras causas de morbilidad y mortalidad infantil no prevenibles4. Las malformaciones congénitas, que pueden tener un origen genético o no, son defectos estructurales presentes al nacimiento. Representan la segunda causa de muerte en niños menores de 5 años, afectando a uno de cada 33 recién nacidos y causando 3,2 millones de discapacidades al año2-5.
Si bien la mayoría de las enfermedades son el resultado de una acción combinada de los genes y el ambiente, nos referimos a enfermedad genética cuando los factores genéticos son el determinante único o principal en su patogénesis. Se reconocen tres tipos principales: anomalías cromosómicas (microscópicas o submicroscópicas), enfermedades monogénicas y enfermedades multifactoriales6, si bien hoy se conocen una gran variedad de otros mecanismos que agregan complejidad a la etiopatogenia. Aunque individualmente son poco frecuentes, en conjunto afectan a una proporción importante de la población general y son, por lo tanto, un problema de salud pública.
En el área de la genética humana se ha producido una revolución diagnóstica con la secuenciación masiva del genoma humano y otras técnicas de análisis genómico. Esto ha permitido disponer de herramientas que permiten caracterizar la relación entre la variación del ácido desoxirribonucleico (ADN) y la predisposición a enfermedades, proporcionando información vinculada a la patogénesis, estrategias para la prevención y el tratamiento7,8.
El impacto de las enfermedades genéticas en la morbilidad infantil es muy significativo9. La mayoría de los trastornos crónicos pediátricos que requieren ingreso hospitalario son de causa genética o tienen una susceptibilidad genética significativa. Los costos de internación, así como la duración, son mayores en esta población10-12.
A nivel de las UCIP se ha producido un cambio en el perfil fenotípico de los niños ingresados, con un aumento de pacientes portadores de enfermedades genéticas13. Estas enfermedades también impactan en la mortalidad de los niños hospitalizados, estando presentes en el 34% de los fallecimientos7. Como indicador no sistematizado, en la unidad de cuidado intensivo pediátrico (CIP) de la Asociación Española fallecieron seis pacientes en el año 2019, cinco de los cuales eran portadores de una patología genética, la cual estuvo directamente involucrada en la causa del deceso.
Atendiendo a la importancia de la patología genética en pediatría y teniendo en cuenta que no hay hasta el momento publicaciones en nuestro medio que evalúen específicamente la prevalencia de éstas en una UCIP, es que decidimos evaluar la prevalencia de patología genética confirmada o sospechada en pacientes egresados de una UCIP y describir si la presencia de patología genética repercute en los días de internación, la realización de maniobras invasivas y en la mortalidad. En los casos en los que se produjeron defunciones, evaluar si se realizó autopsia clínica.
Metodología
Se realizó un estudio prospectivo, descriptivo y transversal desde el 1º de enero de 2020 al 31 de diciembre de 2021 en la UCIP de la Asociación Española, una institución de asistencia médica colectiva de tercer nivel de la ciudad de Montevideo, Uruguay. Esta unidad cuenta con diez camas y recibe pacientes desde el mes de vida a los 14 años. En promedio ingresan unos 400 pacientes por año.
Población de estudio: se consideraron todos los pacientes egresados de la UCIP con diagnóstico de patología genética confirmada o sospechada. Se definió enfermedad genética confirmada ante la presencia de criterios clínicos que confirmen el diagnóstico (cuando esto es posible) y/o un fenotipo compatible con un estudio genético confirmatorio, y enfermedad genética sospechada ante la sospecha clínica en base a fallo del crecimiento, retraso del desarrollo/discapacidad intelectual, dismorfias/malformaciones congénitas, elementos característicos de ciertos síndromes genéticos y antecedentes familiares de enfermedad genética.
Las enfermedades genéticas analizadas se clasificaron en anomalías cromosómicas: numéricas o estructurales -balanceadas o desbalanceadas-, definidas a nivel citogenético o por técnicas moleculares (microdeleciones y microduplicaciones); enfermedades monogénicas; mitocondriales; asociadas a impronta genómica; por expansión de tripletes. Se excluyen las enfermedades de probable herencia multifactorial.
Las variables analizadas fueron: edad, sexo, tipo de enfermedad genética, realización de estudios genéticos, días de internación, realización de maniobras invasivas, fallecimiento, realización de necropsia.
Se definió como maniobra invasiva a los procedimientos que aumentan el riesgo de daño al paciente: intubación endotraqueal, asistencia ventilatoria mecánica, vía venosa central, vía venosa percutánea, vía venosa profunda, punción lumbar, traqueostomía, fibrobroncoscopía, gastrostomía, derivación ventricular externa.
Para la recolección de dichas variables se elaboró una tabla en Excel a la que se volcaron los datos. Las variables cuantitativas se expresaron con medidas de tendencia central (media, mediana) y medidas de dispersión (rango). Las variables cualitativas se expresaron en frecuencia absoluta y relativa. La media de la estadía hospitalaria y la frecuencia de la mortalidad en los pacientes con patología genética se compararon con las correspondientes a la población total que ingresó al CIP en el mismo período del estudio. Estos datos fueron proporcionados por el departamento de estadística de la institución. La comparación se realizó utilizando el test de chi cuadrado y la prueba de T student para muestra única, con un nivel de significancia de 5%. El análisis estadístico se realizó con el programa SPSS.
Se solicitó el consentimiento informado a los padres o tutores para la inclusión en el estudio una vez ingresados al pool de pacientes con patología genética sospechada o confirmada, respetándose en todo momento la identidad del paciente. El protocolo fue aprobado por el Comité de Ética institucional.
Resultados
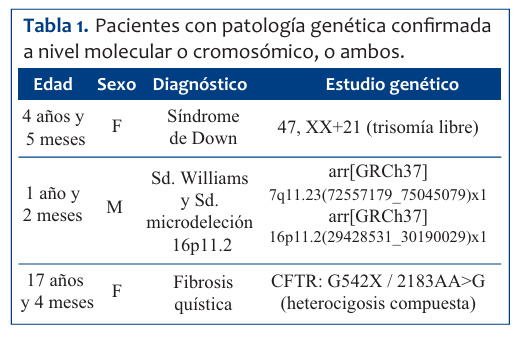
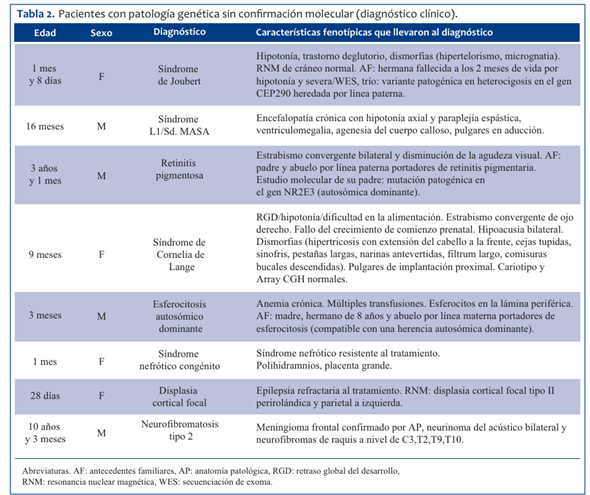
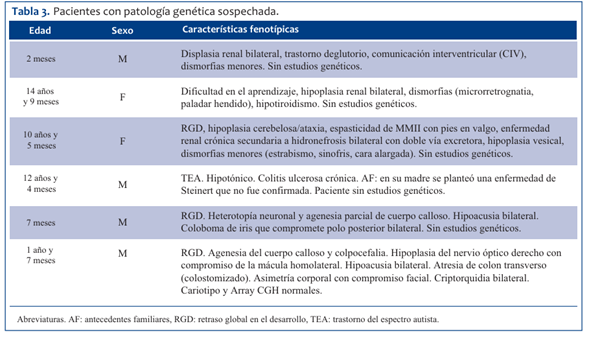
La prevalencia de patología genética confirmada o sospechada en pacientes egresados del CIP fue de 17/244. La mediana de edad para los pacientes con enfermedad genética fue de 16 meses; 9/17 eran de sexo masculino. Las enfermedades genéticas más frecuentes fueron las monogénicas (9/17), seguidas de enfermedad genética sospechada sin orientación etiológica (6/17) y luego anomalías cromosómicas (2/17). Tenían confirmación molecular o citogenética tres de los 17 pacientes. En la (Tabla 1) se muestran los pacientes con patología genética confirmada a nivel molecular o cromosómico, en la (Tabla 2) los pacientes sin confirmación molecular y en la (Tabla 3) los pacientes con patología genética sospechada. Los días de internación promedio para este grupo fue de 12,5 días con un intervalo de confianza de 95% (1,31-23,7). Se destaca que una de las pacientes, portadora de síndrome nefrótico congénito, tuvo una internación prolongada de tres meses. El promedio de días de internación del total de pacientes fue de 3,5 días (p 0,107). De los pacientes con patología genética, 12/17 fueron sometidos a alguna maniobra invasiva durante la internación. Fallecieron cinco pacientes del total de pacientes ingresados durante el período de estudio (5/244), de los cuales dos presentaban patología genética (2/17): uno era portador de fibrosis quística y el restante de síndrome nefrótico congénito. Los otros tres fallecidos (3/227) fueron por: ahogamiento, encefalitis autoinmune y probable tumor hepático maligno. Se encontró una diferencia estadísticamente significativa entre la frecuencia de mortalidad entre los pacientes con patología genética versus los que no la poseen (p 0,0034). No se realizó autopsia a ninguno de los pacientes fallecidos.
Discusión
Las enfermedades genéticas pueden presentarse a cualquier edad, pero las más evidentes y graves generalmente comienzan en la infancia7, lo que impone a los pediatras a adquirir conocimientos sobre aquéllas. Son, a su vez, una causa importante de internación, determinando una tercera parte de las admisiones hospitalarias pediátricas4. A nivel regional, en Argentina, en el Hospital Pediátrico Juan P. Garrahan, se realizó un estudio retrospectivo en el que se revisaron 2.300 historias clínicas en cinco salas de internación y se constató una mayor prevalencia de enfermedades total o parcialmente genéticas, así como mayores días de internación, porcentaje de reinternaciones y defunciones en este grupo9. En Uruguay, un estudio realizado en el Centro Hospitalario Pereira Rossell concluyó que 5,1% de los pacientes que ingresaron a cuidados moderados presentaron un defecto congénito. Estos pacientes tuvieron mayores tasas de reingresos, más días de internación y un mayor porcentaje de ingreso a UCIP14.
A nivel de las UCIP, el nuevo perfil fenotípico de los pacientes que ingresan, con aumento de pacientes portadores de enfermedades crónicas entre las que se incluyen las genéticas, podría estar vinculado a su mayor detección debido a la incorporación de nuevas tecnologías genómicas en la práctica clínica, así como al aumento de la sobrevida de estos pacientes asociado a terapias génicas en auge, mejoras en la calidad de vida de la población, a los avances de la medicina y al soporte de funciones vitales en domicilio, entre otras15-26.
Nuestro estudio evidenció que la prevalencia de patología genética confirmada o sospechada en pacientes egresados del CIP fue 17/244. Se destaca que el estudio transcurre durante los meses de la pandemia COVID-19, período en el que las UCI pediátricas presentaron una franca caída de los ingresos, vinculada a las medidas de confinamiento, protección e higiene, así como el cierre de centros educativos. En Uruguay no existen, hasta nuestro conocimiento, estudios que evalúen la prevalencia de patología genética en una UCIP. A nivel internacional existen múltiples trabajos que evalúan la patología genética y malformaciones congénitas en UCI neonatales (UCIN), pero no pediátricas. Como estudio anecdótico, se destaca un trabajo realizado por Fitz Patrick en Escocia durante los años 1987-1988, en el que se encontró una prevalencia de 5,7% (47/821) de enfermedades cromosómicas o monogénicas en el total de pacientes ingresados a UCIP. Estos pacientes tuvieron más reingresos, estancias medias más largas y una tasa de mortalidad más alta que el resto de los pacientes15. Es de destacar que fue realizado durante un período en el que no se contaba con técnicas de secuenciación masiva ni otras tecnologías de análisis sobre el genoma como de las que disponemos hoy.
El aumento creciente en el diagnóstico de enfermedades genéticas, así como de pacientes internados con dicha patología, requiere cambios significativos en el proceso de la educación médica y en las políticas de salud pública9. La prestación de servicios genéticos debería estar integrada en todos los niveles de la atención sanitaria, siendo fundamental la capacitación del equipo de salud en el conocimiento de dichas enfermedades16. Se estima que existen unas 7.000 enfermedades raras, las que individualmente son poco frecuentes, pero que en conjunto afectan al 7% de la población. Como cada una de estas enfermedades por separado es muy infrecuente, un médico general o pediatra no estarán familiarizados con éstas. Por lo tanto, como actores de la salud, debemos detectar los signos de alarma que permitan sospecharlas, realizar una derivación oportuna a genetista, así como contar con disponibilidad de la especialidad. Establecer un diagnóstico es fundamental para el paciente y su familia. Más allá de la reducción en la ansiedad que supone contar con un diagnóstico, este puede tener implicancias directas en la atención del paciente y el asesoramiento familiar17,18; 6/17 pacientes incluidos en el estudio presentaban sospecha de patología genética, sin orientación etiológica específica al momento de la internación en UCIP. Esto refiere a lo que se ha denominado “odisea diagnóstica” de las enfermedades genéticas, que sostiene que el promedio en el diagnóstico de éstas es de aproximadamente 4,4 años19. Esto puede ser debido a múltiples factores: el gran número de enfermedades, su baja frecuencia, la presentación con signos inespecíficos y la existencia de formas atípicas (cada vez más se habla de un “espectro” de presentaciones). Por otro lado, la falta de recursos, tanto humanos como financieros, contribuye a la falta de diagnóstico.
En el estudio se evidenció una duración de la internación mayor en pacientes con patología genética (12,5 días) respecto al promedio de días del total de pacientes (3,5 días). Muchos pacientes con afecciones genéticas agregan comorbilidades y mayor requerimiento de cuidados especiales, por lo que son ingresados en las UCIP para monitorización y tratamientos que superan los recursos asistenciales de las salas de internación pediátrica. Esto genera un aumento de la demanda de camas de UCIP, dificultando la optimización de sus recursos. Al respecto, en el Hospital Infantil La Paz (España) se creó una unidad de niños con patología crónica compleja. La creación de estas unidades de cuidados moderados facilita su ingreso a sala, con la consecuente reducción del gasto sanitario y aumento de disponibilidad de camas en UCIP para otros pacientes críticos20.
Como se objetiva en los resultados, más de la mitad de los pacientes con enfermedad genética fueron sometidos a alguna maniobra invasiva durante su estadía en la UCIP. Impresiona una frecuencia mayor respecto a pacientes sin patología genética, si bien sería necesario confirmar esta hipótesis mediante un estudio analítico que compare ambas poblaciones.
Teniendo en cuenta la alta contribución de las enfermedades genéticas a la morbimortalidad infantil, se ha acelerado el estudio y la integración de técnicas de análisis masivo sobre el genoma en las UCIP. En varios estudios en los que se analiza el exoma completo, genoma completo y/o ADN mitocondrial en pacientes internados en UCIP con sospecha de enfermedad genética, se logró realizar un diagnóstico genético en 36%-45% de los casos. Esto determinó cambios en el tratamiento instituido21,22. En nuestro medio se han desarrollado programas piloto pequeños centrados en el uso de secuenciación masiva en el diagnóstico de enfermedades raras de causa genética. No se han desarrollado, hasta donde sabemos, programas sistemáticos en UCIP, pero sí hay casos aislados donde el diagnóstico molecular específico cambió el pronóstico y las decisiones terapéuticas. Es de prever que en el futuro se desarrollen programas más amplios en este sentido en virtud de la disminución de los costos de estas técnicas y la generación de recursos humanos locales especializados en su uso.
Durante el período de estudio, fallecieron cinco pacientes del total de pacientes ingresados (5/244). Dos de estos cinco pacientes eran portadores de patología genética (fibrosis quística y síndrome nefrótico congénito), lo que representa una frecuencia de mortalidad significativamente mayor en este grupo respecto a los pacientes sin patología genética. No se realizó autopsia a ninguno de los pacientes fallecidos debido a las dificultades en el acceso a ésta, ya que dicha prestación no se encuentra disponible a nivel mutual. Conocer las causas de muerte y las características de los niños que fallecen en el hospital resulta necesario para mejorar la calidad de la atención y contribuir a prevenir las muertes evitables23. La autopsia proporciona información valiosa para afinar diagnósticos, proporciona explicaciones fisiopatológicas de los procesos que han conducido a la muerte, brindando datos objetivos que pudieron pasar inadvertidos. Es considerada un indicador de calidad asistencial y un excelente instrumento docente24,25. La recuperación de las tasas de autopsia es fundamental25.
En todos los casos de fallecimiento se respetaron las medidas del “buen morir”, tratando en forma enérgica el dolor, permitiendo a la familia acompañar a su ser querido en todo momento, tomarlo en brazos y despedirse. Es fundamental en las UCIP estar familiarizados con el cuidado de calidad en niños que padecen enfermedades que amenazan sus vidas y generan una gran limitación funcional. La adecuación del esfuerzo terapéutico, evitando medidas fútiles que prolongan la vida biológica sin proporcionar recuperación, pero que también incluye los cuidados que aseguran el alivio y el confort del paciente son fundamentales26.
Una de las limitaciones de este trabajo fue que se realizó durante la pandemia COVID-19, momento en el que los ingresos a las UCIP disminuyeron drásticamente, determinando una menor población de estudio. Sin embargo, a pesar de esto, fue posible describir la prevalencia de pacientes con patología genética en una UCIP, los días de internación y la mortalidad. Si bien los días de internación de los pacientes con patología genética fue mayor, este valor no es estadísticamente significativo, lo que podría estar relacionado al tamaño de la muestra, que es pequeña, a lo que se añade que una paciente presentó una internación muy prolongada. Es necesario un nuevo estudio para evaluar la hipótesis de que estos pacientes son sometidos más frecuentemente a maniobras invasivas durante su estadía que el resto de la población.
Conclusiones
La prevalencia de enfermedad genética sospechada o confirmada en pacientes egresados del CIP fue 17/244. Las enfermedades monogénicas fueron las más frecuentes, seguidas de enfermedad genética sospechada sin orientación etiológica y luego anomalías cromosómicas. Estos pacientes tuvieron estadías más prolongadas y una mayor frecuencia de mortalidad. Creemos que es fundamental que los actores de la salud cuenten con la formación adecuada para detectar los signos de alarma que permitan sospechar una enfermedad genética, contar con los recursos humanos especializados en dicha área, así como acceso a estudios sobre el genoma. Esto se logra a través de políticas de salud que contemplen estas enfermedades, las que individualmente son poco frecuentes, pero que en su conjunto afectan a una parte importante de la población.