Introducción
La intensificación de los sistemas productivos ovinos, principalmente para la producción de carne ha llevado a la utilización en forma frecuente de raciones conteniendo monensina sódica en su formulación (Kremer, 2010). Este antibiótico del grupo de los ionóforos es utilizado ampliamente en los animales domésticos como coccidiostático y promotor de crecimiento (Cooper y Valentine, 2016). Otros ionóforos de uso menos frecuente son la salinomicina, narasina y lasalocido (Barros, 1998).
A nivel internacional existen reportes de intoxicación por estas drogas en ovinos (Rissi y Barros, 2010; Ferreira y col., 2016), bovinos (Gava y col., 1997; Gonzalez y col., 2005) y equinos (Doonan y col., 1989; Bezerra y col., 1999). La toxicidad a la monensina varía considerablemente entre las especies, pero se considera a los equinos como la especie más susceptible (DL50 de 2-3 mg/kg), seguido de los ovinos (DL50 de 12-24 mg/kg), y los bovinos (DL50 de 50-80 mg/kg) (Cooper y Valentine, 2016).
Los casos de intoxicación generalmente se deben a errores en la mezcla del fármaco en la ración, al mezclado no homogéneo de la misma, al uso de raciones en una especie distinta para la que originalmente fue formulada, o a la utilización de la monensina en combinación con otros fármacos que potencian sus efectos, como por ejemplo la tiamulina, eritromicina, y sulfonamidas (Barros, 1998; Basaraba y col., 1999).
En ovinos, los síntomas clínicos de intoxicación pueden incluir anorexia, rigidez, debilidad muscular, ataxia, decúbito intermitente, orina oscura (mioglobinuria) y eventualmente la muerte (Rissi y Barros, 2010; Cooper y Valentine, 2016). Los niveles plasmáticos de las enzimas musculares creatina fosfoquinasa (CPK) y de la aspartato amino transferasa (AST) se encuentran aumentados (Bourque y col. 1986; Mendes y col. 2003). Los hallazgos patológicos más importantes se localizan principalmente en músculo cardiaco y en masas musculares del tren posterior (Cooper y Valentine, 2016), con alteraciones histopatológicas típicas de una degeneración y necrosis muscular de tipo monofásica y multifocal (Cooper y Valentine, 2016; Valentine y Mc Gavin, 2007).
El objetivo del presente trabajo es describir la epidemiología, clínica y patología de tres focos de intoxicación por monensina sódica en ovinos en la región Este del Uruguay.
Materiales y Métodos
Los tres focos de intoxicación por monensina ocurrieron entre enero de 2015 y febrero del año 2016 en los departamentos de Lavalleja, Rocha y Treinta y Tres.
El diagnóstico patológico se efectuó en el Laboratorio DILAVE Miguel C. Rubino Regional Este. Se realizó una necropsia en el primer foco (Caso Nº 1), se procesaron macroscópicamente órganos refrigerados de un animal del segundo foco (Caso Nº 2), y finalmente en el tercer foco se realizaron 4 necropsias (Casos Nº 3 a 6). Para la histopatología, muestras de los distintos órganos se fijaron en formol bufferado al 10%, se deshidrataron en alcohol, se incluyeron en parafina, se cortaron a 5-7 µm de espesor, se colorearon con Hematoxilina y Eosina (H&E) y se examinaron bajo el microscopio óptico.
En el primer foco se realizó también extracción de sangre de dos animales del mismo lote afectados, para análisis de las enzimas aspartato aminotransferasa (AST) y creatina fosfoquinasa (CPK) y para funcional renal, utilizando técnicas de laboratorio de rutina en el Departamento de Patología Clínica, DILAVE Miguel C Rubino, Montevideo (Dr. Gonzalo Uriarte).
Muestras de ración del tercer foco se remitieron al Dr. Alejandro Muñoz (Laboratorio QV Chem, La Plata, Argentina), para determinación de los niveles de monensina mediante la técnica de cromatografía líquida de alta eficacia con método de detector mediante luz ultra violeta (HPLC-UV).
Resultados
Descripción de los focos
En el Cuadro 1 se detallan los datos epidemiológicos de los tres focos registrados en el Laboratorio DILAVE Miguel C. Rubino Regional Este.
En el foco Nº1 el predio utilizaba sales minerales con 2000 ppm de monensina para los bovinos pero los carneros también tenían acceso a dicha suplementación. A su vez en el foco Nº2 los corderos estaban siendo suplementados con una ración comercial de engorde para bovinos que contenía un mínimo de 20 ppm de monensina según lo indicaba la etiqueta comercial. Por último, en el tercer foco, la alimentación era a base de pasturas y una ración especialmente elaborada sin monensina a solicitud de la cabaña, pero en la formulación de la misma se utilizaba un mixer donde se preparaba también ración con monensina para bovinos. Pocos días antes de que los animales enfermaran se había cambiado la partida de ración. En otro lote de animales que se mantuvieron comiendo la partida anterior de ración no se observaron animales enfermos.
Signos clínicos
Los signos clínicos observados fueron similares en los 3 focos. Algunos animales presentaron muerte súbita, mientras que en otros se observó anorexia, paresia del tren posterior, decúbito costal, postración y muerte. El animal remitido vivo al laboratorio del primer foco presentaba también como los otros casos paresia de tren posterior, decúbito costal, sensorio normal y temperatura 38.7 ºC (Figura 1).
Hallazgos patológicos
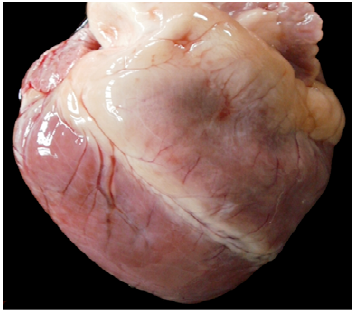
En las necropsias realizadas (Casos Nº 1, 3, 4, 5 y 6) había edema subcutáneo generalizado, hidrotórax, hidroperitoneo y edema pulmonar moderado a severo y en el saco pericárdico se observó un contenido líquido de color amarillo pajizo, que luego de unos minutos coagulaba. En todos los casos, los músculos esqueléticos de las extremidades posteriores estaban pálidos, edematosos (Figura 2) y con estriaciones lineales blancas (Figura 3). En el Caso Nº 1, el contenido de la vejiga urinaria presentaba coloración rojiza y en el corazón se observó edema en surcos coronarios y palidez de la pared ventricular derecha (Figura 4).
Histológicamente, en todos los casos las lesiones correspondían a una miopatía monofásica, multifocal, caracterizada por degeneración y necrosis de fibras musculares esqueléticas, degeneración hialina de Zenker, difusa y granular, fragmentación de las fibras musculares, pérdida de estrías y núcleos picnóticos. También había regeneración con proliferación de células satélites (mioblastos) (Figura 5). En el Caso Nº 1 había lesiones en miocardio caracterizadas por necrosis multifocal con reemplazo de fibras por tejido conectivo fibroso, e inflamación mononuclear intersticial y en riñón había nefrosis mioglobinurica.

Figura 3: Músculo esquelético. Áreas de masas musculares del tren posterior con edema, palidezmarcada y estriaciones blancas (Caso Nº 2).
Hallazgos de laboratorio
El enzimograma realizado en dos animales del primer foco mostró marcada elevación de enzimas musculares. La AST presentó valores mayores a 3450 U/L (Valor Referencia (VR) < 160 U/L) y CPK por encima de 1200 U/L (VR< 40 U/L). El funcional renal también reveló elevación moderada de urea por encima de 37 mmol/L (VR 4.8 - 8.8 mmol/L) y la creatinina por encima de 166 umol/L (VR <135 umol/L).
En el análisis de 4 submuestras de la ración del tercer foco se encontraron valores de monensina altamente variables (284 ppm, 186 ppm, 113 ppm y 380 ppm), lo que es altamente sugestivo de contaminación de la ración en el mixer (Comun. Pers. Dr. Alejandro Muñoz, 2016).
Discusión
Los resultados del presente trabajo confirman por primera vez en Uruguay la intoxicación por monensina en ovinos. Los tres focos sucedieron por la utilización de ración formulada para bovinos, por el acceso accidental a sales minerales con monensina elaborada para bovinos, o por la contaminación en los mixers durante el proceso de elaboración de la ración.
Los hallazgos macro y microscópicos y la marcada elevación de las enzimas musculares AST y CPK fueron coincidentes con otros trabajos que muestran el carácter miotóxico y cardiotóxico de la monensina (Mendes y col., 2003; Cooper y Valentine, 2016). Los hallazgos histopatológicos en corazón y riñón que estaban presentes en el primer y tercer foco pero no en el segundo foco puedan deberse a concentraciones de antibiótico en la ración superiores a 20 ppm.
La monensina cuando llega a niveles tóxicos interfiere en el transporte normal de Na+/Ca++ a través de la membrana celular, lo que provoca un aumento de la concentración de Ca++ intracelular. Cuando este aumento sobrepasa determinado umbral, el Ca++ se libera hacia el citoplasma causando una hipercontracción en la célula muscular. Los niveles elevados de Ca++ activan las proteasas y fosfolipasas musculares, las cuales desencadenan los procesos degenerativos que se observan en el músculo estriado esquelético y cardíaco (Novilla, 2011).
En el diagnóstico diferencial de esta intoxicación se debe incluir en primer lugar a la deficiencia de Vitamina E y Selenio (Enfermedad del músculo blanco), que también produce degeneración y necrosis muscular, generalmente en corderos, en áreas donde los suelos son deficientes en selenio. Las lesiones en esta enfermedad corresponden a una miopatía polifásica, multifocal con calcificación de fibras musculares, mientras que los hallazgos histológicos descriptos se corresponden a una miopatía monofásica, multifocal (Valentine y Mc Gavin, 2007; Cooper y Valentine, 2016).
Otros cuadros miotóxicos y cardiotóxicos, como la intoxicación por Senna occidentalis (cafetillo) (Barros y col., 1999), Ateleia glazioviana (timbó) (Lücke Stigger y col., 2001) y gosipol (compuesto presente en la semilla de algodón Gossypium spp.) (Morgan y col., 1988), fueron descartados ya que ninguna de estas especies se encontraban presentes en los predios problema.
En la suplementación de ovinos no se deberían utilizar raciones y/o sales formuladas para bovinos que contengan dicho ionóforo. A su vez en las plantas elaboradoras, donde no se cuente con procesos separados para la preparación de raciones para bovinos y ovinos se debe asegurar la limpieza del mixer entre cada elaboración como forma de evitar la contaminación cruzada.
En conclusión la intoxicación por monensina en ovinos afecta principalmente los músculos esqueléticos posteriores y el músculo cardiaco, y la misma debe sospecharse, si los animales tienen acceso a raciones o sales minerales con monensina por encima de los valores recomendados para esta especie.












 Curriculum ScienTI
Curriculum ScienTI