Introducción
La producción fisiológica de líquido pericárdico es llevada a cabo por la membrana pericárdica y el volumen oscila entre 0.3 a 1 ml en caninos saludables. El deslizamiento de la membrana pericárdica junto al epicardio (membrana que recubre al corazón), logra una correcta armonía en cada latido cardíaco y evita así la aparición de arritmias, proporciona un ambiente acuoso para promover la distensión del corazón en diástole y su contracción sistólica (Majoy, 2018).
El líquido pericárdico además de lubricar la superficie del corazón contiene un componente humoral y otro celular del sistema inmunitario. Ambos se encargan de proteger al corazón y pericardio de agentes microbianos y facilitan la eliminación de células y detritos tisulares para asegurar la homeostasis. Dentro del componente celular, en medicina humana, se ha encontrado mayor cantidad de Linfocitos B1 que en sangre periférica, y a su vez, la presencia de autoanticuerpos del tipo anticitrato cintasa, que son parte del sistema inmune innato. En este estudio se abre un nuevo pardigma a la hora de relacionar al líquido pericárdico con la eliminación de detritos celulares asociados a la actividad mitocondrial cardíaca y daño cardíaco. La citrato cintasa es una enzima intramitocondrial, producida en células cardíacas que son las que tiene mayor concentración de mitocondrias por cm3. Esta enzima es liberada por las células cardíacas lesionadas, por lo tanto, la función de los autoanticuepos anticitrato cintasa sería la de inactivar la enzima liberada en el pericardio (Simon, 2018). Éste es un área de poca información científica en medicina veterinaria. Debido a ésto, existe nula evidencia en cuánto al orígen de los líquidos colectados, la participación de los tipos celulares y si existen o no autoanticuerpos del tipo anticitrato cintasa como se evidenció en medicina humana.
Cuando la producción de líquido se torna excesiva, se puede provocar un taponamiento cardíaco, el que se define como la colecta pericárdica de diverso origen que puede generar colapso de las cámaras cardíacas derechas, disminuir la precarga cardíaca, consecuentemente provocar una disminución del gasto cardíaco (GC) y culminar en un trastorno hemodinámico severo, potencialmente mortal.
Las colectas pericárdicas pueden ser agudas o crónicas. Las agudas generalmente se asocian a hemorragia cardíaca provocada por traumatismo torácico severo y las crónicas se asocian a efusiones de origen maligno, pericarditis infecciosas e idiopáticas, en las cuales el líquido contenido se acumula de forma paulatina hasta provocar el taponamiento cardíaco. Las colectas crónicas pueden a su vez estar relacionadas a insuficiencia cardíaca derecha, y provocar ascitis. El taponamiento cardíaco, por lo tanto, es una condición aguda que se puede generar tanto en colectas agudas como en crónicas (Magallanes, 2018).
El tipo de colecta que nos interesa detallar en este reporte es la asociada a tumores cardíacos en caninos. Los tumores primarios de base de corazón en caninos tienen una incidencia de 0.19 %. Los hemangiosarcomas son los más comunes y están mayoritariamente ubicados en la aurícula derecha. Otros tumores comúnmente diagnosticados, son los quemodectomas, los cuales provienen de los órganos quimiorreceptores. Estos tumores están ubicados en el arco aórtico, en la bifurcación de las arterias subclavias y en el tronco carotídeo. En último lugar en cuanto a la frecuencia de diagnóstico, se encuentran los mesoteliomas. Estos tumores malignos se diseminan en la superficie serosa del pericardio, siendo difícil su diganóstico ya que, al ser su presentación difusa, hace difícil su visulaización en ecocardiografías (Marwam y Katz, 2011). Dentro de los tumores descritos, los hemangiosarcomas son potencialmente los más exudativos (Lew et al, 2019). Estos producen exudados serosanguinolentos con alta celularidad, y dado su origen seroso, son desfibrinados por lo tanto no coagulan. Por este motivo, si existiera formación de coágulos, indicaría la punción accidental de las cámaras cardíacas en las pericardiocentesis (Ware, 2015).
Los tratamientos sugeridos para las colectas pericárdicas, varían desde pericardiocentesis únicas o seriadas con aspiración, cirugía como pericardiectomía subtotal subfrénica, pericardiotomía percutánea con balón descrita para humanos (Navarro, 2002), inyección de quimioterápicos dentro del espacio pericárdico y resección tumoral (Vega Benavides, y Jiménez-Soto, 2017).
Está descrito que el drenaje a través de punciones seriadas en pacientes con colectas malignas, se ha asociado con rangos de sobrevivencia de 0 a 229 días, con un promedio de 56 días. Este informe concreto es en caninos con hemangiosarcoma y la causa de muerte no fue por el tumor ni sus metástasis, sino que fue a consecuencia de taponamiento cardíaco (Tobías, 2017). Por este motivo convenimos en que es necesario implementar sistemas distintos, poco invasivos, mediante los cuales se acceda al espacio pericárdico sin sembrar células tumorales a través de punciones seriadas y permitan la aspiracón y la inyección. Asimismo, sería oportuno investigar más el uso de drogas inyectadas localmente en el espacio pericárdico, que enlentezcan la producción de líquido de manera de prevenir el taponamiento en estos pacientes que inevitablemente fallecerán.
Se ha reportado la realización de pericardiocentesis y aspiración en caninos hospitalizados con efusión pericárdica mediante la técnica de Seldinger utilizando catéteres de vía central, habiendo sido extraídos a las 48 horas de colocados (Cook et al, 2019). Una complicación que surgió en la colocación de estos catéteres y en pericardiocentesis, fue la producción de arritmias cardíacas ventriculares, las cuales fueron corregidas con Amiodarona (Humm et al, 2009).
A diferencia de los catéteres de vía central el dispositivo Port-a-Cath, (“puerto y catéter” en idioma español), consta de un catéter venoso de dos componentes: el puerto o reservorio que se implanta en el subcutáneo y el catéter radiopaco en una vena de gran calibre. Estos dispositivos proporcionan un acceso sencillo, seguro y permanente al sistema vascular para la realización de tratamientos endovenosos prolongados y ofrecen la posibilidad de múltiples y frecuentes punciones a largo plazo, así como la extracción de sangre de una manera menos cruenta y aséptica (Vázquez Luna y Jordán González, 2018). A pesar de que su uso está destinado a lo anteriormente detallado, (Cahalane y Flanders, 2012) describió la implantación de Port-a-Cath en la pared torácica para el manejo de neumotórax espontáneo recidivante en 2 pacientes caninos pero no se ha publicado su uso en pericardio hasta la fecha. A su vez se reportó el uso de estos dispositivos para el manejo de derrame pleural en seis perros y cuatro gatos (Brooks y Hardie, 2011). Por las ventajas que presenta este tipo de dispositivo, y la experiencia reportada en las citas anteriores, es que se eligió su implantación en el pericardio de esta paciente.
Debido a que las recidivas de las colectas pericárdicas son la causa de muerte en estos animales, el uso de sustancias citostáticas que eviten o enlentezcan la producción de líquido, podría ser beneficiosa para evitar la muerte por taponamiento cardíaco. En medicina humana se describe el uso de Cisplatino en pacientes con tumores de base cardíaca y colectas pericárdicas malignas, habiendo sido eficaz la inyección de 50 mg de Cisplatino en el espacio pericárdico. En algunos casos demostró ser eficaz a la hora de evitar recidivas y prolongar la vida de las personas (Pavón Jiménez, 2000).
Materiales y métodos
Paciente canino hembra, nacida en Montevideo (Uruguay), de la raza Ovejero Alemán de 8 años, de 35 kg de peso vivo, esterilizada. Presentaba su plan sanitario vigente y se alimentaba con comida balanceada Premium (marca Equilibrio) sin antecedentes de enfermedades previas. Comenzó con decaimiento, dificultad para incorporarse, sensorio deprimido y angustia respiratoria. Consultó en otra clínica en la que se realizó una ecografía de tórax constatando un derrame pericárdico de origen desconocido. Se drenó la colecta pericárdica, según relato anamésico del tutor, mediante punción pericárdica (pericardiocentesis), hasta que el animal recuperó su condición previa a la instauración del cuadro clínico. Se dio de alta con estrictas indicaciones que debería consultar si surgían los mismos síntomas. A los 5 días de este episodio, se realizó una ecocardiografía con un ecógrafo marca Chison en modo B, de urgencia en el Hospital Veterinario “La Carlota”, constatando la presencia de un tumor en la pared libre de la aurícula derecha justo en la unión con el ventrículo derecho de ecogenicidad mixta (figura 1).
En esa consulta se repitió la pericardiocentesis, obteniendo 150 ml de un líquido serosanguinolento, que no coaguló incluso hasta haber transcurrido más de una hora. Se remitió una muestra al laboratorio Vetin (Montevideo) para estudio citológico. El informe citológico dio un resultado compatible con hemangiosarcoma, la celularidad encontrada fue de células del tipo endotelial prominentes de gran tamaño con anisocitosis, vacuolas intracitoplasmáticas, alterada relación núcleo citoplasma y presencia de mitosis (figura 2).

Figura 2: Imagen microscòpica a 200x del frotis obtenido de la pericardiocentesis y teñido con May Grunwald Giemsa. Se observan células endoteliales prominentes con alterada relación núcleo citoplasma, con abundantes vacuolas intracitoplasmáticas. Línea densa referencia de 25 µm
Se sugirió la colocación del Port-a-Cath cuando la paciente comenzara a colectar nuevamente pero sin signos clínicos de taponamiento cardíaco para evitar posibles complicaciones anestésicas. A los 15 días del diagnóstico ecográfico y con autorización de los tutores se realizó el implante del Port-a-Cath marca Profuse de calibre 9.6 French en el pericardio. Es importante resaltar que los tutores de la paciente no acordaron en consultar con especialista en oncología para encarar una oncoterapia en conjunto a la colocación del catéter y solo accedieron a la inyección de quimioterápico local (Cisplatino).
Anestesia
Se realizó la venoclisis con catéter (Supercath, Medikit Co.), Nº 20G en la vena cefálica izquierda y se comenzó con fluidoterapia de mantenimiento a una tasa de 5 ml/kg/hora de suero Ringer con Lactato (Laboratorio Fármaco Uruguayo). Se administró un bolo de 5 mg/kilo de propofol al 1% hasta abolición de reflejo tusígeno y se intubó con una sonda endotraqueal Nº 9. La anestesia se mantuvo con el método TIVA (total intravenous anesthesia) con Propofol a una tasa de 0,4 mg/kilo/minuto y oxigenación a un flujo de 12 ml/kg de peso. Se realizó un bloqueo de los nervios intercostales entre el cuarto y quinto espacio intercostal con 0,03 ml/Kg por punto de inyección de Bupivacaína al 0.5 % (Bupivet, Richmond) (Otero, 2017) y una infiltración en el tejido subcutáneo y piel a la altura del quinto espacio intercostal derecho, justo paravertebral, de 5 cm de diámetro donde se alojaría el puerto del dispositivo, administrándose además un bolo de Fentanilo de 5ug/Kg por vía endovenosa justo antes de la maniobra de incisión e introducción del catéter al tórax. La monitorización básica de la función cardiovascular y respiratoria (SpO2, ECG, Temperatura) se realizó con monitor multiparamétrico marca Utech China y el control de la Presión Arterial Sistólica fue realizado con doppler marca Med Mega Brasil. Todos los parámetros medidos se encontraron dentro de los valores de referencia para caninos de 8 años durante el procedimiento. (Otero, 2012). La SpO2 se mantuvo entre 97 y 99%, la PAS osciló entre a 100 y 116 mmHg, la temperatura osciló de 38.9ºC al incio a 37.9ºC al finalizar el procedimiento y el ECG evidenció un ritmo sinusal durante todo el procedimiento.
Técnica quirúrgica
El animal se posicionó en decúbito lateral izquierdo con el hemitórax derecho hacia arriba y se realizó tricotomía amplia de toda la parrilla costal derecha. Se lavó la piel con una solución jabonosa de clorhexidina y se embrocó con una solución alcohólica al 70 %. El kit del catéter tipo Port-a-Cath viene provisto de hoja de bisturí, el catéter, reservorio, la guía metálica y el dilatador o introductor. En una primera instancia, se realizó una incisión en la zona paravertebral derecha justo debajo de la apófisis transversa de craneal a caudal de aproximadamente 4 cm de largo, disecando de forma roma el tejido subcutáneo y se colocó el reservorio de silicona subcutáneo.

Figura 3: Realización de bolsillo subcutáneo y tunelización. Incisopunción en zona paraesternal derecha
Luego, se unió el catéter flexible al trócar de metal y desde la zona de unión con el reservorio precolocado se realizó una tunelización subcutánea en dirección dorso ventral en el 5º espacio intercostal, deslizando el catéter hasta la zona paraesternal derecha. En el mismo sitio se realizó una incisopunción y se exteriorizó el catéter (figura 3).
Técnica de Seldinger modificada
La técnica propuesta para la colocación de estos dispositivos, descrita por Seldinger en 1953, es la de mayor aceptación y más difundida. Consiste en la introducción de una guía metálica al sistema venoso a través de la que se coloca el catéter (Imigo et al, 2018).
En la zona paraesternal derecha contiguo a la salida del catéter, se procedió a realizar una punción en el espacio pericárdico con la aguja Nº 14 que trae el mismo kit. A través de la aguja se introdujo la guía metálica, posteriormente se extrajo la aguja y se comprobó mediante ecografía que la guía continuaba en el espacio pericárdico. Siguiendo la guía se colocó el dilatador a través del cual posteriormente se introdujo el catéter (figura 4).

Figura 4: Reservorio subcutáneo fijado con puntos de sutura con material de sutura no absorbible Polipropilene 2-0
Una vez introducido el catéter en el espacio pericárdico se procedió a extraer por completo el dilatador, abriendo el cerrojo del mismo, y sosteniendo el catéter en posición. Una vez que se confirmó la permanencia del catéter en el espacio pericárdico, mediante ecografía, se realizó un punto de fijación en la 5ª costilla con material no absorbible de polipropilene (Surgipro, Providen Nº 0). La parte de la tubuladura sobrante del catéter fue removida, cortándola justo a la altura del reservorio. Posteriormente, el extremo proximal de dicha tubuladura se unió al reservorio y se lo fijó con los precintos que trae para dicho propósito el kit. Se cerró el bolsillo subcutáneo mediante 5 puntos simples con material no absorbible de polipropilene (Surgipro, Providen Nº 0). Finalmente se chequeó la permeabilidad del catéter y se extrajo la totalidad de la efusión pericárdica (figura 5).
El tratamiento posquirúrgico (durante los siguiente 5 días), consistió en Cefalexina 25 mg/kg de peso cada 12 horas (v.o), Carprofeno 2.2 mg/kilo cada 12 horas (v.o) y Furosemide 2 mg/kilo cada 12 horas (v.o).
A los 7 días se inyectó 5 ml de Cisplatino al 5% a través del catéter hacia el espacio pericárdico. Posteriormente se lavó el mismo con 2 ml de suero fisiológico. Es importante resaltar que los tutores de la paciente no acordaron en consultar con especialista en oncología para encarar una oncoterapia en conjunto a la colocación del catéter y solo accedieron a la inyección de quimioterápico local (Cisplatino) como inhibidor de la producción de la colecta de origen maligno.
Controles
Se realizaron controles semanales (cada 7 días) en los que se chequeó el posicionamiento del catéter mediante ecografía transtorácica en Modo B y la permeabilidad mediante la inyección de 2 ml de suero fisiológico. Al no existir evidencias en cuanto a la cantidad de líquido a inyectar para comprobar la permeabilidad, una vez que se verificó con modo Doppler el movimiento del suero inyectado, se evidenció su permeabilidad, siendo el punto de corte 2 ml de suero en cada inyección (figura 6).

Figura 6: Imagen ecográfica donde se aprecia la masa adherida a la aurícula derecha y se observa el catéter en lateral al ventrículo derecho
Los puntos de sutura se extrajeron a los 14 días, y se controló la evolución de la cicatriz. A los 21 días se extrajo una muestra del líquido y se envió al laboratorio Vetin para la realización de un cultivo bacteriano, el cual se realizó en Agar McConkey y permaneció estéril durante 48 horas. A los 25 días se realizó un control radiológico con triple incidencia para tórax, para comprobar la correcta ubicación del catéter y evaluar metástasis. El estudio radiográfico concluyó en que el catéter rodeaba la zona cardíaca desde caudal a craneal y desde derecha a izquierda. Se evidenció una deformación en el lado derecho cardíaco justo en la zona donde ecográficamente se ubica el tumor. No se evidenciaron metástasis visibles radiográficamente (figura 7).
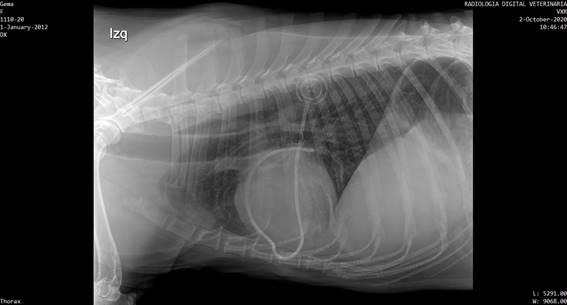
Figura 7: Imagen radiológica lateral izquierda de tórax donde se aprecia el catéter bordeando la silueta cardíaca y el reservorio subcutáneo radiodenso con las letras CT
Al día 25 también se realizó un control de laboratorio de rutina que incluyó hemograma completo (figura 8) evidenciando una anemia macrocítica, crasis en referencias normales, enzimograma hepático, uremia, creatininemia dando resultados en rangos normales y glicemia levemente aumentada (figura 9 y 10).
Cabe destacar que no se eligió estos días de forma objetiva, si no que se coordinó según disponibilidad de colegas y tutores.
Los tutores continuaron acompañando a la paciente a los controles semanales de permeabilidad y ecografía para corroborar si existía colecta. El pericardio se mantuvo sin colecta hasta el día 52 cuando evidenció nuevamente los signos que motivaron la consulta al inicio del cuadro clínico. La paciente presentaba disnea ante actividades domésticas diarias (subir escaleras o mientras comía) y se comenzó a drenar el líquido colectado en el pericardio a través del Port-a-Cath siendo variable la cantidad obtenida en cada aspiración (entre 15 y 50 ml). El intervalo entre aspiraciones fue de 3 días, hasta el día 68 en el que se realizó su eutanasia compasiva ya que no hubo mejoría clínica luego de las maniobras(figura 11).
Resultados
El catéter se mantuvo permeable en todos los controles y su posición ecográfica fue la esperada hasta 68 días luego del implante.
En esta paciente en particular, la causa que llevó a la eutanasia fue la aparición de metástasis y la muerte no la ocasionó el taponamiento cardíaco. La zona donde estaba ubicado el reservorio subcutáneo se mantuvo sin ninguna complicación hasta la fecha de su muerte (figura 12). La misma fue accesible para las punciones y no ocasionó molestias al animal. A partir de la administración de cisplatino el séptimo día luego del implante del catéter, el animal no evidenció recurrencia en la efusión pericárdica hasta el día 52. A partir de ese día se comenzó a aspirar la efusión pericárdica según presentación clínica, lo que se manifestaba exclusivamente por disnea. El Port-a-Cath fue controlado por ecografía modo B. La paciente no manifiestó incomodidad alguna ni ningún tipo de incapacidad provocada por el catéter hasta el día 68 en el cual se decidió la eutanasia por parte de los tutores cuando comenzó con disnea en reposo e incapacidad para dormir, signos sugestivos de metástasis pulmonar. Se realizó una toracotomía post mortem constatando la presencia de múltiples metástasis nodulares de aspecto hemorrágico, color negruzco, en corazón, pulmones, pleura parietal y subcutáneo (figura 13).

Figura 13: Foto de corazón pos mortem evidenciando la presencia de numerosos nódulos negruscos y hemorrágicos en la aurícula derecha
Se remitió muestra de aurícula derecha para su estudio histopatológico y se concluyó el diagnóstico de hemangiosarcoma con tinción de Hematoxilina-Eosina (figura 14).

Figura 14: Aumento 40x. Tinción con Hematoxilina y Eosina de una sección de aurícula derecha. Se observa una neoformación no encapsulada, no bien delimitada de un crecimiento tendiendo a formar espacios vasculares de células elongadas con citoplasma eosinófilo con los límites celulares poco nítidos. El núcleo es oval grande vesicular con la presencia de nucléolos prominentes en algunas células e hipercrómatico en otras. En algunas pequeñas áreas estas células están formando pequeños capilares con sangre en su luz. Hay extensas áreas de necrosis.
Discusión
La colocación de un catéter intrapericárdico con reservorio subcutáneo tipo Port-a-Cath fue una alternativa para evitar las punciones pericárdicas múltiples y sus complicaciones tales como las arritmias cardíacas y la siembra de células malignas a la cavidad torácica (Humm KR 2009). El Port-a-Cath fue una buena alternativa a la hora de realizar la colecta de derrame pericárdico, sin provocar estrés ni sedaciones sucesivas a la paciente, facilitó el acceso a la cavidad pericárdica para la administración de quimioterápico local (Cisplatino) y evitó la muerte por taponamiento cardíaco anticipando la colecta masiva. Su implante se realizó mediante una cirugía de 15 minutos, y supuso un grado medio de dificultad quirúrgica. Si bien es una técnica innovadora se realizó mediante la técnica de Seldinger modificada para vías centrales con reservorio y se adaptó a este caso particular (Vázquez Luna y Jordán González, 2018). Al comparar con las técnicas de pericardiectomías (Vega Benavides, y Jiménez-Soto, 2017), la colocación de un catéter evitaría la siembra de células tumorales a la cavidad pleural y las complicaciones quirúrgicas de dichas técnicas que se realizan mediante toracotomía. Asimismo, como sucedió en esta paciente, sus tutores no querían someterla a ningún procedimiento quirúrgico, lo que muchas veces sucede en la práctica clínica diaria. Existe la referencia de técnicas similares, donde catéteres de vía central permanecieron solamente 48 hs en el espacio pericárdico y expuestos al exterior (Cook et al, 2019). En este estudio, la permanencia de los catéteres no pudo ser a largo plazo por la potencial infección del espacio pericárdico debido a que el extremo libre del catéter de vía central se encuentra en el exterior del paciente. En el caso de un Port-a-Cath, esto se evitaría ya que es cerrado totalmente, no hay conexión con el exterior del animal, por lo que la permanencia en el espacio pericárdico será hasta que el animal fallezca u ocurra alguna complicación que motive la extracción del mismo. Si bien el uso de cisplatino en el pericardio está descrito en medicina humana y ha sido estandarizado para las colectas malignas, no ocurre lo mismo en medicina veterinaria (Pavón Jiménez, 2000) por lo tanto se sugiere estandarizar su uso para este tipo de pacientes, y vincular la evolución de los volúmenes de colecta a la inyección de esta droga en el espacio pericárdico en caninos. Hasta el día 52 post colocación del catéter, la paciente no colectó líquido y continuó teniendo una calidad de vida normal, a pesar de su mal pronóstico vital. No se realizó una planilla o un acceso objetivo a estos datos, pero se recababa la información de sus tutores en cada visita, quienes manifestaban que comía sin dificultad, salía a pasear, jugaba dentro y fuera de su casa, y subía escaleras sin dificultad respiratoria. Es necesario desarrollar un protocolo para la colocación y la correcta elección del calibre del Port-a-Cath para cada paciente. La longitud que se introduce en el pericardio deberá estandarizarse, con el fin de que no sea insuficiente (para evitar la migración hacia la cavidad pleural), ni excesiva (evitando estrangulamiento del catéter). Los autores consideran que en este caso en particular habría sido suficiente introducir la medida que coincida con la distancia entre la pleura parietal y el ápice cardíaco (punto más declive), de esta manera el líquido colectado habría estado siempre en contacto con el extremo del catéter y habría facilitado aún más la aspiración en decúbito esternal o simplemente con la paciente sentada en la mesa del consultorio.
Conclusiones
La implantación de un Port-a-Cath mediante la técnica de Seldinger modificada, permitió asegurar un sitio percutáneo de punción, inyección y drenaje para la prevención del taponamiento cardíaco asociado a colecta de origen tumoral en esta paciente. Con esta técnica se alcanzó una sobrevida de 68 días, preservando la calidad de vida del animal sin complicaciones asociadas a la implantación del dispositivo. Por lo tanto, el pericardio se mantuvo sin efusión durante 52 días de un total de 68 días de sobrevida luego del implante. La causa de muerte en este caso fue la enfermedad primaria y sus agregados metastásicos, pero no el taponamiento cardíaco.






















