Introducción y antecedentes
Al momento de realizar y concluir estos trabajos la clasificación vigente era la surgida del Workshop for the Classification of the Periodontal Diseases and Conditions organizado por la American Academy of Periodontology (AAP) en 1999 5,6.
De acuerdo a esta clasificación, las Periodontitis Crónicas son las más comunes y se caracterizan por su evolución lenta. En cambio, las Periodontitis Agresivas caracterizan a aquellas que en un período corto de tiempo pueden llevar a la pérdida de los tejidos de soporte del diente. Dentro de los cuadros agresivos se distinguían la Periodontitis Agresiva Localizada (PAL) y la Periodontitis Agresiva Generalizada (PAG) en concordancia con la extensión de la destrucción periodontal 7.
Recientemente, se ha consensuado una nueva clasificación de enfermedades periodontales basada en estadios, extensión/distribución y grados sin la diferenciación en agresiva y crónica. Los estadios se basan en la severidad y complejidad del manejo (grado de tejido dañado o perdido). El grado de extensión y distribución en referencia a cuadros localizados o más generalizados. Los grados como indicación de tasa de progresión fundamentalmente 8.
Si quisiéramos efectuar una correlación de los patrones clínicos de nuestros estudios con esta nueva clasificación, respecto a los estadios, en nuestro caso los pacientes que seleccionamos presentaban una profundidad de bolsa >= 5 mm y una pérdida ósea >= 2 mm.
Desde el punto de vista de extensión y distribución, la diferenciación de los cuadros crónicos y agresivos generalizados en contraste con los cuadros agresivos localizados.
Finalmente, desde el punto de grado, la diferenciación de la tasa de progresión más lenta de los crónicos en contraste con los cuadros agresivos.
En la enfermedad periodontal numerosos estudios basados en la especificidad bacteriana como responsables de los cuadros permitió enfocar y establecer el rol de algunos microorganismos como A. actinomycetemcomitans, P. gingivalis, T. denticola, P. intermedia y F. nucleatum en las patologías periodontales 9.
De acuerdo con diferentes estudios, los microorganismos que suelen detectarse en los cuadros de periodontitis crónica son los pertenecientes al complejo rojo como P. gingivalis3,9,10.
A su vez, en el desarrollo de la Periodontitis Agresiva se ha asociado a A. actinomycetemcomitans y P. gingivalis siendo el primero particularmente importante en cuadros localizados y el segundo en generalizados 3,11,12) pero también se han relacionado otro grupo de periodontopatógenos como T. forsythia, P. intermedia y F. nucleatum3,9.
De todas formas, estos microorganismos no actúan aisladamente, sino que interactúan entre ellos y es así como determinan los efectos de la enfermedad 9.
Sigmund Socransky y colaboradores demostraron que los microorganismos en la placa subgingival se asocian entre ellos formando complejos bacterianos y los categorizaron con colores: verde, amarillo, azul, violeta, naranja y rojo. Esos colores se relacionan con la correlación de estos complejos con los diferentes grados de severidad de enfermedad periodontal y con la progresión de ésta 11. Los microorganismos que se destacan en las patologías periodontales son los que conforman el complejo rojo y naranja de Socransky y el microorganismo Aggregatibacter actinomycetemcomitans3,7,12,13,14.
Las diferencias principales entre salud y enfermedad se basan en el predominio de los clusters rojo y naranja. El complejo rojo que aparece más tardíamente en el desarrollo del biofilm está conformado por bacterias que se consideran periodontopatógenas a saber: Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia11,14.
Por otra parte, A. actinomycetemcomitans juega un rol en las periodontitis agresivas, en particular en la PAL siendo posible que juegue un rol importante en el inicio de la enfermedad y luego sea reemplazada por otras bacterias anaerobias estrictas mientras avanza la enfermedad 12.
Nuestro entendimiento hasta el momento de realizar estos estudios en pacientes en Uruguay era que la relevancia de los microorganismos estudiados en los cuadros periodontales de pacientes uruguayos se mantenía, pero no se contaba con estudios locales.
Con el advenimiento de las técnicas moleculares fue posible conocer la realidad en nuestro país sin los riesgos de pérdida de viabilidad que implica la recuperación en el laboratorio utilizando las técnicas convencionales de los microorganismos periodontales, mayoritariamente anaerobios estrictos.
Los microorganismos analizados en este comparativo fueron dos de los que integran el complejo rojo, P. gingivalis y T. forsythia y dos del complejo naranja P. intermedia y F. nucleatum. En el caso de estos últimos, era de interés su inclusión en nuestros estudios dada su capacidad de formar puentes lo que es relevante en la conformación de biofilms14 .
El otro microorganismo estudiado fue A. actinomycetemcomitans que históricamente ha sido asociado a los cuadros de periodontitits, en particular en los cuadros agresivos localizados 3,12
Con este trabajo se busca realizar un análisis comparativo de los patrones de prevalencia de estos cinco patógenos periodontales entre los cuadros de periodontitis estudiados.
Materiales y métodos
Se obtuvieron muestras de 101 pacientes seleccionados con cuadros de Periodontitis crónica y agresiva de la Clínica de Periodoncia de la Facultad de Odontología de UDELAR. Se estudiaron 51 pacientes con periodontitis crónica y 50 con periodontitis agresiva, sin previo tratamiento periodontal y que hubieran firmado el consentimiento informado. Se exceptuaron pacientes con Diabetes, Artritis, Colitis Ulcerativas, VIH, Cáncer y Patología Cardiovascular, mujeres embarazadas y aquellos que recibieron tres meses antes tratamientos con antibióticos y/o antiinflamatorios. El comité de ética de la Facultad de Odontología UDELAR, aprobó el diseño ambos estudios basándose en la normativa MERCOSUR y la Declaración de Helsinki sobre la experimentación en la que participan seres humanos.
Las muestras se obtuvieron removiendo la placa supragingival evitando el sangrado usando gasa estéril. La toma se realizó introduciendo puntas estériles de papel en lo más profundo de la bolsa manteniéndolas durante 15 segundos. Posteriormente, se colocaron en 1.5 ml de medio reducido RTF (Reduced Transport Fluid) 15. Cada muestra constó de 8 puntas de papel medianas (Nº25) de 4 sitios seleccionados en cada cuadrante.
Las muestras fueron sometidas tanto a técnicas tradicionales de Bacteriología como moleculares de estudio del genoma (PCR) en la Cátedra de Microbiología de la Facultad de Odontología de la UDELAR.
El diagnóstico bacteriológico tradicional se realizó para el bacilo Gram negativo facultativo A. actinomycetemcomitans y para P. gingivalis y P. intermedia (ambos bacilos Gram negativos anaerobios estrictos pigmentados). La identificación por PCR se realizó para los antemencionados y también para T. forsythia y F. nucleatum. Las muestras se procesaron realizando agitación rigurosa durante 45 a 60 segundos y posteriormente realizando diluciones seriadas en RTF.
Para la recuperación de A. actinomycetemcomitans se utilizó TSVB: tripticasa soya, bacitracina (75 µg/ml), vancomicina (5.0 µg/ml), 10 ml de suero de caballo (10%) a través de la dilución de 1:10 en RTF e incubación en jarra con vela (para generar condiciones de capnofilia) durante 7 días a 37°C. Para recuperación de los anaerobios pigmentados se utilizó Brucella Agar: menadiona (200 µg/ml) y hemina (5 mg/ml) y sangre lacada a través de la dilución de 1:10, 1:100 y 1:1000 en RTF, sembrando 100 µl de las dos últimas diluciones e incubando en jarra de anaerobiosis durante 14 días a 37°C utilizando el reactivo de anaerobiosis Oxoid®.
Se almacenaron a -30ºC la muestra original y muestras de 100 µl de la muestra original para ser procesadas con la técnica de PCR.
Las cepas como controles positivos utilizadas fueron Aggregatibacter actinomycetemcomitans (ATCC 29522), Porphyromonas gingivalis (BAA-308), Prevotella intermedia (ATCC 25611), Tannerella forsythia (ATCC 43037) y Fusobacterium nucleatum (ATCC 25586).
La identificación por cultivo A. actinomycetemcomitans se hizo por morfología colonial, coloración de Gram, catalasa positivo y MUG negativa (4-Metilumbeliferil-β-D-galactósido) para estudiar la fermentación de la lactosa y también con API bioMérieux ®en caso de dudas.
La identificación de los anaerobios pigmentados se realizó por la formación de pigmento, fluorescencia para diferenciar P. gingivalis de P. intermedia y kit API bioMérieux ® en caso de dudas 1,2.
La extracción del genoma de cada cepa control, se realizó utilizando el Kit BeadTMGenomic DNA (como lo describe el fabricante Zymo Research®). La determinación de la concentración del ADN (ng/µl) se cuantificó por NanoDrop( 2000.
Se utilizaron las bases de datos de genomas microbianos con la finalidad de buscar y seleccionar las secuencias del 16S ARNr, de la cepa silvestre, como blanco en el diseño de los oligonucleótidos específicos de una especie y/o de un serotipo. Asimismo, se utilizó información bibliográfica donde se realizaron estudios con oligonucleótidos validados para la especie 1,2.
Análisis estadístico
Se utilizaron frecuencias absolutas en porcentaje. Las comparaciones entre poblaciones se realizaron utilizando Test Student-T con un nivel de significancia de 0.05.
Resultados
Como se mencionó anteriormente, los microorganismos A. actinomycetemcomitans, P. gingivalis y P. intermedia fueron analizados tanto a través de técnicas bacteriológicas tradicionales como moleculares. Se constató una alta correlación de los resultados obtenidos por ambas técnicas, con un nivel de concordancia igual o superior al 85% (95% para A. actinomycetemcomitans, 93% para P. intermedia y 85% para P. gingivalis). De todas formas, en caso de diferencias en los resultados obtenidos entre ambas técnicas se consideró como válido el resultado obtenido a través de la técnica molecular siendo los resultados que se presentan en este trabajo.
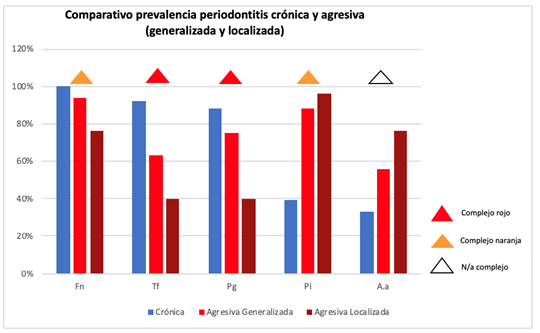
En los cuadros de periodontitis crónica el microorganismo más prevalente fue F. nucleatum del complejo naranja, presentándose en el 100% de los pacientes. Además, se presentaron en una gran proporción de los casos (en un entorno del 90%) los microorganismos T. forshyta y P. gingivalis del complejo rojo. P. intermedia del complejo naranja se recuperó en un 39% de los pacientes mientras que A. actinomycetemcomitans fue recuperado en pacientes con periodontitis crónica pero su prevalencia fue notoriamente inferior (33%) (Gráfica 1).
En ambos cuadros agresivos, también destacó F. nucleatum del complejo naranja, siendo el microorganismo más prevalente en los cuadros generalizados al igual que en la periodontitis crónica (Gráfica 2).
El otro microorganismo del complejo naranja estudiado, Prevotella intermedia, fue más prevalente que en los cuadros crónicos, en particular en los cuadros localizados donde fue el microorganismo más predominante (Gráfica 3)
Por otra parte, en los cuadros agresivos, hallamos una mayor prevalencia de A. actinomycetemcomitans y menor de los microorganismos del complejo rojo estudiados (P. gingivalis y T. forshytia) en relación con los cuadros crónicos. En los cuadros agresivos, se observan distintos resultados cuando se diferencia entre los cuadros generalizados y localizados. Mientras los microorganismos del complejo rojo fueron de mayor relevancia en los cuadros generalizados, A. actinomycetemcomitans lo fue en los cuadros localizados si bien en ambos casos se presentó mayor prevalencia que en los cuadros crónicos (Gráficas 2 y 3).
A modo de facilitar el análisis comparativo de la prevalencia de cada especie bacteriana estudiada entre los diferentes cuadros se presenta la siguiente gráfica y tabla. (Gráfica 4 y Tabla 1)
Tabla 1: Comparativo prevalencia P. crónica, P. agresiva generalizada, P. agresiva localizada
| Fn | Tf | Pg | Pi | Aa | |
|---|---|---|---|---|---|
| Crónica | 100% | 92% | 88% | 39% | 33% |
| Agresiva Generalizada | 94% | 63% | 75% | 88% | 56% |
| Agresiva Localizada | 76% | 40% | 40% | 96% | 76% |
Fn= Fusobacterium nucleatum, Tf= Tannerella forsythia, Pg= Porphyromonas gingivalis, Pi= Prevotella intermedia, Aa = Agreggatibacter actinomycetemcomitans
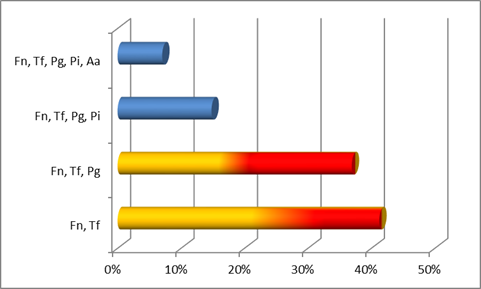
Cuando consideramos la co-detección de especies en los cuadros, en donde probablemente los microorganismos estén conformando clusters o asociaciones, pudimos observar los siguientes patrones para la periodontitis crónica (Gráfica 5) , periodontitis agresiva generalizada (Gráfica 6) y periodontitis agresiva localizada (Gráfica 7). Como puede observarse la co-detección más común que encontramos en el caso de crónica fue F. nucleatum con T. forsyhtia seguida por la asociación de F.nucleatum, T. forsythia y P. gingivalis (ambos microorganismos del complejo rojo).
Asimismo, la co-detección más común en los dos cuadros agresivos fue F. nucleatum y P. intermedia. En el caso de los cuadros Agresivos Generalizados le siguió en importancia la co-detección de F. nucleatum, P. intermedia con P. gingivalis mientras que en los cuadros Agresivos Localizados fue seguido por F. nucleatum, P. intermedia (ambos del complejo naranja) con A. actinomycetemcomitans.
Se puede notar que la microbiota analizada en los cuadros de Periodontitis Agresiva Generalizada se asemejó más con los cuadros de Periodontitis Crónica (mayor representación del complejo rojo) que los cuadros de Periodontitis Agresiva Localizada. Con relación a A. actinomycetemcomitans y P. intermedia ambos cuadros agresivos presentaron mayor proporción que los cuadros crónicos.
Discusión
Se reconoce a la placa dental como un biofilm. Los microorganismos se estructuran en un orden que no es aleatorio y esto motiva a que ciertas especies se encuentren más frecuentemente asociadas a determinadas especies que a otras 9,11
Algunas especies presentan una cantidad limitada de interacciones con otras especies y otras actúan como puentes como es el caso de F. nucleatum que se adhiere a una vasta cantidad de especies 16.
En los pacientes uruguayos estudiados, los microorganismos más prevalentes en los cuadros de periodontitis crónica fueron F. nucleatum del complejo naranja y los microorganismos T. forshyta y P. gingivalis del complejo rojo de Socransky.
No es de extrañar que los dos últimos microorganismos estén presentes en estas altas proporciones en los pacientes con cuadros de periodontitis crónica ya que son microorganismos estrechamente asociados con la etiopatogenia de la enfermedad 3.
Por otra parte, en los cuadros agresivos, estos microorganismos del complejo rojo aparecieron en menor proporción respecto al crónico, en particular para los casos localizados. Este patrón de mayor importancia del complejo rojo en los cuadros generalizados respecto a los localizados es concordante con estudios en otras geografías 13.
La alta presencia de F. nucleatum que detectamos tanto en los cuadros crónicos como agresivos puede explicarse por su relevancia en la adhesión bacteriana ya que expresa múltiples adhesinas que permiten que se unan colonizadores tardíos. Además, F. nucleatum puede tolerar mayores concentraciones de oxígeno que P. gingivalis lo que facilita la generación de condiciones de reducción de oxígeno lo que promueve el crecimiento y desarrollo de éste último y de otras especies anaerobias estrictas 16. F. nucleatum también puede elevar el pH a través de la generación de amoníaco lo que neutraliza el ácido producido por los microorganismos fermentadores creando un ambiente más favorable para P.gingivalis y otros organismos sensibles al ácido 16.
En lo que respecta al microorganismo P. intermedia del complejo naranja apareció en muy alta proporción en los cuadros agresivos respecto a los casos crónicos. El que aparezca en baja proporción en los cuadros crónicos en nuestros pacientes es similar a otros estudios que relatan que sujetos con altas proporciones de P. gingivalis presentaban poca o nula presencia de P. intermedia3.
Nuestros resultados en donde P. intermedia fue el microorganismo más prevalente en los casos agresivos, son comparables a lo reportado en otras investigaciones de Alemania y África 17,18.
En contraste, hay estudios en Corea y Australia que relatan mayor presencia de P. intermedia en crónico y formas agresivas generalizadas respecto a las agresivas localizadas 19,20.
Debemos tener presente que las especies del complejo naranja como P. intermedia y F. nucleatum permiten la colonización de los microorganismos del complejo rojo 3 por lo que los altos números que recuperamos de F. nucleatum en los tres tipos de periodontitis y de ambas especies en las periodontitis agresivas (PAG y PAL) son reveladores.
En cuanto A. actinomycetemcomitans se pudo observar la mayor prevalencia en los cuadros agresivos respecto a los crónicos en nuestros pacientes (y con mayor hincapié en los localizados) lo cual es compatible con la importancia de este microorganismo en los cuadros agresivos en particular en los cuadros localizados 3.
Conclusiones
De los estudios realizados para los microorganismos analizados y del comparativo entre los diferentes cuadros de periodontitis, se desprende que en nuestro país se presenta una microbiota similar a la que figuran en otras localizaciones 3,21. En los cuadros agresivos el microorganismo A. actinomycetemcomitans apareció en mayor número que en los cuadros generalizados lo cual es compatible con estudios realizados en otros países 3,5.
Los microorganismos del complejo rojo, T. forsythia y P. gingivalis, se destacaron particularmente en los procesos crónicos y también más en los agresivos generalizados respecto a los localizados.
Por otro lado el microorganismo F.nucleatum destacó en todos los cuadros pero particularmente en los cuadros crónicos y agresivos generalizados donde probablemente su rol en la comunidad bacteriana es clave. Algo similar ocurrió con el microorganismo P. intermedia del complejo naranja que predominó en los cuadros agresivos y en particular en los localizados.
Se encontró una mayor similitud entre la microbiota estudiada entre los cuadros agresivos generalizados y los cuadros crónicos que entre los agresivos localizados y los cuadros crónicos. Asimismo, en los cuadros agresivos se destaca una mayor proporción de A. actinomycetemcomitans y P.intermedia respecto a los crónicos si bien éstos son más prevalentes en los agresivos localizados respecto a los generalizados.











 texto en
texto en