Introducción
La diabetes se ha convertido en uno de los mayores problemas de salud mundial del siglo XXI. 1 L a prevalencia de diabetes en los países de América Latina se estima en un 8% de la población general, de los cuales aproximadamente un 50% no tiene diagnóstico. 2
Una de las principales complicaciones crónicas es la neuropatía diabética, que se manifiesta con diversos patrones clínicos, siendo la polineuropatía diabética (PND) la forma más frecuente de presentación. 3
La PND es uno de los factores responsables del pie diabético, determinante de discapacidad, de ulceraciones y amputaciones, responsable de alteraciones de la marcha y lesiones relacionadas con caídas. 4,5 Es por tanto una situación clínica que incide directamente sobre la calidad y expectativa de vida de estos pacientes.
Por otro lado, pese a que puede estar presente incluso en prediabetes (glucemia de ayuno alterado, intolerancia a hidratos de carbono), suele ser la repercusión más tardíamente diagnosticada. (6
Su prevalencia es difícil de establecer debido a la ausencia de criterios diagnósticos unificados, a la multiplicidad de métodos diagnósticos y a la heterogeneidad de las formas de presentación clínica. 7-9
Se considera que del 50 al 75% de los diabéticos, padecerán neuropatía entre 5 a 10 años posteriores al inicio de la enfermedad, afectando tanto a pacientes con Diabetes Mellitus tipo 1 (DM1) como con Diabetes Mellitus tipo 2 (DM2).
Se estima que de cada 100 paciente con diabetes, 25 refieren síntomas de neuropatía, en 50 se demuestra afección neuropática en el examen físico y casi en 90 hay señales de afectación neuropática en las pruebas neurofisiológicas. 10
La evolución y gravedad de la PND se correlaciona con el mal control metabólico de la enfermedad. Los factores de riesgo tradicionalmente relacionados son: hiperglucemia, aumento del valor de la hemoglobina glicosilada (HbA1C), edad del paciente y el tiempo de evolución de la diabetes. 10
El factor modificable más fuertemente asociado a la aparición de PND es la hiperglucemia y su duración. Existen evidencias que el estricto control glucémico puede prevenir la aparición de la PND o enlentecer su evolución, por lo que debe considerarse el principal factor de riesgo.
Este enunciado está demostrado en el estudio DCCT en DM1, donde el tratamiento intensivo con insulina redujo la incidencia de neuropatía clínica en un 60%. 11
El estudio UKPDS en DM2 demostró que el tratamiento intensivo de la glucemia reducía el riesgo de complicaciones microvasculares en un 25%, fundamentalmente retinopatía y nefropatía.12,13) A la luz de estos resultados y de nuevos estudios se determinó que el tratamiento de la hiperglucemia en DM1 reduce la incidencia de neuropatía; sin embargo, en DM2 el control de la glucemia “per se” determina sólo una reducción marginal de 5 a 7% en el desarrollo de la misma.
Otros factores de riesgo modificables en el desarrollo de PND, tal como lo demostró el estudio EURODIAB son hipertensión arterial, dislipemia y obesidad. 13
Factores de riesgo adicional son el tabaquismo, resistencia a la insulina e hipovitaminosis D. 14,15
La evaluación de síntomas neuropáticos utilizando cuestionarios validados y pruebas clínicas, junto a una historia detallada para excluir otras etiologías, constituyen el pilar diagnóstico de la PND.
Se debe contar al menos con dos pruebas positivas, las mismas son la demostración de déficit sensitivos y/o motores a la percepción cutánea del calor/ frío, termoalgesia, presión, vibratoria, dolor punzante o alteración de los reflejos.16-19
Otros estudios de mayor sensibilidad diagnóstica pero que habitualmente no se usan en la práctica clínica son los estudios sensoriales cuantitativos, neurofisiológicos, biopsia cutánea y microscopia focal concorneal (MFC). 20,21
Dada la alta prevalencia de la neuropatía diabética como complicación crónica, la relevancia de sus consecuencias, así como la ausencia de publicaciones en nuestro medio, se realiza el presente estudio en el ámbito de una unidad de diabetes.
Los objetivos son establecer la prevalencia de PND en la Unidad de Diabetes, relacionarlo con la enfermedad diabética del paciente, valorar la asociación de la misma con otras complicaciones crónicas y evaluar el rendimiento diagnóstico de NDS (Neuropathy Disability Score).
Material y métodos
Se realizó un estudio descriptivo, observacional, transversal, entre setiembre y noviembre de 2018 en la Unidad de diabetes de un hospital general.
Criterios de inclusión: todos los pacientes con DM1 y DM2, entre 15 y 70 años, que por lo menos hubieran consultado en dos oportunidades en el año anterior al estudio, que dieron consentimiento informado para el estudio.
Criterio de exclusión: antecedentes de amputación de miembros inferiores (MMII), enfermedad renal crónica conocida estadio V (filtrado glomerular < 15 ml/min) y /o paciente en hemodiálisis), alcoholismo (consumo etanol mayor 30gr/día en el hombre y 20gr/día en la mujer), arteriopatía de MMII (documentada por doppler arterial o informe cirujano vascular), hipotiroidismo sin tratamiento, enfermedades del tejido conectivo, enfermedades vertebro medulares (demostrada por estudio de imágenes TAC, RNM o estudio de conducción nerviosa), úlceras definidas oportunamente que impidan examen neurológico .
Las variables analizadas fueron: edad, sexo, tiempo de la diabetes, HbA1C, tabaquismo, obesidad (IMC), dislipemia y repercusiones crónicas.
Tabaquismo: adicción crónica generada por el tabaquismo que produce dependencia física y psicológica, así como gran número de enfermedades. Se considera fumador hasta 6 meses de abandonar el hábito.
Obesidad valorada de acuerdo a IMC: bajo peso < 18.49 kg/m2; normopeso: 18.5 - 24.9 kg/m2; sobrepeso 25 - 29.9 kg/m2; obesidad > 30 kg/m2.
Retinopatía: informe oftalmológico.
Dislipemia: LDL > 100 mg/dl; triglicéridos > 150mg/dl .
Enfermedad renal crónica (ERC): creatinina > 1,5mg/dl o proteinuria positiva o FG < 60 ml/min.
Los test utilizados para el diagnóstico de PND, como la escala de síntomas TSS (total Sympton Score) y de signos NDS (Neuropathy Disability Score), son validados a nivel internacional, utilizándose en distintos ensayos clínicos.
El diagnóstico de PND se estableció de la siguiente manera:
NDS: Es una escala de 4 signos: percepción de temperatura, vibración, presión y reflejo aquilino. Se realizó una modificación, utilizada en otro estudio, que consistió en evaluar la presión a través de un monofilamento de 10 gr. El test original usa el pinchazo con alfiler que actualmente está en desuso ya que puede causar lesiones en los pacientes con sensibilidad disminuida. En cambio el monofilamento no tiene este inconveniente, está validado como herramienta y su uso es universal. El puntaje para cada signo es: 0 si la percepción está conservada, 1 si está alterada, con excepción del reflejo Aquileo, que es 0 si es normal, 1 si está disminuido y 2 si está ausente (Anexo 1).
TSS: Es una escala que contempla 4 síntomas: dolor quemante, dolor lancinante, adormecimiento y hormigueo o parestesias. Se les adjudica un puntaje, teniendo en cuenta la frecuencia y severidad de cada uno 22) (Anexo2).
La recolección de los datos, así como la evaluación de síntomas y signos fue realizada por diabetólogos entrenados.
Las variables cualitativas se presentan como valores absolutos y porcentajes, las variables cuantitativas se resumen con la media ± desvío estándar (DS). Para investigar asociación entre variables cualitativas se utilizó el test de chi cuadrado y para comparar variables cuantitativas el test de Mann Whitney. Valores p < 5% se consideraron significativos.
Resultados
Se analizaron 81 pacientes que cumplían los criterios de inclusión. En la Tabla 1 se presentan las características epidemiológicas de los mismos.
En la Tabla 2 se presentan los hallazgos del control metabólico determinado por el valor de la HbA1C.
En la Tabla 3 se muestra la presencia de otros factores de riesgo modificables
Se encontró que 4/18 (22,2%) de los pacientes DM1 y 7/63 (11,1%) de los pacientes DM2 presentaban retinopatía diabética, mientras que 2/18 (11,1%) de los DM1 y 10/63 (15,9%) de los DM2 tenían ERC.
La presencia de PND estaba presente en 28/81 pacientes (34,6%).
En la Tabla 4 se presentan las características epidemiológicas de esta población.
Tabla 4: Características epidemiológicas población con y sin PND.† Test de chi cuadrado ¶ Test U de Mann Whitney * Valor p significativo

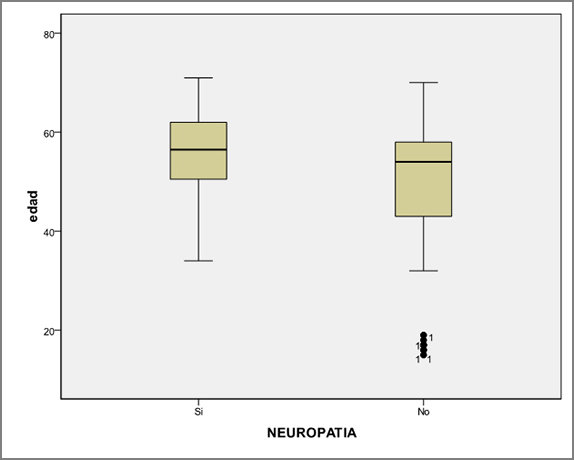
En el Gráfico 1 se presenta la relación entra la presencia de PND y la edad del paciente.
En el Gráfico 2 se representa la presencia de PND en relación al tiempo de evolución de la DM.
En la Tabla 5 se presentan los hallazgos del control metabólico determinado por el valor de la HbA1C.
Tabla 5: Control metabólico de la población con y sin PND. † Test de chi cuadrado ¶ Test U de Mann Whitney * Valor p significativo

En el Gráfico 3 se representa la relación entre la presencia de PND y el control metabólico según HbA1C.
En la Tabla 6 se muestra la presencia de otros factores de riesgo modificables.
Tabla 6: Factores de riesgo de la población. † Test de chi cuadrado ¶ Test U de Mann Whitney * Valor p significativo

En la Tabla 7 se muestra la presencia de otras repercusiones de estos pacientes.
Tabla 7: Repercusiones de la población. † Test de chi cuadrado ¶ Test U de Mann Whitney * Valor p significativo

El diagnóstico se realizó en 27 casos (96.5%) por el criterio de la escala NDS ≥ 6, y solo en 1 caso fue por la escala TSS ≥5 (NDS 3-5).
Al evaluar el rendimiento diagnóstico de los signos considerados en el NDS en el grupo de pacientes con PND, se encontró que el 100% tenía alteración de los reflejos osteotendinosos, el 89% presentó apalestesia, el 44% tenía ausencia de respuesta al monofilamento y el 17.9% tenía pérdida de la termosensibilidad.
Del total de pacientes con PND, 18/28 (64%) presentaba síntomas. Esta subpoblación sintomática incluyó a 15/18 pacientes con DM2 (83%) y 3/18 con DM1 (17%); corresponden al sexo femenino 10/18 (55,6%). No se encontró asociación significativa entre sexo y síntomas (valor p=0.7 en DM1 y 0,07 en DM2).
Un número no despreciable de pacientes 17/53 (32%) presentaba alteraciones en el test NDS (valor 3-5); es decir que presentaban alteraciones al examen, pero no alcanzan el diagnóstico de neuropatía por los criterios establecidos.
Discusión
La población analizada en este estudio es mayoritariamente de sexo femenino, y tal cual se conoce de la epidemiología de esta enfermedad, predomina la DM2, con edades y tiempo de evolución acordes al tipo de diabetes analizada.
Tanto en los pacientes con DM1 como DM2 se constata un mal control metabólico con valores de HbA1C por encima de los objetivos.
La presencia de sobrepeso/obesidad y dislipemia presentan alta prevalencia en DM2 (91.1% y 71,4% respectivamente), elementos que apuntan al alto riesgo cardiovascular de esta población. Se destaca la presencia de sobrepeso /obesidad y dislipemia en DM1 que llega al 38,9% y 11% respectivamente, lo cual determina un llamado de atención y nos lleva a tener un enfoque proactivo en la corrección de estos factores también en pacientes con DM1.
El porcentaje de pacientes fumadores con neuropatía es más bajo que el de aquellos sin neuropatía, no comportándose con un factor de riesgo jerárquico en nuestra población de pacientes con PND.
La prevalencia de PND en nuestra serie fue de 34.6%, cifras superiores al 25% encontrado por Mendivil en Colombia en población con DM223) y al 22% del trabajo de Sarturi-Tres en Brasil.24) Sin embargo otros estudios como el de Aliss Samur e Ibarrar enMéxico encontraron una prevalencia de PND mayor 81% y 69% respectivamente. 25,26
Esta variabilidad la podemos explicar por los pacientes incluidos en los distintos estudios y los criterios diagnósticos empleados en cada uno de ellos.
No encontramos relación estadísticamente significativa cuando se analiza el sexo. Este hallazgo tampoco ha sido encontrado en otros reportes.27
Cuando analizamos aquellos factores que la literatura relaciona con la presencia de PND, como son la edad, control metabólico y tiempo de evolución de la diabetes, en nuestro estudio no se comprueba asociación estadística con respecto a la edad de los pacientes ni con el control metabólico, si bien el grupo de pacientes con PND presentaba una media de HbA1C superior al grupo sin PND (8,4% vs 8.0%).
Uno de los elementos que pudo haber incidido en nuestros resultados es que consideramos en forma aislada la última determinación de HbA1C y no el promedio de los últimos años, tal cual fue considerado en otros estudios.21
Los trabajos actuales indican que un mejor control metabólico, es decir la reducción de la HbA1c, se asocia con disminución en la prevalencia de PND en población con DM1, pero no en DM2, donde son múltiples los factores involucrados en el desarrollo de PND. 10-12
Sin embargo el análisis del tiempo de evolución de la diabetes sí se asoció significativamente con el diagnóstico de PND (p=0,002), tanto en DM1 como en DM2, confirmando que es un factor de riesgo importante y bien reconocido. 15
De los otros factores relacionados con la presencia de PND, no se encontró asociación significativa en el análisis del tabaquismo, sobrepeso/obesidad y dislipemia. Los resultados de otros trabajos son también no concluyentes con respecto a éstos factores.28-30
El análisis de otras repercusiones microangiopáticas, evidenció una asociación significativa de PND con retinopatía (p=0,005), pero no con ERC - aunque ésta fue más frecuente en el grupo con PND (25.0% vs 9.4%).
En relación a la metodología, encontramos un alto rendimiento diagnóstico de los instrumentos utilizados para evaluar reflejos y sensibilidad vibratoria (100% y 89% respectivamente); sin embargo, este rendimiento no llega al 50% cuando hablamos de la sensibilidad a la presión (utilizando el monofilamento) y la sensibilidad térmica.
Particular mención merece el uso del monofilamento ampliamente utilizado como screening de neuropatía y utilizado en distintos trabajos clínicos. Un metaanálisis reciente encuentra una sensibilidad limitada para la detección de PND, concluyendo que el uso clínico del monofilamento no se puede alentar basándose en la evidencia actualmente disponible. 31
Visto que la tercera parte de los pacientes sin PND presentaba de todas maneras alteraciones en algunos de los signos del NDS, nos lleva a plantear que si contáramos con métodos de mayor rendimiento diagnóstico, como los estudios cuantitativos sensoriales, biopsia de piel o MFC, optimizaríamos el diagnóstico, siendo mayor la prevalencia encontrada de PND. (19
La PND sintomática se encontró más frecuentemente en DM2 y en el sexo femenino; si bien este hallazgo no fue significativo, está en concordancia con la bibliografía. Esto podría explicarse por diferencias en los umbrales al dolor; también debemos tener presente que se trata de manifestaciones subjetivas del individuo, necesariamente relacionadas con experiencias vividas anteriormente. Los trabajos muestran predominio en las mujeres, proponiéndose diferentes explicaciones.30-40
Consideramos que se trata de un trabajo que muestra las características de nuestra población, que tiene por fortaleza estrictos criterios de exclusión lo que por un lado reduce la posibilidad de factores de confusión en el diagnóstico de PND, pero por otro, limita el número de pacientes incluidos en el trabajo, ya que este grupo de pacientes es seguramente el que presenta mayor daño neuropático.
Otro elemento que consideramos de importancia ha sido el utilizar para el diagnóstico de PND test validados internacionalmente con criterios clínicos. Apostamos a contar en el futuro con otros test diagnósticos, que permitan optimizar el diagnóstico de esta enfermedad.
Conclusiones
La Prevalencia de PND fue del 34.6%. Se encontró asociación significativa entre la presencia de PND y con el tiempo de evolución de la DM. Es necesario el screening oportuno de PND con instrumentos validados dado que un porcentaje no despreciable de los casos diagnosticados (36%) no presentaba síntomas.