Introducción
El Lupus Eritematoso Sistémico (LES) es una enfermedad autoinmune sistémica de presentación clínica heterogénea 1. Si bien se puede presentar a cualquier edad, frecuentemente se observa mujeres en edad reproductiva 2. En Sudamérica, la tasa estimada de incidencia es alrededor de 1 a 25 casos por cada 100.000 habitantes, con tasas de prevalencia que varían entre 20-70 casos por 100.000 habitantes, documentándose mayor prevalencia y severidad en poblaciones afrocaribeñas 3,4.
El objetivo terapéutico en el LES consiste en disminuir de forma precoz, efectiva y sostenida la actividad de la enfermedad. Es bien conocido que la actividad persistente provoca daño orgánico irreversible y que, a mayor actividad mayor daño. A su vez, el daño acumulado provoca diversos grados de morbilidad y aumenta la mortalidad en el LES 5,6.
El daño en el LES se define como la pérdida de funcionalidad de los órganos o sistemas afectados, tiene un carácter irreversible, y puede ser resultado directo de la actividad de la enfermedad, de los medicamentos empleados para el tratamiento, o bien asociada a enfermedades preexistentes 7-9.
Se estima que aproximadamente dos tercios de los pacientes afectados presentará algún nivel de daño transcurridos 7 años desde el diagnóstico de la enfermedad 7-10. Se han diseñado instrumentos para la medición del daño en esta enfermedad, por su sigla en inglés “Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index”, en adelante “SDI”, que establecen categorías y órganos afectados. El daño debe estar confirmado por un método diagnóstico objetivo y estar presente por al menos 6 meses para definir su presencia 10.
De igual forma, se han diseñado instrumentos para medir los niveles de actividad de la enfermedad. Uno de ellos, ampliamente empleado, es el SLEDAI-2K, por su sigla en inglés “Systemic Lupus Erythematosus Disease Activity Index-2000” 10.
Los pilares del tratamiento del LES se basan en el uso de Hidroxicloroquina, inmunosupresores, glucocorticoides y agentes biológicos 5. Hidroxicloroquina es una antimalárico de síntesis cuya eficacia en el tratamiento del LES es hoy indiscutida. Diversos grupos han confirmado que disminuye el riesgo de trombosis y la mortalidad, tiene un efecto protector sobre las infecciones y es un ahorrador de corticoides, entre otras características 11. Dentro de los inmunosupresores destacan Metotrexato para las manifestaciones cutáneas, articulares y serosas. Azatioprina, fundamentalmente para manifestaciones renales, del Sistema Nervioso y hematológicas 12. En los últimos tiempos ha irrumpido Micofenolato de Mofetilo como un agente inmunosupresor eficaz para el tratamiento de inducción y mantenimiento de la Nefritis Lúpica 12,13. Sin embargo, su uso se ha ampliado extensamente para manifestaciones “fuera de etiqueta”, utilizándoselo como un inmunosupresor de primera línea en manifestaciones graves y de segunda línea cuando fallan alguno de los anteriormente mencionados 12-14.
El arsenal de terapias biológicas en el LES es de menor amplitud que en otras enfermedades inflamatorias y autoinmunes, pero igualmente promisorio. En efecto, existen dos moléculas ampliamente empleadas, Rituximab y Belimumab. El análisis de su utilidad excede ampliamente el alcance de este trabajo, pero vale la pena recordar que el primero de ellos suele ser empleado en casos refractarios o corticodependientes de manifestaciones severas (sistema nervioso central, nefritis, vasculitis, hematológicas) mientras que el segundo en casos refractarios o corticodependientes a tratamientos convencionales, fundamentalmente de la esfera articular, cutánea y serosa 15,16.
El uso de glucocorticoides (GCC) es ampliamente difundido en el tratamiento del LES, en distintas etapas de la enfermedad, ya sea en remisión o, particularmente, en períodos de actividad. Los pacientes suelen estar expuestos por períodos variables, habitualmente prolongados. En períodos de actividad se recurre a su efecto inmunosupresor y antiinflamatorio rápido y efectivo; mientras que en períodos de remisión se propone mantener estos efectos. Su elevada efectividad antiinflamatoria e inmunosupresora contrasta con su perfil de seguridad, caracterizado por una gran amplitud de efectos adversos. En efecto, buena parte de estos efectos adversos, acumulados en el tiempo, constituyen y contribuyen al daño orgánico crónico orgánico e irreversible 17,18).
Es bien conocido que los efectos adversos de los GC son múltiples y afectan, de manera variable, a casi todos los órganos y tejidos del organismo. Está bien establecido que existe una relación lineal entre la dosis y la duración del tratamiento y la aparición de ciertos efectos adversos 19,20). Además, no existe evidencia que respalde la eficacia de dosis altas. Su uso, casi constante, ha contrastado con la falta de protocolos claros sobre dosis máxima, pautas de descenso y suspensión de estos. 19-22
En las últimas décadas se ha observado de forma sistemática que dosis menores a las “habituales o convencionales” de prednisona, de 1 mg/kg/día, son igualmente efectivas e indiscutiblemente más seguras. El desafío, entonces, consiste en identificar la mejor relación beneficio/riesgo de los tratamientos empleados para provocar el menor daño a largo plazo 22.
Este “viejo paradigma” del uso de GC, particularmente del uso de prednisona a 1 mg/kg/día ha marcado a generaciones de médicos. Nada tan arraigado a la práctica profesional como carente de evidencia. Nuestro grupo ha trabajado firmemente en los últimos años sobre este tema. En efecto, hemos confirmado que dosis menores son igualmente efectivas, determinando remisiones precoces y sostenidas en el tiempo y determinando un menor perfil de efectos adversos 20-22.
Dadas las diversas manifestaciones de esta enfermedad y los múltiples posibles riesgos asociados al uso de glucocorticoides, nos propusimos conocer la relación entre la presencia de daño orgánico y su asociación con la exposición a los GC.
Material y Métodos
Se realizó un estudio retrospectivo de pacientes con LES, según criterios clasificatorios del ACR 1997 23 de un único centro, asistidos en el Hospital Pasteur de la ciudad de Montevideo. El Hospital Pasteur es un hospital de tercer nivel asistencial polivalente, de adultos, que cuenta con 220 camas totales, entre cuidados moderados y especializados. Dispone de un policlínico de referencia para ciertas enfermedades que asiste una población total de 100.000 usuarios. Se identificaron todos los pacientes en seguimiento por LES en dicho centro asistencial.
Se analizaron variables demográficas (sexo y edad), tabaquismo, niveles de actividad medido por score SLEDAI-2K, definido en diversos momentos desde el diagnóstico de la enfermedad: T0, al inicio de la enfermedad; T1, al mes; T2, a los 6 meses; T3 a los 12 meses y T4 a los 5 años o al final del seguimiento; dosis de prednisona con que comenzó el tratamiento, acumulada en T1, T2, T3, T4 (con igual criterio cronológico que en el SLEDAI-2K); daño en T2, T3 y T4 medido por estimador de daño "SLICC Damage Index (SDI)" 7,23.
Se excluyeron los casos en los cuales el daño no podía ser estimado, la dosis de glucocorticoides no podía ser verificada, los casos con nefritis lúpica, diabetes, con creatinina mayor oigual a 1,3 mg/dl y los que presentaran daño permanente previo a ser controlados en nuestra Unidad.
El SLEDAI-2K, es un instrumento que permite la revision por sistemas (nervioso central y periférico, cardiovascular, nefrológico, esquelético entre otros), en el interrogatorio, examen físico y analítica del paciente. A cada item se le otorga un puntaje, que finalmente se suma y arroja un puntaje final 24. Dicha puntuación va de 0 a 105 (valor teórico); no obstante, la manifestación de uno o dos signos o síntomas mayores, se catalogará como actividad severa, aunque esta puntuación sea baja y los síntomas restantes se ubiquen en categorías más bajas, ya que prima la importancia de los signos mayores sobre la puntuación y demás signos menores presentes. Para este trabajo se consideró actividad leve: ≤ a 4 puntos, moderada > 4 puntos pero < 8, severa ≥ a 8 puntos. La remisión se define como un puntaje igual a 0 y se considera sostenida si persiste más de 3 meses.
El SDI por su sigla en inglés (Índice de daño) establece el grado de daño tisular desde el inicio de la enfermedad, el cual puede ser resultado de enfermedad previa, intercurrente o tratamiento, y evalúa por separado 12 diferentes sistemas, siendo necesario que los signos y síntomas se manifiesten al menos seis meses previos a la realización de dicha prueba 7.
Para simplificar el análisis se dicotomizó el daño permanente en “relacionado con GCC” (cataratas, osteonecrosis, fractura osteoporótica, diabetes mellitus y miopatía) y “no relacionado con GCC” (neuropsiquiátrico, renal, pulmonar, ocular no catarata, cardiovascular central o periférico, gastrointestinal, musculoesquelético, cutáneo, fallo gonadal prematuro, malignidad), según lo recomendado en la literatura 25.
Las variables cuantitativas se presentan con medidas de tendencia central y dispersión; media y desvío estándar y mediana y rango, según su distribución. La normalidad se probó mediante test de Hipótesis (Shapiro-Wilk) y gráficos. Las variables cualitativas se presentan mediante frecuencias absoluta y relativa. Las comparaciones entre grupos se realizarán mediante Chi2 o Test de Fisher para los datos cualitativos y mediante Test de t de Student o de Wilcoxon, según la distribución, para los datos cuantitativos. Para conocer la influencia de los niveles de actividad en las dosis de prednisona y su relación con el daño orgánico a largo plazo se realizó un análisis de regresión logística binaria. Se tomó el daño como variable dependiente, dicotomizada en “presente o ausente”. Se consideró un nivel de significación estadística menor a 0.05. Los datos se procesaron en el programa informático SPSS.
El trabajo se desarrolló de acuerdo con la Declaración de Helsinki de la Asociación Médica Mundial. Se obtuvo autorización del Comité de Ética Institucional. Los datos fueron tratados con total confidencialidad, para lo cual se anonimizó la información de los participantes.
Resultados
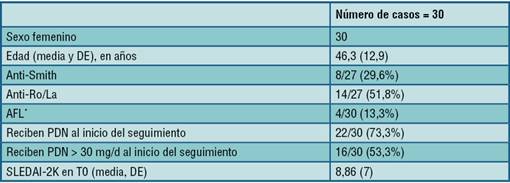
Se analizaron 30 casos, todos de sexo femenino, media de edad 46,3 (DE: 12,9) años, 7/30 fueron fumadoras. La media de seguimiento fue 155 (DE: 127) meses.
Con relación al perfil de autoanticuerpos: 8/27 presentaron anti-Smith; 14/27 anti-Ro/La; 6/28 anti-RNP; anticuerpos antifosfolípidos estuvieron presentes en 4/30 casos (Tabla 1).
Tabla 1: Características basales de la población estudiada. Abreviaturas. DE=desvío estándar; AFL= anticuerpos antifosfolípidos; PDN= prednisona
Los anticuerpos anti-DNA fueron positivos en 14/27 pacientes en T0; 7/27 en T1; 6/27 en T2 y 4/27 en T3 y 3/27 en T4, p< 0,05 entre T0 y T4. La media de SLEDAI en T0 fue de 8,86 (DE: 7), T1: 5,93 (DE: 5), T2: 4,37 (DE: 5), T3: 3,53 (DE: 4,6), T4 2,33 (DE: 3,4); p<0,05 entre los periodos (Gráfico 1).

Gráfico 1: Media de SLEDAI-2K en los distintos momentos considerados. T0: al inicio del tratamiento; T1: al mes de tratamiento; T2: a los 6 meses de tratamiento; T3: a los 12 meses de tratamiento y T4 a los 5 años o final del seguimiento. p < 0.05 entre los períodos
Veintidós pacientes de 30 (73,3%) fueron tratados con prednisona al inicio de la enfermedad. La media de dosis máxima de prednisona al inicio del tratamiento fueron 33,9 (DE 23,8) mg/día; la media de dosis acumulada en T1 (al mes) fue 1085 (DE 1011) mg; en T2 (a los 6 meses) fue de 4125 (DE 3400) mg; a los 12 meses (T3) fue 6314 (DE 5868,4) mg y en T4 (5 años) fue de 7270 (DE 7568,21) mg, rango intercuartílico: 315 - 11235 mg.
Las medianas (intervalo intercuartílico) de SDI observadas en T2 fue 0 (0-1), en T3: 1 (1-1,25, T4: 2 (0-2). Al final del seguimiento 13/30 (43.3%) pacientes presentaron algún nivel de daño orgánico.
Los pacientes que presentaron daño en los dominios relacionados con GCC en T4 tuvieron una media de dosis inicial significativamente superior, 53,3 (DE: 10,3) mg/d vs. 28,3 (DE: 24) mg/d, de los que no presentaron daño, p<0,05 (Gráfico 2).

Gráfico 2: Media e intervalo de confianza 95% de dosis de prednisona al inicio del tratamiento en pacientes que presentan daño permanente por glucocorticoides al final del seguimiento y los que no lo presentan (p < 0,05).
La media de dosis acumulada de prednisona en T1 (1 mes de tratamiento) de los pacientes que presentaron daño relacionado con GCC en T4 fue 1493 (289) mg respecto a los que no presentaron daño, que fue 963 (1120) mg, p<0,05. La media de dosis acumulada (DE) en T2 (6 meses de tratamiento) entre los que presentaron daño relacionado con GCC en T4 (5 años) fue 6930 (3639) mg, mientras que los que no presentaron daño relacionado con GCC en igual plazo fue de 3190 (2835) mg, p < 0,05. La medida de dosis acumulada (DE) en T3 (1 año) entre los que presentaron daño al final del seguimiento (T4) fue 8362,3 (5941,2) mg, mientras que en los que no presentaron daño fue 4198,2 (4913,8) mg considerado el mismo período de seguimiento (p= 0,08).
No hubo diferencias estadísticamente significativas en la media de SLEDAI en T4 en los pacientes que presentan daño relacionado con GCC: 1,33 (DE: 3,26) y los que no presentaron daño: 2,73 (DE: 3,55), p>0,05.
En la Tabla 2 se presenta el plan de tratamiento con GC en el grupo de pacientes con LES.
Tabla 2: Plan de tratamiento con glucocorticoides en lupus (primer año de seguimiento). Notas: PDN, prednisona; MTP, metilprednisolona; AZA, azatioprina; MTX, metotrexato; CFM, ciclofosfamida; MMF, micofenolato de mofetilo

En el análisis de regresión logística binaria, tomando como variable dependiente el daño inducido por corticoides en los dominios atribuidos a éstos (daño presente o ausente) al final del seguimiento (T4), el efecto sobre el daño se observó con dosis de inicio de prednisona mayores a 30 mg/d, independientemente del nivel de actividad medido por SLEDAI-2K en el inicio de la enfermedad (T0), p > 0.05, OR 2,05 (IC 95% 1,5 - 4,0). De igual modo, las dosis acumuladas de prednisona al año (T3) mayores a 3000 mg, se mostraron relacionadas con el daño vinculado al uso de corticoides en los dominios atribuidos a éstos al final del seguimiento (T4), independientemente del nivel de actividad al mes (SLEDAI-2K, T1), p > 0.05. Sin embargo, el análisis de regresión evidenció que el daño en los dominios no atribuidos a los corticoides al final del seguimiento estuvo influenciado por los niveles de actividad iniciales (p < 0.05) independientemente de las dosis de corticoides empleadas al inicio y acumuladas al año.
En relación con el uso de Hidroxicloroquina, se constató que 22/30 (73,3%) recibieron Hidroxicloroquina. En cambio, 2/30 (6,7%) recibieron Metotrexato, 13/30 Azatioprina (43,3%), 8/30 Micofenolato de Mofetilo (26,7%) y 5/30 (16,7%) recibieron Ciclofosfamida. Es de destacar que el dato refiere a si alguna vez recibieron alguno de estos inmunosupresores.
Discusión
Nuestro trabajo muestra una asociación entre el uso de glucocorticoides y el daño permanente en una cohorte de pacientes con Lupus Eritematoso Sistémico. La relación se establece particularmente entre dosis elevadas al inicio y el daño permanente en los dominios relacionados con glucocorticoides del SDI al final del seguimiento.
Es de destacar que, en la captación, y por lo tanto al inicio del tratamiento (T0) los niveles de actividad fueron elevados, lo que condicionó probablemente el uso de dosis altas de glucocorticoides, en particular prednisona. Su eficacia en disminuir la actividad es indiscutible. En efecto, se observa una disminución clara de los niveles de actividad en los distintos cortes temporales (un mes, seis meses, al año y a los cinco años), con diferencia estadística entre sí.
Estas observaciones son consistentes con los objetivos del tratamiento del LES, que implican, entre otros aspectos, disminuir los niveles de actividad de la enfermedad, de forma precoz y sostenida en el tiempo 5. Se dispone de una amplia gama de terapéutica para ello, pero los glucocorticoides siguen concitando atención por su rápido y eficaz efecto antiinflamatorio.
Nuestras observaciones están en línea con trabajos pioneros sobre este tema. En el año 2000, el grupo de la cohorte del John Hopkins, que lidera Michele Petri, con más de 1000 pacientes durante más de 30 años, comprobó que las dosis acumuladas de prednisona se relacionaban con diferencias estadísticamente significativas con osteonecrosis, enfermedad coronaria y cataratas. A su vez, cada 2 meses de exposición a dosis elevadas (mayores a 60 mg/día) aumentó un 20 % el riesgo de necrosis avascular de la cabeza femoral y ataque cerebrovascular. Estos efectos no se comprobaron para el uso de pulsos de metilprednisolona al inicio del tratamiento 18,26.
Estas observaciones fueron corroboradas en estudios posteriores del grupo del Hospital de Cruces (Bilbao). Ruiz-Irastorza et al. observaron un 38% de daño acumulado a 5 años, comparable a nuestras observaciones. Asimismo, comprobaron que los pacientes que recibían dosis medias o altas de glucocorticoides, mayores a tan sólo 7,5 mg/día al final del cuarto año de seguimiento, presentaron un OR de 5,39 (IC 95% 1,59 -18,27) de presentar daño permanente, en dominios relacionados y no relacionados con glucocorticoides.
Llamativamente, y en línea con otras observaciones, los pulsos de metilprednisolona no se relacionaron con riesgo de daño permanente en ninguno de los dominios 27,28.
En el mismo sentido, Apostolopoulos et al., en una cohorte de 162 pacientes, observaron datos similares a los nuestros, encontrando que 75% de los pacientes habían recibido prednisolona y que más de la mitad presentaban algún nivel de daño en 7 años, con valores comparables a los nuestros. Los autores encontraron una asociación firme entre la exposición a glucocorticoides y la probabilidad de desarrollar daño, observando que a mayores dosis mayores daño, independientemente de si se consideraran dominios relacionados o no con glucocorticoides. Esta asociación se mostró independientemente del nivel de actividad de la enfermedad, algo similar a lo que ocurrió en nuestro trabajo 29.
Nuestros datos confirman una relación entre la dosis de glucocorticoides y el daño inducido por éstos, de forma dosis-dependiente. En efecto, dosis de inicio mayores a 30 mg/día se asociaron con el doble de chance de daño en los dominios relacionados con glucocorticoides al final del seguimiento. Esta observación no se confirmó para los dominios no relacionados con glucocorticoides. En la regresión logística, esta asociación persistió, independientemente de los niveles de actividad considerados. De igual modo, dosis acumuladas al año por encima de 3000 mg se asociaron con daño al final del seguimiento en los dominios relacionados con glucocorticoides, no así en los no relacionados.
Curiosamente, en nuestra casuística, ningún paciente recibió pulsos de metilprednisolona, algo otrora planteado sólo para casos graves a muy graves. De igual modo, si bien es conocido que el uso de hidroxicloroquina es la piedra angular del tratamiento del LES con una eficacia indiscutible y un perfil de seguridad muy favorable, llama la atención que casi una cuarta parte no la recibieran 30. La mayoría de los pacientes (28/30) recibieron algún inmunosupresor para el tratamiento. El diseño del trabajo no permite identificar si la introducción fue precoz, dentro del primer mes de diagnóstico, o tardía. En el primer caso, permitirían ahorrar corticoides y evitar la acumulación de dosis elevadas al final del primer año.
Ninguna de estas dosis elegidas es casual. La primera, 30 mg/día de prednisona, es la dosis que, nuestro grupo, ha venido postulando como “dosis máxima” de prednisona vía oral, en contraposición a los clásicos esquemas de 1 mg/kg/día. La segunda, porque nuestro esquema terapéutico postula no acumular dosis mayores a 3 gramos en un año, en particular durante el primer año de seguimiento (Tabla 2).
Para lograr esto, es fundamental introducir precozmente inmunosupresores y asociar pulsos de metilprednisolona para evitar emplear dosis elevadas (mayores a 30 mg/día) de prednisona. En efecto, diversos trabajos concluyen que el uso de metilprednisolona permite emplear dosis más bajas de prednisona “de salida” y no se han relacionado con daño orgánico permanente 27-29.
Estas consideraciones están basadas, no sólo en observaciones clínicas bien documentadas, sino que tienen sólidos fundamentos farmacológicos. Los glucocorticoides actúan por dos vías: genómica y no genómica 31,32. La primera es la vía “clásica”, por la cual la molécula del glucocorticoide se une a un receptor citosólico que es trasportado al núcleo celular y allí regula, en más o en menos, la transcripción genética de moléculas involucradas en el proceso inflamatorio y en los efectos adversos. Esta vía está expresada en todas las células del organismo y se ha postulado que tiene su techo antiinflamatorio a dosis de prednisona o equivalente de 30 a 40 mg. Luego de estas dosis la capacidad de modular en menos la transcripción génica de moléculas vinculadas al proceso inflamatorio es prácticamente nula, al tiempo que su capacidad de modular moléculas relacionadas con los efectos adversos, está activa y es dosis-dependiente. La vía no genómica, más novedosa, estaría especialmente expresada en las células inflamatorias y consiste en la modulación de un receptor de membrana y de vías intracelulares no relacionadas con el receptor citosólico de los glucocorticoides. Esta vía se activa con dosis de prednisona o equivalente mayores a 100 mg y es especialmente sensible a dos moléculas, metilprednisolona y dexametasona. Esta es la razón por la cual nuestro grupo promueve el uso de estas moléculas en los brotes, en lugar de dosis de prednisona mayores a 30-40 mg, que no logran reclutar la vía no genómica y a la cual la vía genómica está reclutada de forma casi completa (31-33.
Nuestro trabajo tiene debilidades por su carácter retrospectivo, el muestreo no probabilístico considerado y el reducido número de casos. Probablemente, esta es la razón por la cual no pudimos comprobar el efecto protector del uso de Hidroxicloroquina sobre el daño relacionado al uso de glucocorticoides, observado por otros autores. Sin embargo, es la primera vez que en nuestro medio se explora la relación entre el daño orgánico en lupus y la exposición a los glucocorticoides. En efecto, se observa una relación precoz con el daño a largo plazo.
Conclusiones
Si bien los niveles de daño en nuestra cohorte son bajos, se observa un aumento con el tiempo y una relación clara con la exposición al uso de GCC. Se destaca que la relación es temprana, es decir, la dosis de inicio probablemente signará la acumulación de daño, especialmente en los dominios relacionados con glucocorticoides, independientemente de los niveles de actividad. Existe evidencia creciente que dosis más bajas pueden ser igualmente efectivas y más seguras. Deben continuarse estas exploraciones para establecer conclusiones más robustas.















